Занятие 8 основные понятия биоорганической химии. Изомерия органических соединений
 Скачать 0.85 Mb. Скачать 0.85 Mb.
|
|
| |
Тетраэдрическую модель одного из энантиомеров (рис. 10) располагают в пространстве так, чтобы цепь атомов углерода оказалась в вертикальном положении, а карбоксильная группа - сверху. Связи с неуглеродными заместителями (Н и ОН) у хирального центра должны быть направлены к наблюдателю.
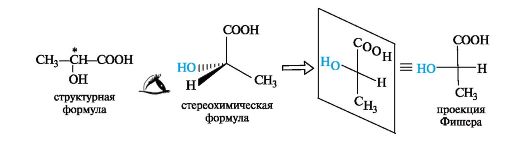
Рис. 10. Построение проекционной формулы Фишера (+)-молочной кислоты
После этого модель проецируют на плоскость. Символ асимметрического атома при этом опускается, под ним понимают точку пересечения вертикальной и горизонтальной линий.
Тетраэдрическую модель хиральной молекулы перед проецированием можно располагать в пространстве по-разному, не только так, как показано на рис. 7. Необходимо только, чтобы связи, образующие на проекции горизонтальную линию, были направлены к наблюдателю, а вертикальные связи - за плоскость рисунка.
Полученные таким образом проекции можно с помощью несложных преобразований привести к стандартному виду, в котором углеродная цепь расположена вертикально, а старшая группа (в молочной кислоте это СООН) - сверху. Преобразования разрешают две операции:
• в проекционной формуле разрешается менять местами два любых заместителя у одного и того же хирального центра четное число раз (двух перестановок бывает достаточно);
• проекционную формулу разрешается поворачивать в плоскости рисунка на 180° (что эквивалентно двум перестановкам), но не на 90°.
Тетраэдрическую модель строения органических соединений предложили Я.Г.Вант-Гофф и Ж.А.Ле-Бель в 1874 г. Они пришли к выводу, что если две молекулы являются стереоизомерами, то их можно описать зеркальными формулами, и если один изомер вращает плоскость поляризации влево, то второй должен вращать вправо. По знаку вращения можно определить относительную конфигурацию стереоизомеров. Однако между абсолютной конфигурацией, т.е. истинным расположением групп вокруг данного хирального центра, и знаком вращения прямого соответствия нет. Определить абсолютную конфигурацию химическими методами, если не известна абсолютная конфигурация хотя бы одного хирального реагента (а так и было вначале), невозможно. Спектральные методы могут дать информацию только об относительной конфигурации. В настоящее время существуют лишь два метода независимого определения абсолютной конфигурации: теоретический расчет и исследование аномальной дифракции рентгеновских лучей на ядрах тяжелых элементов.
Но в конце XIX - начале XX века этих методов не существовало и поэтому химики придумали следующий выход. Решили взять в качестве стандарта какое-нибудь одно соединение и произвольно приписать ему одну из возможных абсолютных конфигураций. Выбор пал на глицериновый альдегид по той причине, что он структурно связан с сахарами, которые в то время изучал Эмиль Фишер. (+) - Изомеру была приписана абсолютная конфигурация и он был обозначен буквой D (dextriogyrus - правый), а соответствующий (-) - изомер - буквой L (laevogyrus - левый). Как только был выбран стандарт, стало возможным соотносить с ним конфигурацию других соединений. Например, при окислении с помощью HgO (+)-глицериновый альдегид дает (-)-глицериновую кислоту. Данная реакция не затрагивает асимметричский атом, поэтому очень мало вероятно, чтобы его конфигурация изменилась, и следовательно (-)-глицериновая кислота относится к D - ряду.

Отнесение к D- или L-ряду других родственных по структуре оптически активных соединений производится путем сравнения конфигурации их асимметрического атома с конфигурацией D- или L-глицеринового альдегида. Например, у одного из энантиомеров молочной кислоты (I) в проекционной формуле группа ОН находится слева, как у L-глицеринового альдегида, поэтому энантиомер (I) относят к L-ряду. Из тех же соображений энантиомер (II) относят к D-ряду. Так из сравнения проекций Фишера определяют относительнуюконфигурацию.
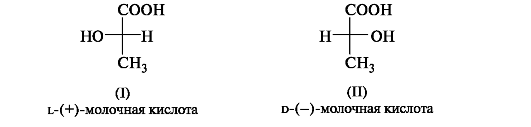
Следует отметить, что L-глицериновый альдегид имеет левое вращение, а L-молочная кислота - правое (и это не единичный случай). Более того, одно и то же вещество может быть как лево-, так и правовращающим в зависимости от условий определения (разные растворители, температура).
Стереоизомерия молекул с двумя и более центрами хиральности: энантиомерия и диастереомерия. Мезоформы. Рацемические смеси.
Диастереомерами называют стереоизомеры, не относящиеся друг к другу, как предмет и несовместимое с ним зеркальное отражение, т. е. не являющиеся энантиомерами.
Наиболее важными группами диастереомеров являются σ-диастереомеры и π-диастереомеры.
| |
σ-Диастереомеры. Многие биологически важные вещества содержат в молекуле более одного центра хиральности. При этом возрастает число конфигурационных изомеров, которое определяется как 2n, где n - число центров хиральности. Например, при наличии двух асимметрических атомов соединение может существовать в виде четырех стереоизомеров (22 = 4), составляющих две пары энантиомеров.
2-Амино-3-гидроксибутановая кислота имеет два центра хиральности (атомы С-2 и С-3) и, следовательно, должна существовать в виде четырех конфигурационных изомеров, один из которых является природной аминокислотой.
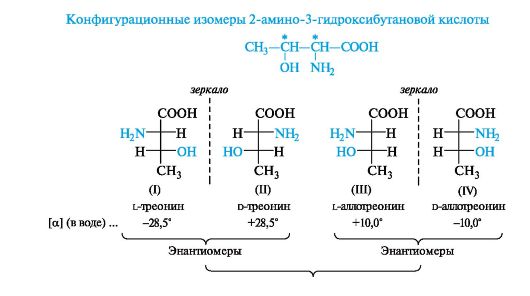
Структуры (I) и (II), соответствующие L- и D-треонину, а также (III) и (IV), соответствующие L- и D-аллотреонину (от греч. alios - другой), относятся друг к другу, как предмет и несовместимое с ним зеркальное отражение, т. е. они представляют собой пары энантиомеров. При сопоставлении структур (I) и (III), (I) и (IV), (II) и (III), (II) и (IV) видно, что в этих парах соединений у одного асимметрического центра конфигурация одинаковая, а у другого - противоположная. Такие пары стереоизомеров представляют собой диастереомеры. Подобные изомеры называют σ-диастереомерами, так как заместители в них связаны с центром хиральности σ-связями.
Аминокислоты и гидроксикислоты с двумя центрами хиральности относят к D- или L-ряду по конфигурации асимметрического атома с наименьшим номером.
Диастереомеры, в отличие от энантиомеров, различаются физическими и химическими свойствами. Например L-треонин, входящий в состав белков, и L-аллотреонин имеют разные значения удельного вращения (как показано выше).
Мезосоединения.Иногда в молекуле содержатся два асимметрических центра и более, но молекула в целом остается симметричной. Примером таких соединений может служить один из стереоизомеров винной (2,3-дигидроксибутандиовой) кислоты.
| |
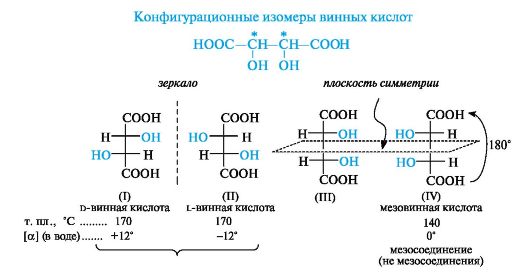
Теоретически эта кислота, в которой имеется два центра хиральности, могла бы существовать в виде четырех стереоизомеров (I)-(IV).
Структуры (I) и (II) соответствуют энантиомерам D- и L-ряда (отнесение проведено по «верхнему» центру хиральности). Может показаться, что структуры (III) и (IV) также соответствуют паре энантиомеров. В действительности это формулы одного и того же соединения - оптически неактивной мезовинной кислоты. В идентичности формул (III) и (IV) легко убедиться, повернув формулу (IV) на 180°, не выводя ее из плоскости. Несмотря на два центра хиральности, молекула мезовинной кислоты в целом является ахиральной, так как имеет плоскость симметрии, проходящую по середине связи С-2-С-3. По отношению к D- и L-винным кислотам мезовинная кислота является диастереомером.
Таким образом, существует три (а не четыре) стереоизомера винных кислот, не считая рацемической формы.
Рацемическая смесь (racemic mixture) - смесь в равных пропорциях двух энантиомеров- веществ, проявляющих оптическую активность. Один из них - правовращающий, т.е. поворачивающий плоскость поляризации света, проходящего через него, в правую сторону; другой - левовращающий, отличается только направлением поворота. В результате оба эффекта взаимно гасят друг друга, и рацемическая смесь не обнаруживает оптической активности. Название происходит от рацемической винной кислоты, представляющей собой смесь равных количеств D-(правовращающей) и L-(левовращающей) винных кислот.
π-Диастереомеры. К ним относятся конфигурационные изомеры, содержащие π-связь. Этот вид изомерии характерен, в частности, для алкенов. Относительно плоскости π-связи одинаковые заместители у двух атомов углерода могут располагаться по одну (цис) или по разные (транс) стороны. В связи с этим существуют стереоизомеры, известные под названием цис- и транс-изомеров, как показано на примере цис- и транс-бутенов (см. 3.2.2). π-Диастереомерами являются простейшие ненасыщенные дикарбоновые кислоты - малеиновая и фумаровая.
| |

Малеиновая кислота является термодинамически менее стабильным цис-изомером по сравнению с транс-изомером - фумаровой кислотой. Под действием некоторых веществ или ультрафиолетовых лучей между обеими кислотами устанавливается равновесие; при нагревании (150°C) оно смещено в сторону более стабильного транс-изомера.
