Занятие Теории кислот и оснований. Водородный показатель
 Скачать 51.21 Kb. Скачать 51.21 Kb.
|
|
Практическое занятие № 7. Теории кислот и оснований. Водородный показатель Цель: систематизация, обобщение и углубление знаний о свойствах растворов электролитов, рН; расширение представлений о понятиях кислота и основание Сделайте записи в рабочей тетради по плану: -дата; -номер занятия; -тема занятия; -цель занятия; -основные вопросы темы. 1.Учебные вопросы занятия Теории кислот и оснований. Теория электролитической диссоциации (теория С.Аррениуса). Электронная теория кислот и оснований Г. Льюиса. 1.3. Протолитическая теория И. Бренстеда и Т. Лоури. Амфолиты. 1.4. Типы протолитических реакций. 2.Количественная оценка силы кислот и оснований (Ka, Kb, pKa, pKb). 2.1.Диссоциация воды. Ионное произведение воды. Водородный показатель. Шкала pH. 3.Роль ионов водорода в биологических процессах. Виды кислотности. Интервал значений pH важнейших биологических жидкостей. 4.Методы определения водородного показателя. Кислотно-основные индикаторы в аналитической химии. 5.Решение задач. При подготовке к данному занятию Вам необходимо повторить: - электронное строение молекулы воды; - образование ковалентной полярной связи в молекуле воды и образование - водородных связей между молекулами воды; - понятие электролит и неэлектролит; - основные положения теории электролитической диссоциации; диссоциация электролитов с ионной и ковалентной связью. - кислотность растворов и определение pH с помощью различных индикаторов; - химическое равновесие. Константа химического равновесия. Принцип Ле-Шателье. При отработке 1-го учебного вопроса обратите внимание: - на причину электролитической диссоциации (ионизации) веществ в водном растворе и особенности диссоциации электролитов с различным типом связи; -на факторы, влияющие на процесс диссоциации (ионизации); - на необходимость создания более общих теорий (теория Бренстеда и Лоури,) кислот и оснований для описания реакций в неводных растворителях; При отработке 2-го учебного вопроса обратите внимание: -на применимость закона действующих масс для количественного описания силы кислот и оснований Бренстеда. При отработке 3-го учебного вопроса обратите внимание: - на то, что чистая вода ведет себя как амфолит; - на выражение константы автоионизации воды и взаимосвязь между концентрацией ионов водорода и значением pH; - жизнедеятельность организма в норме при определенной кислотности биологических жидкостей. При отработке 4-го учебного вопроса обратите внимание: - на экспериментальные методы определения водородного показателя (колориметрический и потенциометрический). 2.Вопросы и задания для самоконтроля 2.1. Вопросы для самоконтроля Уравнение ионного произведения воды, его анализ. Водородный и гидроксильный показатели среды. Характеристика кислотности сред по величине pH. Биологическое значение водородного показателя. 2.2. Контрольные задания 5. Рассчитать рН и рОН слюны, если концентрация ионов водорода в ней составляет 1,78·10–7 моль·л-1. 6. Физиологическое значение рН крови 7,36. Определить концентрацию ионов [H+] и [OH-] в крови. 7. Рассчитать рН раствора соляной кислоты с концентрацией 0,03 моль/л и водного раствора гидроксида калия с концентрацией 0,12 моль/л, считая, что указанные вещества диссоциируют полностью. 8. Определите рН кишечного сока, если концентрация гидроксид- анионов ОН- в составе кишечного сока составляет 2,3·10-6 моль·дм-3. Эталоны решения задач Задача 1. Рассчитать рН раствора соляной кислоты с молярной концентрацией вещества в растворе С(НСl) = 0,001 моль·дм-3. Дано: Решение:  С(HCl) = 0,001 моль·дм-3 HClH+ + Cl-, т.к. = 1, то С(HCl) = 0,001 моль·дм-3 HClH+ + Cl-, т.к. = 1, то  [H+] = [HCl] = 10-3 моль·дм-3 [H+] = [HCl] = 10-3 моль·дм-3рН - ? pH = -lg [H+] pH = -lg10-3 = 3 Ответ: pH = 3. Задача 2. Рассчитать pH раствора гидроксида калия с молярной концентрацией вещества в растворе C(KOH) = 1,5·10-2 моль·дм-3. Дано: Решение:  С(KOH) = 1,5·10-2 моль·дм-3 KOHK+ + OH-, т.к. = 1, то С(KOH) = 1,5·10-2 моль·дм-3 KOHK+ + OH-, т.к. = 1, то  [OH-] = [KOH] = 1,5·10-2 моль·дм-3 [OH-] = [KOH] = 1,5·10-2 моль·дм-3рН -? pOH = –lg[OH-] pOH = –lg1,5·10-2 = 1,82 pH + pOH = 14 pH = 14 – pOH pH = 14 – 1,82 = 12,18. Ответ: pH = 12,18. Задача 3. pH желудочного сока равен 1,65. Определить концентрации ионов [H+] и [OH-] в желудочном соке. Дано: Решение:  pH = 1,65 pH = –lg [H+] pH = 1,65 pH = –lg [H+] 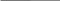 lg [H+] = –pH [H+] = 10–pH lg [H+] = –pH [H+] = 10–pH[ 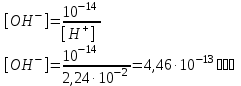 H+] - ? [H+] = 10–1,65 = 0,0224 моль·дм–3 = 2,24·10–2 моль·дм–3 [OH-] - ? [H+] · [OH-] = 10–14 Ответ: [H+] = 2,24·10–2 моль/л ; [OH–] = 4,46·10–13 моль/л . 2.3. Тестовые задания Выбрать один правильный ответ 1. Сопряженным основанием для C2H5OH2+ является: C2H5O- 2.C2H5OH 3.H2O 4.CH3OH 2. Cогласнопротолитической теории вода является: 1. только кислотой; 2. только основанием; 3. как кислотой, так и основанием; 4. ни тем ни другим. 3. Значение pH раствора при pOH = 11 равно 1). 14; 2). 7; 3). 3; 4). 1 4. Протолитическая реакция HS- +H2O ↔ H2S + OH- осн-е к- та с. к-та с. осн-е является реакцией: 1.ионизации 2.нейтрализации 3.гидролиз по аниону 4.гидролиз по катиону 5. Фактор эквивалентности серной кислоты в реакции H2SO4 + 2KOH→ … Составляет: 1)1/2 2) 4 3) 1 2) 2 6. По теории Льюиса кислотой является: 1) любая частица – акцептор протона 2) любая частица – донор протона 3) любая частица – акцептор электронной пары 4) вещество, при диссоциации которого образуется катион водорода и анион кислотного остатка. 7. Ионная сила растворов электролитов определяется согласно теории 1) Бренстеда-Лоури 2) Аррениуса 3) Дебая-Хюккеля 4) Льюиса 8. При гидролизе соли по катиону 1) pH увеличивается 2) pH уменьшается 3) pH не изменяется 4) не влияет на значение pH. 9. Согласно протолитической теории кислотно-основное равновесие устанавливается 1) в результате конкуренции за протон Н+ 2) в результате конкуренции за анион ОН- 3) в результате конкуренции за электронную пару 4) вследствие образования осадка. 10. [H+] = 10-2. Среда раствора 1) нейтральная 2) кислая 3) щелочная 4) водная Лабораторное занятие 7 Тема: Определение водородного показателя биологических жидкостей Цель: овладеть практическими навыками определения рН растворов с помощью универсального индикатора и экспериментально доказать изменение окраски индикаторов в зависимости от рН среды; освоить принцип потенциометрического определения рН, научиться пользоваться рН-метром. 1.Учебные вопросы занятия: 1. Инструктаж по выполнению лабораторной работы 2. Выполнение лабораторной работы 2.1. Лабораторная работа «Определение активной кислотности биологических жидкостей» 3.Защита лабораторной работы 2.Материально-техническое обеспечение занятия: учебная аудитория снабжена: справочным материалом, таблицами, мультимедийной установкой; химическое Оборудование и реактивы: рН-индикаторная бумага, иономер, .индикаторный электрод – стеклянный водородный электрод., электрод сравнения – хлорсеребряный электрод,стеклянные стаканы емкостью 50 см3. Реактивы: исследуемые биологические жидкости Лабораторная работа Определение активной кислотности биологических жидкостей. Ход работы Задание 1. Определение pH растворов 1 и 2 с помощью универсального индикатора. Чистую палочку опускают в исследуемый раствор и касаются ею полоски индикатора. Сравнивают окраску влажного участка индикаторной бумаги с колориметрической шкалой pH. Определяют pH исследуемого раствора и записывают его значение в таблицу результатов опыта. После определения pH раствора 1 стеклянную палочку моют, протирают куском фильтровальной бумаги и определяют pH раствора 2. Записывают полученные результаты определения в таблицу. Задание 2. Определение pH растворов 1 и 2 с помощью иономера. Перед началом работы знакомятся с инструкцией к прибору.исследуемый раствор наливают в чистый стаканчик, в раствор на 1,5 см опускают электроды. дальнейший порядок выполнения работы описан в «Инструкции по эксплуатации иономера». Перед определением pH электроды осторожно промывают дистиллированной водой и капли воды с электродов убирают фильтровальной бумагой. Полученные результаты записывают в таблицу и рассчитывают активную кислотность растворов по формуле [H+] = 10-pH.
Делают вывод о характере среды в исследуемых растворах. Сравнивают [H+] в обоих растворах. Сравнивают точность обоих методов. ПРИЛОЖЕНИЕ. Существует несколько способов для определения рН: 1) колориметрический метод- водородный показатель можно приблизительно оценивать с помощью индикаторов;2) потенциометрическое (ионометрическое) определение рН- водородный показатель можно точно измерять pH-метром;3) определять аналитически путём, проведением кислотно-основного титрования. Колориметрическое определение водородного показателя. Колориметрическое определение рН основано на изменении цвета кислотно-основных индикаторов, окраска которых зависит от рН среды. Индикаторы могут быть одноцветными, имеющими окраску только в щелочной среде, а в кислой среде-бесцветными ( фенолфталеин, нитрофенолы), и двухцветными, имеющими различную окраску в кислой и щелочной средах (метилоранж, феноловый красный и др.)(см. таблицу). Таблица Кислотно-основные индикаторы.
Каждый индикатор характеризуется показателем титрования и интервалом (зоной) перехода окраски. Показатель титрования рТ- это значение рН в пределах интервала перехода окраски, при котором наблюдается наиболее резкое изменение цвета индикатора. Интервалом перехода окраски индикатора называется интервал значений рН(ΔрН), в пределах которого происходит различимое глазом изменение окраски индикатора. Граница интервала перехода приблизительно равна рТинд± 1. При определении рН раствора можно использовать только тот индикатор, в интервал перехода окраски которого входит рН исследуемого раствора. Обычно в начале определяют приблизительное значение рН с помощью универсального индикатора. Универсальный индикатор – это смесь нескольких индикаторов с различными, но примыкающими друг к другу интервалами перехода окраски, охватывающими шкалу рН от 1 до 14, причем эта смесь индикаторов имеет определенную окраску при тех или иных значениях рН. Универсальная индикаторная бумага- это фильтровальная бумага, пропитанная универсальным индикатором. К ней прилагается цветная шкала со значениями рН для каждой окраски. Точность определения не превышает 0,5 ед. рН. По приблизительному значению рН подбирают индикатор для более точного определения. Потенциометрическое (ионометрическое) определение рН основано на изменении электродвижущей силы (ЭДС) гальванической цепи, составленной из индикаторного полуэлемента (электрода определения), потенциал которого зависит от рН среды(стеклянный, водородный, хингидронный) и электрода сравнения (хлорсеребряного, каломельного), имеющего постоянный потенциал. Измерительная шкала иономера (рН-метра) градуирована как в милливольтах, так и в единицах рН. Точность определения до 0,01 ед. рН. Можно использовать для определения рН мутных и окрашенных жидкостей. Метод кислотно-основного титрования – также даёт точные результаты определения общей кислотности растворов. Принцип метода: раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности – момент, когда титрант и анализируемое вещество полностью прореагировали согласно закона эквивалентов, фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется общая кислотность раствора. Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи. Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных биологических сред. Концентрация в растворе ионов водорода оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-основного гомеостаза является необходимым условием. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем. 3. Контрольные вопросы для защиты работы 1. Как устроен гальванический элемент для измерения рН биологических жидкостей? 2. Какие ионоселективные электроды применяют в медико-биологичес-ких исследованиях? 3. Как устроен стеклянный водородный электрод? 4. Объясните постоянство потенциала электрода сравнения на примере хлорсеребряного электрода. 5. В чем сущность прямой потенциометрии? 6. В чем сущность потенциометрического титрования? 6.3. Вопросы для защиты лабораторной работы 4.Вопросы и задания для самоконтроля 1.Уравнение ионного произведения воды, его анализ. 2.Водородный и гидроксильный показатели среды. 3.Характеристика кислотности сред по величине pH. 4.Биологическое значение водородного показателя. 5.Вычислите водородный показатель рН раствора КОН с молярной концентрацией 4,2 • 10-3. (рН= 11,62) 6.Рассчитайте концентрацию ионов ОН- в растворе, рН которого равен 3,28. (0,19 10 -3 моль/л) 7.Найдите рН раствора HN03, если его молярная концентрация равна 0,178 моль/л. (рН = 0,83) 8.Вычислите общую, активную и потенциальную кислотность раствора HCN с молярной концентрацией 0,01 моль/л, если Ka(HCN)-7,2 *10 -10. (0,01 моль/л; 2,68-10 -6моль/л; ≈1·10-2моль/л) 5.Список рекомендуемой литературы 5.1 Основная литература 1. Попков В.А. Общая химия [Электронный ресурс]: учеб. / В.А. Попков, С.А. Пузаков. - М.: ГЭОТАР-Медиа, 2010. - 976 с. – Режим доступа:http://www.studentlibrary.ru/book/ISBN9785970415702.html 2. Попков В.А. Общая химия [Текст]: учеб. / В.А. Попков, С.А. Пузаков. - М.: ГЭОТАР-Медиа, 2009. - 976 с. 3. Жолнин, А.В. Общая химия [Текст] :учеб. / А. В.Жолнин ; под ред. В. А. Попкова, А.В. Жолнина. - М. : ГЭОТАР-Медиа,2012. - 400 с. 4. Жолнин, А.В. Общая химия [Электронный ресурс] :учеб. / А. В. Жолнин ; под ред. В. А. Попкова, А. В. Жолнина. - М. : ГЭОТАР-Медиа, 2014. – 400 с. – Режим доступа: http://www.studentlibrary.ru/book/ISBN9785970429563.html | |||||||||||||||||||||
