Занятие 1 Вопрос 1 Структура стоматологической поликлиники
 Скачать 0.52 Mb. Скачать 0.52 Mb.
|
|
Вопрос 6 Стерилизация изделий медицинского назначения Стерилизация - это процесс уничтожения всех видов микробной флоры, в том числе их споровых форм, и вирусов с помощью физических или химических воздействий. Стерилизации должны подвергаться медицинские изделия, контактирующие с кровью пациента, контактирующие с раневой поверхностью и соприкасающиеся со слизистой оболочкой и могущие вызвать нарушение ее целостности. Процесс стерилизации медицинских инструментов и изделий от момента окончания операции и до стерильного хранения или следующего применения включает в себя выполнение мероприятий в определенной последовательности. Все этапы должны быть строго соблюдены для обеспечения стерильности и длительного срока жизни инструментов. Схематично это можно представить следующим образом:
При применении стерилизационной упаковки (бумага, фольга или стерилизационные контейнеры) инструменты могут храниться в стерильном виде и позднее использоваться от 24 часов до 6 месяцев. Методы стерилизации Стерилизация осуществляется физическими методами:
Химическими методами:
При стерилизации физическими методами (паровым, воздушным) изделия, как правило, стерилизуют упакованными в упаковочные материалы, разрешенные в установленном порядке к промышленному выпуску и применению в России. При паровом методе могут применяться стерилизационные коробки без фильтров и с фильтром. При воздушном методе, а также при паровом и газовом методах допускается стерилизация инструментов в неупакованном виде. Паровой метод стерилизации Паровым методом стерилизуют медицинские изделия, детали приборов и аппаратов из коррозионностойких металлов, стекла, хирургическое белье, перевязочный и шовный материал, изделия из резины (катетеры, зонды, трубки), из латекса, пластмасс. При паровом методе стерилизующим средством является водяной насыщенный пар под избыточным давлением 0,05 МПа (0,5 кгс/см2) - 0,21 МПа (2,1 кгс/см2) (1,1-2,0 бар) температурой 110-134°С. Процесс стерилизации происходит в стерилизаторах (автоклавах). Полный цикл составляет от 5 до 180 минут (табл.). Согласно ГОСТ 17726-81, название данного класса устройств: «Стерилизатор паровой». Несмотря на то, что обработка паром достаточно эффективна, она не всегда может обеспечить стерилизацию инструмента. Причина этого состоит в том, что воздушные полости в стерилизуемых объектах могут послужить тепловым изолятором, как например, стоматологические турбинные наконечники. Для решения этой проблемы в автоклавах используется функция создания предварительного вакуума в импульсном режиме. Преимущества метода - короткий цикл, возможность стерилизации нетермостойких изделий, применение различных типов упаковки. Недостатком является высокая стоимость оборудования. Воздушный метод стерилизации Стерилизация при воздушном методе осуществляется сухим горячим воздухом температурой 160°, 180° и 200°С. Воздушным методом стерилизуют медицинские изделия, детали приборов и аппаратов из коррозионностойких металлов, стекла с пометкой 200°С, изделия из силиконовой резины. Перед стерилизацией воздушным методом изделия подвергаются предстерилизационной очистке и обязательно высушиваются в сушильном шкафу при температуре 85°С до исчезновения видимой влаги. Полный цикл составляет до 150 минут. Преимущество стерилизации горячим воздухом по сравнению с паровым методом состоит в низкой себестоимости оборудования. Недостатками являются: длинный полный цикл стерилизации (не менее 30 мин), опасность повреждения инструментов высокими температурами, невозможность стерилизации тканей и пластмасс, только один контрольный параметр - температура, высокие энергозатраты. Гласперленовая стерилизация Гласперленовая стерилизация осуществляется в стерилизаторах, стерилизующим средством в которых является среда нагретых стеклянных шариков при рабочей температуре 190-330°С. При стерилизации сухие инструменты помещают в среду раскаленных стеклянных гранул на глубину более 15 мм. Этим методом могут быть простерилизованы только инструменты, размер которых не превышает 52 мм, они должны быть целиком погружены в камеру на 20-180 с в зависимости от размера. После стерилизации изделия используются сразу по назначению. Высокая рабочая температура и невозможность полного погружения инструментов в стерилизующую среду ограничивают возможность стерилизации широкого ассортимента медицинских изделий. Стерилизация газовым методом Для газового метода стерилизации применяют смесь окиси этилена и бромистого метила в весовом соотношении 1: 2,5 соответственно (ОБ), окись этилена, пары раствора формальдегида в этиловом спирте, озон. Стерилизацию смесью ОБ и окисью этилена осуществляют при температуре не менее 18°С, 35°С и 55°С, парами раствора формальдегида в этиловом спирте при температуре 80°С. Перед газовой стерилизацией изделия после предстерилизационной очистки подсушивают до исчезновения видимой влаги. Удаление влаги из полостей изделий производят с использованием централизованного вакуума, а при его отсутствии с помощью водоструйного насоса, подсоединенного к водопроводному крану. При стерилизации ОБ и окисью этилена удаляют воздух до давления 0,9 кгс/см2. При использовании портативного аппарата после окончания стерилизации его выдерживают в вытяжном шкафу на протяжении 5 часов. Озоном, вырабатываемым в озоновом стерилизаторе С0-01 -СПБ, стерилизуют изделия простой конфигурации из коррозионностойких сталей и сплавов, в неупакованном виде при температуре не более 40°С. Цикл стерилизации (выход на режим, стерилизация, дезактивация) составляет 90 минут. После стерилизации инструменты используют по назначению сразу без дополнительного проветривания. Срок сохранения стерильности изделий 6 часов, при соблюдении правил асептики. При упаковке в стерильную двухслойную х/б ткань срок стерильности составляет 3 суток, а при содержании в камере с бактерицидными облучателями - 7 суток. Инфракрасное воздействие Новые методы стерилизации нашли свое отражение в стерилизаторе инфракрасной стерилизации, предназначенном для стерилизационной обработки металлических медицинских инструментов в стоматологии, микрохирургии, офтальмологии и других областях медицины. Высокая эффективность ИК-стерилизующего воздействия обеспечивает полное уничтожение всех исследованных микроорганизмов, в том числе таких как: S. epidermidis, S. aureus, S. sarina flava, Citrobacter diversus, Str. pneumonia, Bacillus cereus. Быстрый, в течение 30 секунд, выход на режим 200±3°С, короткий цикл стерилизационной обработки - от 1 до 10 минут, в зависимости от выбранного режима, наряду с низкой энергоемкостью, несравнимы по эффективности ни с одним из применяемых до настоящего времени методов стерилизации. Стерилизатор ИК-стерилизации прост в эксплуатации, не требует специально обученных операторов, а сам метод относится к экологически чистым технологиям. В отличие от паровой, воздушной или гласперленовой стерилизации, при ИК-стерилизации отсутствует агрессивное воздействие стерилизующего агента (инфракрасного излучения) на режущий инструмент. Стерилизация растворами химических средств Данный метод применяют для стерилизации изделий, материалы которых не являются термоустойчивыми, и применение других официально рекомендуемых методов невозможно. Недостатком данного метода является то, что изделия нельзя стерилизовать в упаковке и по окончании стерилизации их необходимо промыть стерильной жидкостью (водой или 0,9% раствором натрия хлорида), что при нарушении правил асептики может привести к вторичному обсеменению микроорганизмами простерилизованных изделий. Для химических средств применяют стерильные емкости из стекла, термостойких пластмасс, выдерживающих стерилизацию паровым методом, металлов, покрытых эмалью. Температура растворов, за исключением специальных режимов применения перекиси водорода и средства Лизоформин 3000, должна быть не менее 20°С для альдегидсодержащих средств и не менее 18°С для остальных средств Химический метод стерилизации достаточно широко применяется для обработки «проблемной техники», например, для аппаратуры с волоконной оптикой, наркозной аппаратуры, кардиостимуляторов, стоматологического инструментария. Используются такие современные стерилизующие агенты, как глутаровый альдегид, производные ортофталевой и янтарной кислот, кислородосодержащие соединения и производные надуксусной кислоты в режиме экспресс-стерилизации и «Классической стерилизации». Перспективными считаются препараты, полученные на их основе - «Эригид форте», «Лизоформин-3000», «Сайдекс», «НУ Сайдекс», «Сайдекс ОПА», «Гигасепт», «Стераниос», «Секусепт актив», «Секусепт пульвер», «Аниоксид 1000», «Клиндезин форте», «Клиндезин окси», причем подводя экономическое обоснование использования этих препаратов, следует сделать вывод об их неравнозначности, которая определяется сроками использования рабочих растворов (например, из всех препаратов только «Эригид форте» имеет возможность использования рабочего раствора в течение 30 дней для «классической» стерилизации). Разъемные изделия стерилизуют в разобранном виде. Во избежание нарушения концентрации стерилизационных растворов, погружаемые в них изделия должны быть сухими. Цикл обработки составляет 240-300 минут, что является существенным недостатком метода. Кроме того, недостатком является высокая стоимость дезинфектантов. Преимущество - нет специального оборудования. Промытые стерильные изделия после удаления жидкости из каналов и полостей используют сразу по назначению или после упаковки в двухслойную стерильную х/б бязь, помещают в стерильную коробку, выложенную стерильной простыней, на срок не более 3 суток. Все работы по стерилизации изделий проводятся в асептических условиях в специальных помещениях, подготавливаемых как операционный блок (квар-цевание, генеральная уборка). Персонал использует стерильную спецодежду, перчатки, очки. Ополаскивание изделий проводится в 2-3 сменах стерильной воды, по 5 минут в каждой. Контроль эффективности стерилизации Контроль эффективности стерилизации осуществляется физическими, химическими и бактериологическими методами. К физическим методам контроля относятся: измерение температуры, давления и времени применения стерилизации. Для проведения химического контроля на протяжении десятилетий применялись химические вещества, имеющие температуру плавления, близкую к температуре стерилизации. Такими веществами были: бензойная кислота - для паровой стерилизации; сахароза, гидрохинон и некоторые другие -для контроля воздушной стерилизации. Если происходило расплавление и изменение цвета указанных веществ, то результат стерилизации признавался удовлетворительным. Поскольку применение вышеуказанных индикаторов является недостаточно достоверным, в настоящее время внедрены в практику контроля термических методов стерилизации химические индикаторы, цвет которых изменяется под воздействием температуры, адекватной для конкретного режима, для определенного времени, необходимого для реализации данного режима. По изменению окраски индикаторов судят об основных параметрах стерилизации - температуре и продолжительности стерилизации. К 1 классу отнесены индикаторы внешнего и внутреннего процесса, которые размещаются на наружной поверхности упаковки с медицинскими изделиями или внутри наборов инструментов и операционного белья. Изменение цвета индикатора указывает на то, что упаковка подверглась процессу стерилизации. Ко 2 классу относят индикаторы, которые не контролируют параметры стерилизации, а предназначенные для применения в специальных тестах, например, на основании таких индикаторов оценивают эффективность работы вакуумного насоса и наличие воздуха в камере парового стерилизатора. К 3 классу относятся индикаторы, при помощи которых определяется один параметр стерилизации, например, минимальная температура. Однако они не дают информации о времени воздействия температуры. К 4 классу относят многопараметровые индикаторы, изменяющие цвет при воздействии нескольких параметров стерилизации. Примером таких индикаторов являются индикаторы паровой и воздушной стерилизации одноразового применения ИКПВС-«Медтест». К 5 классу относят интегрирующие индикаторы, реагирующие на все критические параметры метода стерилизации. К 6 классу относят индикаторы-эмуляторы. Индикаторы откалиброваны по параметрам режимов стерилизации, при которых они применяются. Эти индикаторы реагируют на все критические параметры метода стерилизации. Эмулирующие индикаторы являются наиболее современными. Они четко регистрируют качество стерилизации при правильном соотношении всех параметров - температуры, насыщенного пара, времени. При несоблюдении одного из критических параметров индикатор не срабатывает. Биологический индикатор представляет собой препарат из патогенных споро-образующих микроорганизмов с известной высокой устойчивостью к данному типу стерилизационного процесса. Задачей биологических индикаторов является подтверждение способности стерилизационного процесса убивать устойчивые микробные споры. Это наиболее критичный и достоверный тест стерилизационного процесса. Применяются биологические индикаторы в качестве контроля загрузки: если результат положительный (микробный рост), то использовать данную загрузку нельзя и необходимо отозвать все предыдущие загрузки до последнего отрицательного результата. Для получения достоверного биологического ответа следует использовать только те биологические индикаторы, которые соответствуют международным стандартам ЕК 866 и ISO 11138/11135. При использовании биологических индикаторов возникают определенные трудности - необходимость наличия микробиологической лаборатории, обученного персонала, продолжительность инкубации многократно превышает длительность стерилизации, необходимость карантина (невозможность использования) простерилизованных изделий до получения результатов. Из-за указанных выше трудностей в применении биологического метода в амбулаторной стоматологической практике обычно используется физический и химический метод контроля эффективности стерилизации. Вопрос 7 Стерилизация стоматологических зеркал СанПиН 2.1.3.2630-10 предписывает определённый порядок обеззараживания стоматологических инструментов. В повседневной работе зубной врач часто пользуется стоматологическими зеркалами. Они нужны для того, чтобы подсвечивать и осматривать ротовую полость пациента, исследовать кариозные полости, слизистую и др. Этот инструмент представляет собой зеркало в металлической оправе, которое закрепляется на стержне и навинчивается на металлическую ручку. Размеры применяются разные (22 мм, 24 мм, 38 мм, 50,8 мм). Виды инструмента:
Порядок обеззараживания Для правильной обработки нужно строго следовать разработанным инструкциям:
Стерилизация Зеркала непосредственно соприкасаются со слизистой и биологическими жидкостями организма, поэтому должны быть стерильными. Существуют основные методы стерилизации стоматологических инструментов:
Корпус изготавливается из нержавеющей стали с родиевым покрытием, которое очень чувствительно к высоким температурам и портится, например, при кипячении. Поэтому ручки можно стерилизовать в автоклаве (110-134°), а для деконтаминации самих зеркал используется только химический метод стерилизации. Идеально подходит для этих целей российское дезсредство «Септолит Тетра». Оно имеет высокую противомикробную активность, уничтожает также вирусы и грибы, безопасно, экономично в использовании, обладает моющими свойствами и разрешено к применению санитарными службами. Купить это средство можно в интернет-магазине Septolit.ru. Вопрос 8 Особенности обработки стоматологических наконечников Поскольку наконечники непосредственно контактируют с тканями и биологическими жидкостями пациентов, то они могут являться факторами передачи различных инфекционных заболеваний, в том числе и гемоконтактных, таких как вирусные гепатиты, ВИЧ-инфекция. Для предотвращения инфицирования пациентов стоматологические инструменты должны подвергаться полноценной обработке, которая является одной из самых актуальных проблем в современной стоматологической практике. Данные обстоятельства обусловлены тем, что сложность конструкции наконечников значительно затрудняет осуществление дезинфекционно-стерилизационных мероприятий. ЭТАП 1. Промывка и продувка наконечника осуществляется непосредственно после проведения манипуляции у пациента до момента отсоединения наконечника от стоматологической установки. Канал наконечника промывают водой, прочищают с помощью специальных приспособлений (например, мандренов) и продувают воздухом. ЭТАП 2. Очистка наружной поверхности наконечника. Данный этап следует проводить после отсоединения наконечника от стоматологической установки. Поверхность наконечника тщательно протирают тканевыми салфетками, смоченными питьевой водой, до удаления видимых загрязнений. Для дезинфекции медицинских изделий, применяемых в стоматологии, необходимо использовать препараты, обладающие широким спектром антимикробной активности, в том числе бактерицидными, вирулицидными, фунгицидными свойствами. Выбор режимов осуществляют между вирусами или грибами рода Кандида, в туберкулезных медицинских организациях следует применять режимы, при которых дезинфицирующие растворы активны в отношении микобактерий туберкулеза.  ЭТАП 3. Разборка наконечника. Рабочий инструмент (бор, фрезу, диск, полир и т.д) вынимают из наконечника. Если наконечник имеет съемную головку, то ее отсоединяют от основной части, поскольку наконечники должны стерилизоваться в разобранном виде. ЭТАП 4. Смазка наконечника. Данный этап является особенно важным для продления срока службы стоматологического наконечника. Смазку его внутренних полостей проводят специальным спреем под давлением.  ЭТАП 5. Упаковка наконечника. Для предотвращения вторичной контаминации стерилизацию стоматологических наконечников целесообразно осуществлять в упакованном виде, используя специальные стерилизационные одноразовые материалы. ЭТАП 6. Стерилизация наконечника. Стоматологические наконечники и насадки к ним стерилизуют только паровым методом. Режим стерилизации определяется рекомендациями фирмы-производителя. Наиболее часто стерилизацию осуществляют при температуре 135 оС.  Хранение простерилизованных наконечников в упакованном виде осуществляют в шкафах или на рабочих столах. Сроки хранения определяются видом упаковочного материала, а также инструкцией по его применению. Обратите внимание! Процесс обработки стоматологических наконечников является довольно длительным и трудоемким. В связи с этим все стоматологические кабинеты должны быть обеспечены достаточным количеством медицинских изделий и оборудования. Вопрос 9 Стерилизация — уничтожение всех форм патогенных и непатогенных микроорганизмов. Стерилизации подвергаются изделия медицинского назначения, соприкасающиеся с раневой поверхностью, кровью, с диагностическими и лекарственными препаратами. Процесс стерилизации проводится поэтапно и включает в себя: — предварительную дезинфекцию; — предстерилизационную очистку; — собственно стерилизацию; — контроль качества стерилизации. Перед предстерилизационной очисткой и стерилизацией дезинфекции подвергаются изделия медицинского назначения, использованные при: — гнойных операциях; — оперативных манипуляциях: — инфекционных больных; — пациентов, относящихся к группам риска заболевания СПИДом, гепатитом; Дезинфекция — удаление или уничтожение живых возбудителей инфекционных болезней в (на) абиотических объектах окружающей среды. Дезинфекция медицинских изделий проводится на месте их использования (в отделениях, кабинетах) с применением физических и химических агентов. Наиболее надежной принято считать физическую дезинфекцию. Обеззараживание физическими методами представлено в трех вариантах. 1. Кипячение в дистиллированной воде в течение 30 минут или в 2,0% растворе питьевой соды (15 минут) при полном погружении предмета. 2. Обработка водяным насыщенным паром под избыточным давлением (0,5 кгс/см2) при температуре 110°С, время выдержки— 20 минут. 3. Дезинфекция сухим горячим воздухом при температуре 120°С с экспозицией 45 минут, для чего используются воздушные стерилизаторы (сухожаровые шкафы). Химическая дезинфекция Применяются различные химические вещества и их сочетания (дезинфектанты). Пример: хлорамин, перекись водорода, формалин…. Предстерилизационная обработка стоматологического инструментария Предстерилизационная очистка предназначена для удаления с изделий белковых, механических и лекарственных загрязнений. Очистке подвергается инструментарий после его использования и предварительной дезинфекции. Ее осуществляют ручным или механизированным способом в моющих растворах. Процесс очистки включает в себя: — ополаскивание проточной водой по 30 с на предмет; — замачивание в моющем растворе при полном погружении изделия в течение 15 минут, температура раствора 50°С — мойка каждого изделия в моющем растворе щеткой по 30 с каждый предмет; — ополаскивание в проточной воде 3—5 мин; — ополаскивание в дистиллированной воде 30 с; — сушка горячим воздухом при 85 "С до полного исчезновения влаги. Контроль качества предстерилизационной очистки Качество предстерилизационной очистки определяют путем постановки химических реакций на наличие: — крови и белковых загрязнений (азопирамовая и амидопириновая пробы); — остаточных количеств щелочи моющих растворов (фенолфталеиновая проба); — жира (проба с Суданом III). Контролю качества очистки подлежит 1% изделий каждого наименования, обработанных в смену. Контроль качества стерилизации Контроль качества стерилизации осуществляется физическим, химическими и бактериологическими методами. Физический и химический методы используются в оперативном контроле технологического цикла стерилизации, т. е. результаты учитываются в процессе стерилизации или сразу после ее окончания. Физический метод Метод предполагает измерение температуры, давления и времени. Химический метод Химический контроль проводят с помощью химических тестов и термических индикаторов. Используются химические вещества, иногда в смеси с органическим красителем, изменяющие свое агрегатное состояние и цвет при определенной температуре. Бактериологический метод Метод предназначен для контроля работы стерилизаторов с помощью биотестов. Биотесты представляют собой споры бактериальных культур, помещенных в стеклянные трубки или чашечки из алюминиевой фольги. Вопрос 10 Ятрогенные инфекции — инфекционные заболевания, заражения которыми произошло в процессе оказания любых видов медицинской помощи Некоторые инфекционные заболевания, способные передаваться при лечении стоматологических заболеваний Вызываемые вирусом: СПИД, Гепатит А, В, С, Герпес, ОРЗ, Грипп, Корь, Ветряная оспа, паротит Вызываемые бактериями: Гонорея, Легионеллез, Пневмония, Столбняк, Туберкулез Грибами: кандидоз Пути передачи ЯИ:
Факторы передачи: - бытовые (воздух, вода, поверхности пола, стен, потолка, мебель, посуда, белье, обувь, сантехоборудование, кожа рук, волосы и т. д.); - медицинские (инструменты, приборы, аппараты, кровь, лекарственные и дез. средства, белье). Контроль инфекций в стоматологии При работе в стоматологическом кабинете следует обратить внимание на соблюдение следующих требований. Медицинский анамнез Во всех случаях необходимо собрать тщательный анамнез, который должен включать вопросы о лекарственной терапии, текущих болезнях, гепатите, рецидивах заболевания, необъяснимой потере веса, лимфоаденопатиях, поражениях мягких тканей полости рта, других инфекциях, принадлежности пациента к группам риска. Использование защитных средств и методик - Для защиты персонала и пациентов при контактах с кровью, слюной, слизистой оболочкой полости рта необходимо обязательное использование перчаток. После завершения работы с одним пациентом руки следует вымыть, сменить перчатки на новые, и только затем начать прием следующего пациента. Не рекомендуется использовать перчатки вторично, поскольку в материале, из которого они сделаны, могут быть дефекты, что значительно снижает их барьерную роль. Медицинские работники с травмами (ранами) на руках, экземой, дерматитами отстраняются на время заболевания от медицинского обслуживания больных и контакта с предметами для ухода за ними. - При возможном разбрызгивании крови, слюны следует использовать хирургические очки или защитные экраны. - Халаты и другая рабочая одежда должны стираться горячей водой с детергентами, меняться ежедневно либо немедленно, если на них попала кровь.
Использование острого инструментария и игл
Указания для высокоуровневой дезинфекции и стерилизации инструментов Хирургические и другие инструменты, при помощи которых разрезают мягкие ткани и кость (щипцы, скальпели, инструменты для удаления зубного камня, стоматологические боры и др.) следует стерилизовать после каждого использования. Однако если стерилизация невозможна, данные инструменты должны получить высокоуровневую дезинфекцию. Занятие 4 Вопрос 1 Зубы как анатомический орган, функции зубов. Зубы человека являются основными составляющими органами пищеварительного аппарата. В их функцию входит участие в акте жевания, откусывания, разминания и раздробления пищи. Зубы также принимают участие в акте дыхания, формировании речи, способствуют четкому произношению звуков и определяют эстетику внешности человека. В каждом зубе различают коронку (corona dentis), корень (radix dentis) и шейку зуба (collum dentis). Различают коронку анатомическую - это часть зуба, которая покрыта эмалью, и клиническую - это часть зуба, которая видна во рту и выступает над десной. В течение жизни размер клинической коронки изменяется вследствие рецессии окружающих тканей. Корень - это часть зуба, покрытая цементом. Корень зуба располагается в костной альвеоле челюсти. Между корнем и компактной пластинкой альвеолы располагается периодонт. Периодонт выполняет различные функции, главной из которых является опорно-удерживающая. Шейка - это анатомическое образование, являющееся местом перехода коронки в корень зуба, соответствует эмалево-цементной границе. Внутри зуба имеется полость (cavum dentis), форма которой повторяет внешние контуры зуба и делится на коронковую часть (cavum coronale) и корневые каналы (canalis radicis dentis). В области верхушки корня каналы заканчиваются апикальным (верхушечным) отверстием (foramen apicis dentis). Каждый зуб имеет анатомические признаки, позволяющие определить его групповую принадлежность. Такими признаками являются форма коронки, режущего края или жевательной поверхности, количество корней. Вопрос 2 Эмаль (enamelurn). Основными структурными образованиями эмали являются эмалевые призмы, идущие в направлении от дентина к поверхности эмали. Толщина их неодинакова: в среднем от 3 до 6 мкм; у эмалево-дентинного соединения они более тонкие, тогда как ближе к поверхности диаметр их увеличивается. чаще всего встречаются аркадовидные призмы. Они представляют собой образования, имеющие округлой формы головки, которые переходят в более узкую удлиненную часть. Такие эмалевые призмы на поперечном сечении напоминают форму замочной скважины. Призмы располагаются рядами, так что удлиненная часть их внедряется между головками нижележащих призм. На гистологических препаратах эмали, где эмалевые призмы расположены продольно, можно видеть чередование более широких полос — головок призм с узкими полосами, которые являются хвостовой, удлиненной частью призм. Ранее считали, что эти узкие полосы являются самостоятельным образованием — межпризменным веществом, и только после изучения эмали под электронным микроскопом было доказано, что это вещество является частью (удлинениями) эмалевых призм, внедряющихся между соседними призмами. Эмалевые призмы складываются в пучки (по 10—20 штук), которые следуют от эмалево-дентинного соединения в радиальном направлении. Некоторое расстояние они проходят S-об-разно и, спиралеобразно извиваясь, опять принимают радиальное направление и доходят до поверхности эмали. Иногда призмы изгибаются и у самой поверхности эмали, а форма эмалевых призм теряется и поверхностный слой образован только радиально расположенными кристаллами гидроксилапатита. Дентин (dentinum). В основном веществе дентина имеются различно расположенные коллагеновые волокна. Часть их ориентирована радиально (волокна Корфа), а другие тангенциально (волокна Эбнера).Поверхностная, прилегающая к эмалево-дентинному соединению и цементу зона, ширина которой составляет несколько микронов, состоит исключительно из радиально направленных волокон. В средней зоне радиальные волокна собираются в пучки, а основная масса волокон расположена тангенциально. Эти две зоны называют плащевым дентином. Третья, наиболее широкая, прилегающая к полости зуба зона называется околопульпарным дентином и представлена в основном тангенциальными волокнами. Между коллагеновыми волокнами расположено склеивающее обызвествленное вещество. Степень минерализации дентина неодинакова. Малообызвествленным остается слой дентина, прилегающий к полости зуба, а также зона интерглобулярного дентина. Эта зона расположена ближе к эмалево-дентинному соединению (между плащевым и околопульпарным дентином) и характеризуется тем, что обызвествленные участки располагаются в виде шаровидных глыбок. В области корня эти глыбки меньшего размера, а зона носит название зернистого слоя (Томса). На поперечных шлифах зуба видны контурные линии (Оуэна), соответствующие темным линиям (Ретциуса) в эмали. Линии Оуэна возникают также в результате неравномерной минерализации дентина. Все основное вещество дентина пронизано дентинны-ми трубочками (канальцами), диаметр которых колеблется от 1 до 5 мкм. От дентинных трубочек отходит много ответвлений, а ближе к эмалево-дентинному соединению они разветвляются на более тонкие веточки. Некоторые из них проникают через эмалево-дентинное соединение и заканчиваются в эмали Субмикроскопическая структура дентина представлена кристаллами гидроксилапатита, которые расположены между коллагеновыми волокнами. Однако в хорошо минерализованном дентине коллагеновые волокна замаскированы массой кристаллов гидроксилапатита. Коллагеновые волокна видны лишь на некоторых препаратах в стенках дентинных трубачу или же на декальцинированных препаратах. Вокруг дентинныж трубочек расположены участки плотного, бесструктурного вещества—так называемые зоны гиперминерализации. Эти зоны более выражены в хорошо минерализованных зубах и менее, а иногда совсем отсутствуют у отдельных дентинных трубочек в недостаточно минерализованных зубах. От дентинных трубочек отходят ответвления, которые пронизывают основное вещество дентина (межканальцевак зона); ближе к шалево-дентинному соединению кристаллы гидроксилапатита сположены более плотно. Эта зона пронизана разветвления дентинных трубочек В зависимости от сроков образования дентина, а иногда патологических процессов, вызывающих его повышенное отложение, дентин делят на первичный, вторичный (заместительный) и третичный (иррегулярный). Первичным называют дентин, образовавшийся в процессе развития зуба, вторичным — Дентин, который откладывается на всем протяжении жизни человека как следствие физиологической деятельности пульпы. По своему строению вторичный дентин не отличается от первичного и лишь под микроскопом можно видеть границу между ними в виде пренатальной линии. У пожилых людей отложения вторичного дентина вызывает уменьшение размеров полости зуба, а иногда полную ее облитерацию. Третичный дентин, который также называют заместительным или иррегулярным, образуется в более короткие сроки как результат защитной деятельности пульпы при патологических процессах в твердых тканях зуба, а иногда и при общих заболеваниях. В третичном дентине возможно неправильное расположение коллагеновых волокон, а в некоторых случаях — и дентинных трубочек или полное их отсутствие. Цемент (cementum). По строению приближается к грубо-волокнистой соединительной ткани. В цементе, как и в дентине, имеются коллагеновые волокна и минерализованное склеивающее вещество. Часть коллагеновых волокон расположена в продольном направлении, другие — в радиальном. Эти волокна, с одной стороны, переходят в радиальные (корфовские) волокна дентина, с другой — в волокна периодонта (шарпеевские). Цементом покрыта вся поверхность корней. Непосредственно к дентину прилегает так называемый бесклеточный, или первичный, цемент, в котором отсутствуют клетки. У верхушек корней и на межкорневых поверхностях многокорневых зубов этот цемент покрыт слоем клеточного, или вторичного, цемента, который содержит много цементных клеток-цементоцитов, имеющих большое число отростков. В отличие от первичного цемента во вторичном выражено радиальное направление коллагеновых волокон. ПУЛЬПА По структуре пульпа зуба является рыхлой соединительной тканью, которая представлена:
Клеточный состав пульпы зуба разнообразен. В зависимости от расположения групп клеток пульпу принято подразделять на три слоя: периферический, промежуточный и центральный. Периферический слой образован специфическими клетками — одонтобластами. Одонтобласты — это высокодифференцированные и специализированные клетки пульпы, располагающиеся в 2—4 ряда; количество рядов уменьшается по мере приближения к верхушечному отверстию корня. Клетка имеет продолговатую, овальную или грушевидную форму, которая с возрастом изменяется на цилиндрическую или колбообразную. По периферии одонтобласт ограничен плазматической мембраной, имеющей двухконтурное строение. В цитоплазме содержится ядро вытянутой формы, хорошо развитая эндоплазматическая сеть с большим количеством рибосом и митохондрий, что свидетельствует об активных энергетических процессах, происходящих в одонтобластах и участии их в синтезе протеинов. В цитоплазме также имеются свободные рибосомы, липидные гранулы, пиницитозные пузырьки, которые свидетельствуют об активном участии клетки в обменных процессах с межканальцевой средой. Одонтобласт имеет два отростка — центральный и периферический. Центральный отросток не выходит за пределы пульпы зуба, а периферический проникает в дентин, располагаясь в дентинных канальцах, полностью заполняя его просвет. Большая часть отростков достигает эмалево-дентинного соединения, где делятся на две веточки, что, вероятно, и объясняет его высокую чувствительность. Одонтобласты плотно прилежат и контактируют друг с другом, образуя своеобразный клеточный монослой. Основная функция клетки — образование дентина. В коронковой части эуба под слоем одонтобластов находится зона Вейля, свободная от клеточных элементов и богатая нервными волокнами. Промежуточный или субодонтобластический слой представлен большим количеством звездчатых клеток. Эти клетки могут быть различной величины, иметь двухконтурную мембрану, вытя-нутой формы ядро, которое занимает значительную часть клетки, 1—2 ядрышка. В цитоплазме звездчатой клетки содержатся митохондрии, большое количество свободных рибосом, липидные гранулы, крупные вакуоли, аппарат Гольджи. Клетка имеет несколько отростков, длина которых превышает размеры самой клетки. Соединяясь друг с другом, отростки образуют клеточный синцитий. Звездчатые клетки являются предодонтобластами, через стадию фибробласта она дифференцируется в одонтобласт. В промежуточном слое, помимо звездчатых клеток, находятся зрелые фибробласты, гистиоциты (фиксированные макрофаги), а также сеть мелких капилляров и безмякотных нервных волокон. Центральный слой богат фибробластам. Клетки этого слоя лежат рыхло, вокруг расположены пучки коллагеновых и ретикулиновых волокон, что связано с функцией фибробластов образовывать коллагеновые волокна и межуточное вещество соединительной ткани пульпы зуба. Данный слой богат гистиоцитами (блуждающие клетки), наличие которых связано с дентинообразующей, трофической и защитной функциями клеток. Гистиоцит имеет длинные отростки, которые он легко утрачивает, превращаясь в макрофаг. При внедрении в пульпу бактерий или при нарушении обменных процессов в ней гистиоциты активизируются и приобретают черты подвижных макрофагов, активно фагоцитирующих и переваривающих поглощенные частицы. Макрофаги обеспечивают обновление пульпы, захват и переваривание погибших клеток, микроорганизмов и компонентов межклеточного вещества. Лимфоциты присутствуют в небольшом количестве в здоровой пульпе зуба, преимущественно в периферической ее части, их содержание возрастает при воспалении. Плазматические клетки являются конечной стадией дифференцировки В-клеток, в норме — единичные, но при воспалении становятся многочисленными, деятельность их связывают с синтезом антител и иммуноглобулинов, отвечающих за гуморальный иммунитет. Тучные клетки присутствуют преимущественно в воспаленной пульпе зуба, располагаются периваскулярно и являются носителями биологически активных веществ — гепарина, гистамина, эозинофильного хемотаксического фактора и лейкотриена С. Дегрануляцня тучных клеток сопровождается увеличением проницаемости сосудов и сокращением гладких миоцитов. Волокнистые структуры пульпы зуба подобны соединительнотканным волокнам других органов, представлены в основном коллагеновыми волокнами, располагаются без особой ориентации, формируя достаточно рыхлую сеть в центральной части пульпы (диффузные коллагеновые волокна) и плотный каркас по периферии (пучковые коллагеновые волокна). В молодой пульпе очень мало коллагеновых волокон, однако по мере старения, коллаген вырабатывается все больше н больше, что придает пульпе беловатый оттенок. Независимо от возраста верхушечная часть пульпы плотнее коронковой благодаря большому содержанию коллагеновых волокон. В пульпе также присутствуют ретикулярные волокна Корфа, берущие свое начало от пульпы зуба, проходящие между одонтобластамн в дентин спиралевидными переплетениями в виде тонкой сети, образуя фибриллярную основу последнего. В коронковой и корневой части пульпы присутствуют окситалановые волокна, на периферии их значительно больше, они располагаются хаотично без строгой ориентации. Эластических волокон в пульпе зуба нет. Вопрос 3 Сроки прорезывания различных групп молочных зубов. Сроки прорезывания различных групп молочных зубов.  Вопрос 4 Зубы формируются в тесной взаимосвязи с общим развитием и ростом ребенка. В период формирования они находятся под влиянием разнообразных факторов внешней и внутренней среды, которые отражаются как на скорости роста, степени минерализации, так и на сроках прорезывания зубов. В процессе развития зубы проходят следующие этапы: закладку, формирование эмали и дентина коронки, прорезывание зуба, формирование дентина и цемента корня, резорбцию корня (для временных зубов), созревание тканей зуба после прорезывания. Эти этапы условно можно разделить на несколько периодов. В развитии временных зубов различают 5 периодов:
Закладка временных зубов происходит на 6-8-й неделе внутриутробного развития. Обызвествление эмали временных зубов начинается на 4-5 месяце эмбрионального развития. К рождению ребенка неминерализованными остаются фиссуры и большая часть коронок временных моляров, 2/3 коронок временных клыков, пришеечная часть резцов, что объясняет наиболее частую локализацию кариозного процесса в указанных областях. Внутричелюстная минерализация этих участков зубов продолжается после рождения ребенка в течение 1,5-11 месяцев (Schroeder, 1991), а окончательное созревание эмали происходит уже после появления зуба в течение 2-2,5 лет, особенно интенсивно в 1-й год после прорезывания. На процессы полноценного формирования и первичной минерализации твердых тканей зуба в период внутричелюстного развития влияет состояние здоровья матери (болезни, курение, злоупотребление алкогольными напитками). После прорезывания зуба основное значение для постэруптивной минерализации имеет минеральный состав слюны. В течение своего формирования зубы реагируют на все изменения, происходящие в организме ребѐнка. 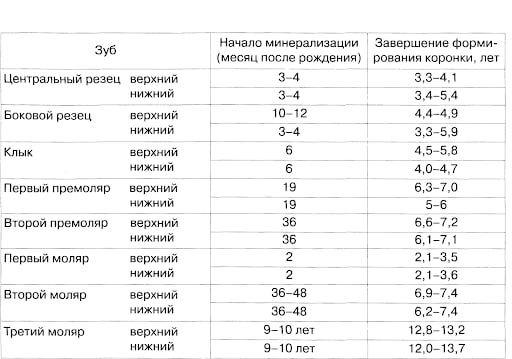 Прорезывание временных зубов начинается на 5-6месяце жизни и заканчивается к 2-2,5 годам. В ходе прорезывания зуба происходят изменения в тканях, его окружающих, формируется корень зуба, перестраивается альвеолярная кость, развивается и перестраивается периодонт. Прорезывание временных зубов начинается на 5-6месяце жизни и заканчивается к 2-2,5 годам. В ходе прорезывания зуба происходят изменения в тканях, его окружающих, формируется корень зуба, перестраивается альвеолярная кость, развивается и перестраивается периодонт. После окончательной минерализации твердых тканей временного зуба и формирования корня наступает период относительной стабильности, который длиться в среднем 2,5-3 года. Однако следует понимать, что и в этот период временные зубы характеризуются рядом анатомических и гистологических отличий, что обуславливает некоторые закономерности клинического течения кариозного процесса. Вопрос 5 Периоды резорбции корней молочных зубов
Таким образом, из таблиц видно, что в молочном прикусе совпадают сроки окончательного формирования корней молочных зубов (вторые моляры) с началом резорбции корней (центральные резцы). Такое же совпадение наблюдается и в сменном прикусе. До 12 лет заканчивается резорбция молочных зубов и заканчивается формирование всех постоянных зубов, за исключением клыков и вторых моляров. |
