Значение биохимии в подготовке врача. Биологическая химия
 Скачать 8.33 Mb. Скачать 8.33 Mb.
|
|
Основные функции антител - обнаружение и связывание чужеродных антигенов, находящихся в организме вне его клеток (в крови, лимфе, межклеточной жидкости, в слизистых секретах). Это происходит с помощью специфических антигенсвязывающих участков разных клонов иммуноглобулинов. Кроме, того, благодаря связыванию антигена с антителом облегчается процесс дальнейшего разрушения чужеродных веществ. Специфичность пути разрушения комплекса антиген-антитело зависит от класса антител. Классы иммуноглобулинов. Существует 5 классов тяжёлых цепей иммуноглобулинов, отличающихся по строению константных доменов: α, δ, ξ, γ и μ. В соответствии с ними различают 5 классов иммуноглобулинов: A, D, Е, G и М. Особенности строения тяжёлых цепей придают их "шарнирным участкам" и С-концевым областям характерную для каждого класса конформацию. Связывание антигена с антителом изменяет конформацию константных доменов тяжёлых цепей, что определяет путь разрушения комплекса в организме (связывание с белками системы комплемента или поглощение комплекса фагоцитирующими клетками). Иммуноглобулины М - первый класс антител, синтезирующийся в развивающихся В-лимфоцитах. Различают 2 формы иммуноглобулинов М: мономерная, мембранно-связанная форма и пентамерная, секретируемая В-лимфоцитами в кровь. Мембранно-с вязанная форма иммуноглобулинов М . Созревающие В-лимфоциты синтезируют мономерные бивалентные молекулы IgM, по структуре похожие на рассматриваемые выше IgG, которые встраиваются в плазматическую мембрану клеток и играют роль первых антиген-распознающих рецепторов. Прикрепление IgM к мембране осуществляется с помощью гидрофобного участка, находящегося в С-концевой ("хвостовой") области тяжёлых цепей, содержащей 25 гидрофобных аминокислотных остатков. Взаимодействие антигена с рецептором на поверхности В-лимфоцита вызывает его размножение и образование целого клона лимфоцитов, происходящих из одной, стимулированной антигеном клетки. Этот клон В-лимфоцитов будет вырабатывать иммуноглобулины с одинаковыми антигенсвязывающими участками. Однако В-лимфоциты способны переключаться на выработку других классов антител. Секреторная форма иммуноглобулинов М . Когда В-лимфоциты впервые встречаются в жидкостях организма с неизвестным ранее антигеном, они синтезируют и секретируют в кровь IgM, которые содержат пять мономерных субъединиц, связанных друг с другом дисульфидными связями и дополнительной полипептидной J-цепью. Взаимодействие антигена с IgM изменяет его конформацию и индуцирует связывание его "хвостовой" области с первым компонентом системы комплемента. Если антиген расположен на поверхности микроорганизма, активирование системы комплемента вызывает нарушение целостности клеточной мембраны и гибель бактериальной клетки. Иммуноглобулины G. В количественном отношении IgG доминируют в крови и составляют около 75% от общего количества этих белков. Строение IgG подробно описано выше. В крови IgG обнаруживают только в мономерной форме; он секретируется активированными В-лимфоцитами в больших количествах при вторичном иммунном ответе, когда антиген повторно попадает в организм. У человека обнаружено 4 подкласса IgG: IgGg1, IgGg2, IgGg3, IgGg4. Порядковый номер указывает на количественное содержание каждого подкласса в сыворотке (в наибольшем количестве содержится IgGg1 а в наименьшем - IgGg4). Степень гомологии между этими подклассами очень высока (около 90-95%). IgG не только эффективно связывают и инактивируют чужеродные молекулы и клетки, попавшие в организм, но также облегчают их дальнейшее уничтожение. Конформационные изменения в "хвостовой" области IgG после его взаимодействия с антигеном приводят к связыванию и активации белков системы комплемента. Кроме того, С-концевая область IgG способна взаимодействовать со специфическими рецепторами макрофагов и нейтрофилов, что приводит к фагоцитозу комплексов антиген-антитело и разрушению их в фагосомах (рис. 1-48). IgG - единственный класс антител, способный проникать через плацентарный барьер и обеспечивать внутриутробную защиту плода от инфекций. Иммуноглобулины А. Основной класс антител, присутствующий в секретах желёз организма (слюны, молока, пищеварительного сока, секретов дыхательных путей). В сыворотке крови его содержание не превышает 10-15% от общего количества иммуноглобулинов. Мономерная форма по строению напоминает IgG. Однако в секретах IgA находится в основном в форме димера, где мономеры соединены дополнительной пептидной цепью J. На базальной поверхности эпителиальных клеток димер IgA специфически взаимодействует с белками клеточной поверхности, называемыми секреторным компонентом. Образующийся комплекс посредством эндоцитоза поглощается внутрь клетки и перемещается к апикальной части. Здесь комплекс подвергается действию протеолитических ферментов, и свободный димер высвобождается во внеклеточное пространство (рис. 1-50). Образующийся при взаимодействии IgA с антигеном комплекс не взаимодействует с белками системы комплемента и фагоцитирующими клетками, но препятствует прикреплению антигенов к поверхности эпителиальных клеток и проникновению их в организм. Иммуноглобулины Е. Содержание этого класса иммуноглобулинов в крови крайне мало. IgE - мономеры, но, в отличие от IgG, их тяжёлые цепи е содержат не 3, а 4 константных домена. После синтеза и секреции в кровь В-лимфоцитами IgE После присоединения антигена хотя бы к двум антигенсвязывающим участкам двух соседних IgE клетка получает сигнал к секреции биологически активных веществ (серотонина, гистамина), хранящихся в секреторных пузырьках. Выброс этих веществ в значительной мере ответственен за развитие воспалительной реакции, а также таких аллергических реакций, как бронхиальная астма, крапивница, сенная лихорадка. Увеличение количества IgE может предшествовать развитию аллергических реакций. Иммуноглобулины D. IgD обнаружены в крови в очень малых количествах. Мономерные белки играют роль рецепторов В-лимфоцитов; других функций у IgD пока не выявлено. 12. Ферменты, определение. Особенности ферментативного катализа. Специфичность действия ферментов, виды. Ферменты (энзимы, Е) – биокатализаторы белковой природы.   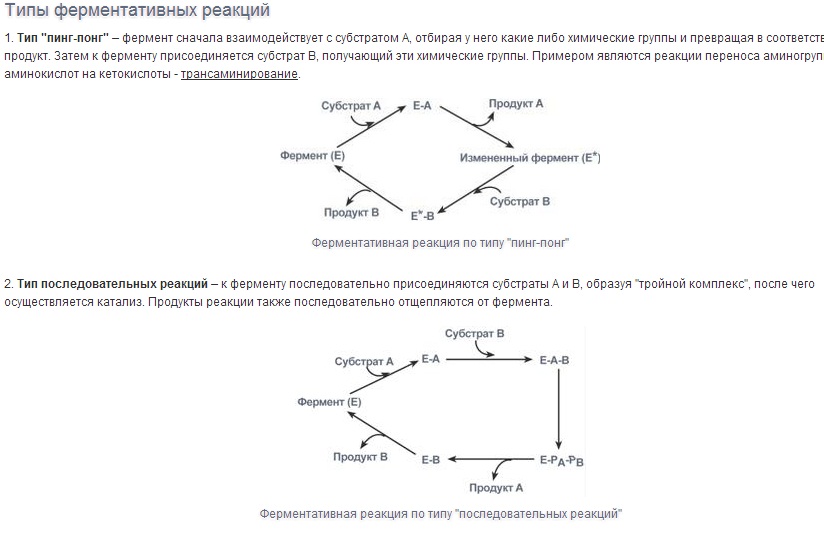 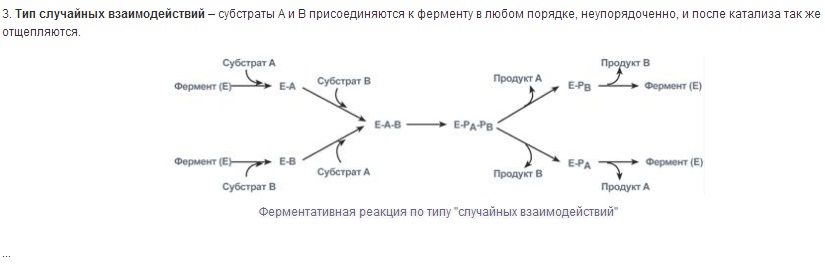 Специфичность - наиболее важное свойство ферментов, определяющее биологическую значимость этих молекул. Различают субстратную и каталитическую специфичности фермента, определяемые строением активного центра. Специфичность - наиболее важное свойство ферментов, определяющее биологическую значимость этих молекул. Различают субстратную и каталитическую специфичности фермента, определяемые строением активного центра.1. Субстратная специфичность - способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Различают: -абсолютную субстратную специфичность; -групповую субстратную специфичность; -стереоспецифичность. Абсолютная субстратная специфичность Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Следует отметить, что таких ферментов в живых организмах мало. Пример фермента с абсолютной субстратной специфичностью - аргиназа, катализирующая реакцию расщепления аргинина до мочевины и орнитина: 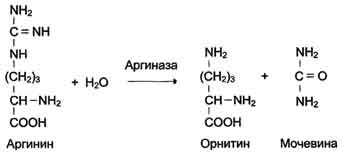 Групповая субстратная специфичность Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов. Так, фермент панкреатическая липаза катализирует гидролиз жиров в двенадцатиперстной кишке человека, катализируя превращение любой молекулы жира (триацилглицерола) до молекулы моноацилглицерола и двух молекул высших жирных кислот. Панкреатическая липаза гидролизует эфирную связь у α-атомов углерода глицерола, независимо от того, какие жирные кислоты входят в состав молекулы жира. Большинство протеолитических ферментов, осуществляющих гидролиз белков, имеет групповую субстратную специфичность, гидролизуя пептидные связи, образованные разными аминокислотами. Стереоспецифичность При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность 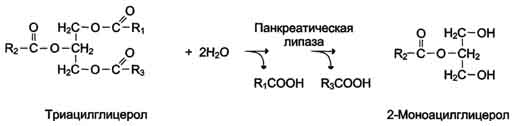 Каталитическая специфичность Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения, Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата. Так, молекула глюкозо-6-фосфата в клетках печени человека - субстрат 4 различных ферментов; фос-фоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы. Однако из-за особенностей строения каталитических участков этих ферментов происходит различное превращение этого соединения с образованием 4 различных продуктов. 13. Классификация и номенклатура ферментов, примеры Каждый фермент имеет 2 названия. Первое - короткое, так называемое рабочее, удобное для повседневного использования. Второе (более полное) - систематическое, применяемое для однозначной идентификации фермента. А. Рабочее название В названии большинства ферментов содержится суффикс "аза", присоединённый к названию субстрата реакции, например уреаза, сахараза, липаза, нуклеаза или к названию химического превращения определённого субстрата, например лактатдегидрогеназа, аденилатциклаза, фосфо-глюкомутаза, пируваткарбоксилаза. Согласно российской классификации ферментов (КФ), названия ферментов пишутся слитно. Однако в употреблении сохранился ряд тривиальных, исторически закреплённых названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения, например трипсин, пепсин, ренин, тромбин. Б. Классы ферментов 1. Оксидоредукпшзы Катализируют различные окислительно-восстановительные реакции с участием 2 субстратов (перенос е- или атомов водорода с одного субстрата на другой). Систематическое наименование ферментов составляют по формуле "донор: акцептороксидоредуктаза", рабочее - субстрат-подкласс оксидоредуктаз. Дегидрогеназы.В этот подкласс входят ферменты, катализирующие реакции дегидрирования (отщепления водорода). В качестве акцепторов электронов используются коферменты NAD+, NADP+, FAD, FMN (см. ниже). Все ферменты этой группы обладают высокой субстратной специфичностью. Пример реакции: 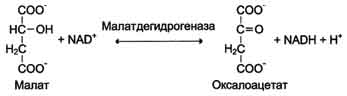 Оксидазы.Акцептором электрона служит молекулярный кислород. Пример реакции, катализируемой цитохромоксидазой: Оксигеназы (гидроксилазы) -атом кислорода из молекулы кислорода присоединяется к субстрату. Пример реакции: 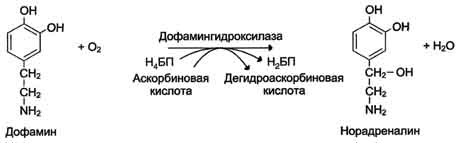 2.Трансферты Катализируют перенос функциональных групп от одного соединения к другому. Подразделяют в зависимости от переносимой группы. Название этих ферментов составляют по формуле "донор: ацетрофэкспортируемая группатрансфераза". К классу трансфераз относят аминотрансферазы, ацилтрансферазы, метилтранс-феразы, гликозилтрансферазы, киназы (фосфо-трансферазы). Примеры реакций 3.Гидролазы Катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Подразделяют в зависимости от расщепляемой связи. Наименование ферментов составляют по формуле "субстрат-гидролаза" или прямым присоединением к названию субстрата суффикса "аза", например протеаза, липаза, фосфолипаза, рибо-нуклеаза. Пример реакции (см. схему Б). Для отдельных классов гидролаз применимы специальные термины, характеризующие гидролиз определённой химической связи: эстеразы, фосфатазы и др. 4. Лиазы К лиазам относят ферменты, отщепляющие от субстратов негидролитическим путём определённую группу (при этом могут отщепляться СО2, Н2О, NH2,SН2и др.) или присоединяющие чаще всего молекулу воды по двойной связи. Наименование ферментов составляют по формуле "субстрат-отщепляемая или присоединяемая группировка". Примеры реакций. 5. Изомеразы Катализируют различные внутримолекулярные превращения. Подразделяют в зависимости от типа реакции изомеризации. Как общее название ферментов этого класса применяют термин "изомеразы" Изомеразы могут катализировать внутримолекулярные окислительно-восстановительные реакции, осуществляя взаимопревращения альдоз и кетоз, кетонных и енольных групп, перемещения двойных связей внутри молекулы . Когда изомеризация состоит во внутримолекулярном переносе группы, фермент называют "мутазой» 6. Лигазы (синтетазы) Катализируют реакции присоединения друг к другу двух молекул с образованием ковалент-ной связи. Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (или других нуклеозидтрифосфатов) или с разрывом макроэргических связей других соединений. В первом случае (при использовании энергии гидролиза АТФ) такие ферменты называют ли-газами, или синтетазами (см. схему Г). В случае, когда источником энергии служит любое другое макроэргическое соединение (не АТФ), ферменты называют синтазами. В. Систематическое название В соответствии с классификацией каждый фермент получил систематическое название, однозначно характеризующее катализируемую им химическую реакцию. Например, D-глицеральдегид-3-фосфат: NAD-оксидоредуктаза (рабочее название - глицеральдегидфосфат дегидрогеназа). Из названия фермента следует, что субстратом этого фермента служит D-глицеральдегид-3-фосфат, тип катализируемой реакции - окислительно-восстановительная в присутствии кофермента NAD+. В 1972 г. комиссией по номенклатуре биохимических соединений Международного союза теоретической и прикладной химии были предложены "Правила номенклатуры ферментов", имеющие кодовое четырёхзначное цифровое обозначение, где первая цифра обозначает класс фермента, вторая цифра (подкласс) уточняет преобразуемую группировку, третья (подподкласс) - уточняет дополнительных участников реакции (например, донора и акцептора) и четвёртая - порядковый номер фермента в данной подгруппе. Так, фермент малатдегидрогеназа имеет систематическое название L-малат: NAD-оксидоредуктаза и кодовый шифр 1.1.1.38. Шифр означает, что этот фермент относят к первому классу ферментов - оксидоредуктаз, окисляемая группа - гидроксильная группировка (1) в присутствии кофермента NAD+ (1) и порядковый номер фермента в этой подгруппе - 38. Кодовую номенклатуру ферментов в основном используют в научной литературе. 14. Строение ферментов. Каталитический и регуляторный центры. Взаимодействие ферментов с лигандами. Механизм действия ферментов. Формирование фермент-субстратного комплекса. Гипотеза «ключ-замок» и гипотеза индуцированного соответствия. Все ферменты это белки с молекулярной массой от 15 000 до нескольких млн Да. По химическому строению различают простые ферменты (состоят только из АК) и сложные ферменты (имеют небелковую часть или простетическую группу). Белковая часть носит название – апофермент, а небелковая, если она связана ковалентно с апоферментом, то называется кофермент, а если связь нековалентная (ионная, водородная) – кофактор. Функции простетической группы следующие: участие в акте катализа, осуществление контакта между ферментом и субстратом, стабилизация молекулы фермента в пространстве. В роли кофактора обычно выступают неорганические вещества - ионы цинка, меди, калия, магния, кальция, железа, молибдена. 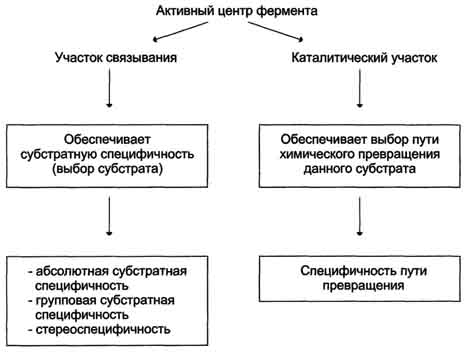 Коферменты можно рассматривать как составную часть молекулы фермента. Это органические вещества, среди которых различают: нуклеотиды (АТФ, УМФ, и пр), витамины или их производные (ТДФ – из тиамина (В1), ФМН – из рибофлавина (В2), коэнзим А – из пантотеновой кислоты (В3), НАД и пр) и тетрапиррольные коферменты – гемы. В процессе катализа реакции в контакт с субстратом вступает не вся молекула фермента, а определенный ее участок, который называется активным центром. Эта зона молекулы не состоит из последовательности аминокислот, а формируется при скручивании белковой молекулы в третичную структуру. Отдельные участки аминокислот сближаются между собой, образуя определенную конфигурацию активного центра. Важная особенность строения активного центра - его поверхность комплементарна поверхности субстрата, т.е. остатки АК этой зоны фермента способны вступать в химическое взаимодействие с определенными группами субстрата. Можно представить, что активный центр фермента совпадает со структурой субстрата как ключ и замок. В активном центре различают две зоны: центр связывания, ответственный за присоединение субстрата, и каталитический центр, отвечающий за химическое превращение субстрата. В состав каталитического центра большинства ферментов входят такие АК, как Сер, Цис, Гис, Тир, Лиз. Сложные ферменты в каталитическом центре имеют кофактор или кофермент. Помимо активного центра ряд ферментов снабжен регуляторным (аллостерическим) центром. С этой зоной фермента взаимодействуют вещества, влияющие на его каталитическую активность. Ферменты обладают высокой специфичностью, поэтому выдвинули гипотезу, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная, жёстко детерминированная структура. В 1959 г. был предложен другой вариант гипотезы "ключ-замок", объясняющий события в активном центре фермента. По этой гипотезе активный центр является гибкой структурой по отношению к субстрату. Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции. Эта "гипотеза индуцированного соответствия" впоследствии получила экспериментальное подтверждение. |
