Значение биохимии в подготовке врача. Биологическая химия
 Скачать 8.33 Mb. Скачать 8.33 Mb.
|
|
15. Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от температуры, рН среды, концентрации ферментов и субстрата. Уравнение Михаэлиса-Ментен, Кm. Кинетика ферментативных реакций - раздел энзимологии, изучающий зависимость скорости химических реакций, катализируемых ферментами, от химической природы реагирующих веществ, а также от факторов окружающей среды. Для измерения каталитической активности ферментов используют такие показатели, как скорость реакции или активность фермента. Скорость ферментативной реакции определяется изменением количества молекул субстрата или продукта за единицу времени. Скорость ферментативной реакции - мера каталитической активности фермента, её обозначают как активность фермента. Математически скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение) или продукта (увеличение) за единицу времени: V= D[S]/t = D[P]/t. На начальном этапе [0 - t0] скорость реакции прямо пропорциональна времени и имеет линейную зависимость. Графически изменение скорости ферментативной реакции определяется тангенсом угла наклона касательной к кривой профиля реакции. Чем больше угол наклона, тем больше изменение скорости реакции. С течением времени изменение скорости ферментативной реакции в экспериментальных условиях уменьшается, об этом свидетельствует уменьшение угла наклона касательной в момент времени t. Снижение скорости ферментативной реакции может происходить за счёт ряда факторов: уменьшения концентрации субстрата, увеличения концентрации продукта, который может оказывать ингибирующее действие, могут происходить изменения рН раствора, инактивация фермента и т.д. На этапе [t1 - tx] скорость реакции изменяется нелинейно в зависимости от времени. Поэтому для определения скорости ферментативной реакции чаще всего исследуют изменение скорости на начальном этапе [t0 - t1], где наблюдают линейное изменение концентрации продукта (или субстрата). Скорость ферментативной реакции зависит от ряда факторов, таких как количество и активность ферментов, концентрация субстрата, температура среды, рН раствора, присутствие регуляторных молекул (активаторов и ингибиторов). Рассмотрим влияние этих факторов на скорость ферментативной реакции. А. Зависимость скорости ферментативной реакции от количества ферментов При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента. Графическая зависимость такой реакции имеет вид прямой линии. Однако количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: одна международная единица активности (ME) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов. Количество единиц активности nME определяют по формуле: В 1973 г. была принята новая единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с. Количество каталов определяют по формуле: n катал =
Международная единица ферментативной активности ME связана с каталом следующими равенствами: 1 кат = 1 моль S/c = 60 моль S/мин = 60х106мкмоль/мин = 6х107ME, 1 ME = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат. Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (пМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани: Уд. ак. =
По удельной активности судят об очистке фермента: чем меньше посторонних белков, тем выше удельная активность. Б. Зависимость скорости ферментативной реакции от температуры среды Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы. Для большинства ферментов человека оптимальна температура 37-38 °С. Однако в природе существуют и термостабильные ферменты. Например, Taq-полимераза, выделенная из микроорганизмов, живущих в горячих источниках, не инактивируется при повышении температуры до 95 °С. Этот фермент используют в научно-практической медицине для молекулярной диагностики заболеваний с использованием метода полимеразной цепной реакции (ПЦР). В. Зависимость скорости ферментативной реакции от рН среды Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности. Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности. Оптимум значения рН у разных ферментов различный. Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН. Г. Зависимость скорости ферментативной реакции от количества субстрата Если концентрацию ферментов оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывают гиперболой. При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax. Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта. Это наблюдение легло в основу ферментативной кинетики, разработанной учёными Л. Михаэлисом и М. Ментен в 1913 г. Ферментативный процесс можно выразить следующим уравнением:  где k1 - константа скорости образования фермент-субстратного комплекса; k-1 - константа скорости обратной реакции, распада фермент-субстратного комплекса; k2 - константа скорости образования продукта реакции. Следующее соотношение констант скоростей (k-1 + k2)/k1 называют константой Михаэлиса и обозначают Кm. Скорость реакции пропорциональна концентрации фермент-субстратного комплекса ES, a скорость образования ES зависит от концентрации субстрата и концентрации свободного фермента. На концентрацию ES влияет скорость формирования и распада ES. Наибольшая скорость реакции наблюдается в том случае, когда все молекулы фермента находятся в комплексе с субстратом, т.е. в фермент-субстратном комплексе ES, т.е. [Е] = [ES]. Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением (математическое выведение этой формулы можно найти в пособиях по ферментативной кинетике):
V = Это уравнение получило название уравнения Михаэлиса-Ментен. В случае, когда скорость реакции равна половине максимальной, Km = [S] (рис. 2-19). Таким образом, константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости. Уравнение Михаэлиса-Ментен - основное уравнение ферментативной кинетики, описывающее зависимость скорости ферментативной реакции от концентрации субстрата. Если концентрация субстрата значительно больше Km (S >> Km), to увеличение концентрации субстрата на величину Кm практически не влияет на сумму (Km + S) и её можно считать равной концентрации субстрата. Следовательно, скорость реакции становится равной максимальной скорости: V = Vmax. В этих условиях реакция имеет нулевой порядок, т.е. не зависит от концентрации субстрата. Можно сделать вывод, что Vmax - величина постоянная для данной концентрации фермента, не зависящая от концентрации субстрата. Если концентрация субстрата значительно меньше Km(S << Km), то сумма (Km + S) примерно равна Кm, следовательно, V = Vmax[S]/Km, т.е. в данном случае скорость реакции прямо пропорциональна Vmах и Km - кинетические характеристики эффективности фермента. Vmax дает характеристику каталитической активности фермента и имеет размерность скорости ферментативной реакции моль/л, т.е. определяет максимальную возможность образования продукта при данной концентрации фермента и в условиях избытка субстрата. Кm характеризует сродство данного фермента к данному субстрату и является величиной постоянной, не зависящей от концентрации фермента. Чем меньше Кm, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции и наоборот, чем больше Кm, тем меньше начальная скорость реакции, тем меньше сродство фермента к субстрату. На рис. 2-20 представлена зависимость скорости двух ферментативных реакций (1 и 2) от концентрации субстрата. Константа Михаэлиса первого фермента меньше константы Михаэлиса второго фермента (Kml < Km2). Следовательно, сродство первого фермента к субстрату выше, чем у второго фермента, и начальная скорость реакции, катализируемой первым ферментом, выше в сравнении со вторым ферментом. 16. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов В6, РР, В2 на примере трансаминаз и дегидрогеназ. Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах). Термин. "кофермент" был введён в начале XX века и обозначал часть некоторых ферментов, которая легко отделялась от белковой молекулы фермента и удалялась через полупроницаемую мембрану при диализе. Несколько позже было выяснено, что большинство ферментов состоит из термолабильной белковой части и термостабильного небелкового фактора - кофермента. Белковая часть получила название "апофермент", который в отсутствие кофермента не обладает каталитической активностью. Кофермент с белковой молекулой (апоферментом) формируют молекулу холофермента, обладающую каталитической активностью. А. Кофакторы Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов. Рассмотрим роль кофакторов в ферментативном катализе. Роль металлов в ферментативном катализе Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа. Участие в электрофильном катализе Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. Это, в первую очередь, такие металлы, как Zn2+, Fe2+, Mn2+, Cu2+. Ионы щёлочно-земельных металлов, такие как Na+ и К+, не обладают этим свойством. В качестве примера можно рассмотреть функционирование фермента карбоангидразы. Карбоангидраза - цинксодержащий фермент, катализирующий реакцию образования угольной кислоты: СО + H2O ↔ H2CO3. Ион Zn2+ в результате электрофильной атаки участвует в образовании Н+ и ОН- ионов из молекулы воды: 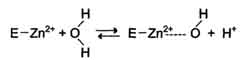 Протон и гидроксйльная группа последовательно присоединяются к диоксиду углерода с образованием угольной кислоты. В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений. Участие в окислительно-восстановительных реакциях Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон: Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях. Другой пример участия ионов металлов в окислительно-восстановительных реакциях - работа фермента дофамингидроксилазы, катализирующего реакцию образования норадреналина при участии витамина С За окислительно-восстановительные свойства у дофамингидроксилазы отвечает ион меди Фермент, содержащий ион Сu2+, не вступает в реакцию с молекулой кислорода. При восстановлении Си2+ до Си+ с помощью аскорбиновой кислоты образуется ион меди, способный взаимодействовать с кислородом с образованием перекисного соединения. Далее гидроксильная группа переносится на молекулу дофамина с образованием норадреналина. Коферменты Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента. Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат. Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+. Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот. Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов. К коферментам относят следующие соединения: -производные витаминов; -гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов; -нуклеотиды - доноры и акцепторы остатка фосфорной кислоты; -убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ; -фосфоаденозилфосфосульфат, участвующий в переносе сульфата; -S-аденозилметионин (SAM) - донор метильной группы; -глутатион, участвующий в окислительно-восстановительных реакциях. Строение и функции этих коферментов подробно рассмотрены в соответствующих разделах учебника. Водораствор витамины являются энзимовитаминами, то есть выполняют коферментные функции в составе ферментов. Проявления и механизмы гиповитаминозов по различным энзимовитаминам взаимосвязаны и перекрываются, хотя для большинства из них описаны и специфические авитаминозы. Витамин В2, рибофлавин. входит в состав двух коферментов ФМН и ФАД, являющихся компонентами таких ферментов как сукцинатдегидрогеназа, дегидрогеназы жирных кислот, оксидаз аминокислот, МАО, цитохромредуктазы.Витамин В5, РР входит в состав коферментов НАД и НАДФ,которые являются коферментами более ста дегидрогеназ, участвующих в тканевом дыхании, окислении молочной, яблочной, кетоглутаровой, изолимонной кислот, фосфоглицеринового альдегида, жирных кислот и т.п.Витамин В6, пиридоксин Этот витамин в виде коферментов ПАЛФ (пиридоксальфосфата) и ПАМФ(пиридоксаминфосфата) входит в состав ферментов переаминирования, дезаминирования и декарбоксилирования аминокислот. В реакциях с участием пиридоксина, осуществляется всасывание и транспорт аминокислот, балансируется аминокислотный состав организма.Витамин Н, биотин служит коферментом карбоксилаз, таких как пируваткарбоксилаза, ацетил-КоА-карбоксилаза, пропионил-КоА-карбоксилаза. Биотин связывает молекулу углекислого газа и включает его в органическое вещество. Как кофермент витамин Н участвует т в синтезе жирных кислот, стеринов, пуриновых оснований, мочевины, превращении пиовиноградной кислоты в щавелевоуксусную кислоту.Витамин В3, пантотеновая кислота входит в состав кофермента ацетилирования (КоА), который активирует ацетат и ацильные группы, необходимые для синтеза жирных кислот, стеролов, ацетилхолина. Пантотеновая кислота участвует в биосинтезе жирных кислот 17. Ингибирование активности ферментов: обратимое (конкурентное и неконкурентное) и необратимое. Лекарственные препараты как ингибиторы ферментов. Ингибирование ферментативной активности - снижение каталитической активности в присутствии определённых веществ - ингибиторов. К ингибиторам следует относить вещества, вызывающие снижение активности фермента. Следует отметить, что все денатурирующие агенты также вызывают уменьшение скорости любой ферментативной реакции, вследствие неспецифической денатурации белковой молекулы, поэтому денатурирующие агенты к ингибитррам не относят. Ингибиторы вызывают большой интерес для выяснения механизмов ферментативного катализа, помогают установить роль отдельных ферментов в метаболических путях организма. В основе действия многих лекарственных препаратов и ядов лежит ингибирование активности ферментов, поэтому знание механизмов этого процесса крайне важно для молекулярной фармакологии и токсикологии. Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. По механизму действия ингибиторы подразделяют на конкурентные и неконкурентные. Обратимое ингибирование Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными. 1. Конкурентное ингибирование К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется. Для конкурентного типа ингибирования справедливы следующие уравнения: Е + S ⇔ ES → E + P, E + I ⇔ EI. Классический пример конкурентного ингибирования - ингибирование сукцинатдегидрогеназной реакции малоновой кислотой. Малоновая кислота - структурный аналог сукцината (наличие двух карбоксильных групп) и может также взаимодействовать с активным центром сукци-нат дегидрогеназы. Однако отщепление двух атомов водорода от малоновой кислоты невозможно; следовательно, скорость реакции снижается. Конкурентные ингибиторы уменьшают скорость химической реакции. Конкурентный ингибитор повышает Кm для данного субстрата (уменьшает сродство субстрата к ферменту). Это означает, что в присутствии конкурентного ингибитора необходима большая концентрация субстрата для достижения 1/2 Vmax. Увеличение соотношения концентрации субстрата и ингибитора снижает степень ингибирования. При значительно более высоких концентрациях субстрата ингибирование полностью исчезает, потому что активные центры всех молекул фермента будут находиться преимущественно в комплексе с субстратом. Четвертичные аммониевые основания ингибируют ацетилхолинэстеразу, катадизирующую реакцию гидролиза ацетилхолина на холин и уксусную кислоту (см. схему ниже) При добавлении ингибиторов активность ацетилхолинэстеразы уменьшается, концентрация ацетилхолина (субстрата) увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы используют при лечении мышечных дистрофий. Эффективные антихолинэстеразные препараты - прозерин, эндрофоний и др. 2. Неконкурентное ингибирование Неконкурентным называют ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентные ингибиторы не являются структурными аналогами субстрата. Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции. Кинетические зависимости Этот тип ингибирования характеризуется снижением Vmax ферментативной реакции и уменьшением сродства субстрата к ферменту, т.е. увеличением Кm. Необратимое ингибирование Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию. К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению. При наличии реактиваторов ферментативная функция восстанавливается. В больших концентрациях ионы тяжёлых металлов вызывают денатурацию белковой молекулы фермента, т.е. приводят к полной инактивации фермента. 18. Аллостерическая регуляция активности ферментов. Роль аллостерических ферментов в метаболизме клетки. Аллостерические эффекторы и ингибиторы. Особенности строения и функционирования аллостерических ферментов и их локализация в метаболических путях. Регуляция активности ферментов по принципу отрицательной обратной связи. Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами. Участвующие в аллостерической регуляции эффекторы - клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют. Роль аллостерических ферментов в метаболизме клетки. Аллостерические ферменты играют важную роль в метаболизме, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состояния клетки. Аллостерическая регуляция имеет большое значение в следующих ситуациях: -при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений; -при катаболических процессах. В случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии. Субстраты при этом расходуются на реакции запасания резервных питательных веществ; -для координации анаболических и катаболических путей. АТФ и АДФ - аллостерические эффекторы, действующие как антагонисты; -для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот). Таким образом, конечные продукты одного метаболического пути могут быть аллостерическими эффекторами другого метаболического пути. Аллостерические эффекторы. Эффектор, вызывающий снижение (ингибирование) активности фермента, называют отрицательным эффектором, или ингибитором. Эффектор, вызьгоаюший повышение (активацию) активности ферментов, называют положительным эффектором, или активатором. Аллостерическими эффекторами часто служат различные метаболиты. Конечные продукты метаболического пути - часто ингибиторы аллостерических ферментов, а исходные вещества - активаторы. Это так называемая гетеротропная регуляция. Такой вид аллостерической регуляции очень распространён в биологических системах. Более редкий случай аллостерической регуляции, когда сам субстрат может выступать в качестве положительного эффектора. Такая регуляция называется гомотропной (эффектор и субстрат - одно и то же вещество). Эти ферменты имеют несколько центров связывания для субстрата, которые могут выполнять двойную функцию: каталитическую и регуляторную. Аллостерические ферменты такого типа используются в ситуации, когда субстрат накапливается в избытке и должен быстро преобразоваться в продукт. Выявить ферменты с аллостерической регуляцией можно, изучая кинетику этих ферментов. Эти ферменты не подчиняются законам Михаэлиса-Ментен, они имеют характерную S-образную кривую зависимости скорости реакции от концентрации субстрата. Особенности строения и функционирования аллостерических ферментов: -обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение; -они имеют аллостерический центр, пространственно удалённый от каталитического активного центра; -эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах; -аллостерические центры, так же, как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие - к ингибиторам. -протомер, на котором находится аллостерический центр, - регуляторный протомер, в отличие от каталитического протомера, содержащего активный центр, в котором проходит химическая реакция; -аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента; -регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента; -аллостерические ферменты катализируют ключевые реакции данного метаболического пути. 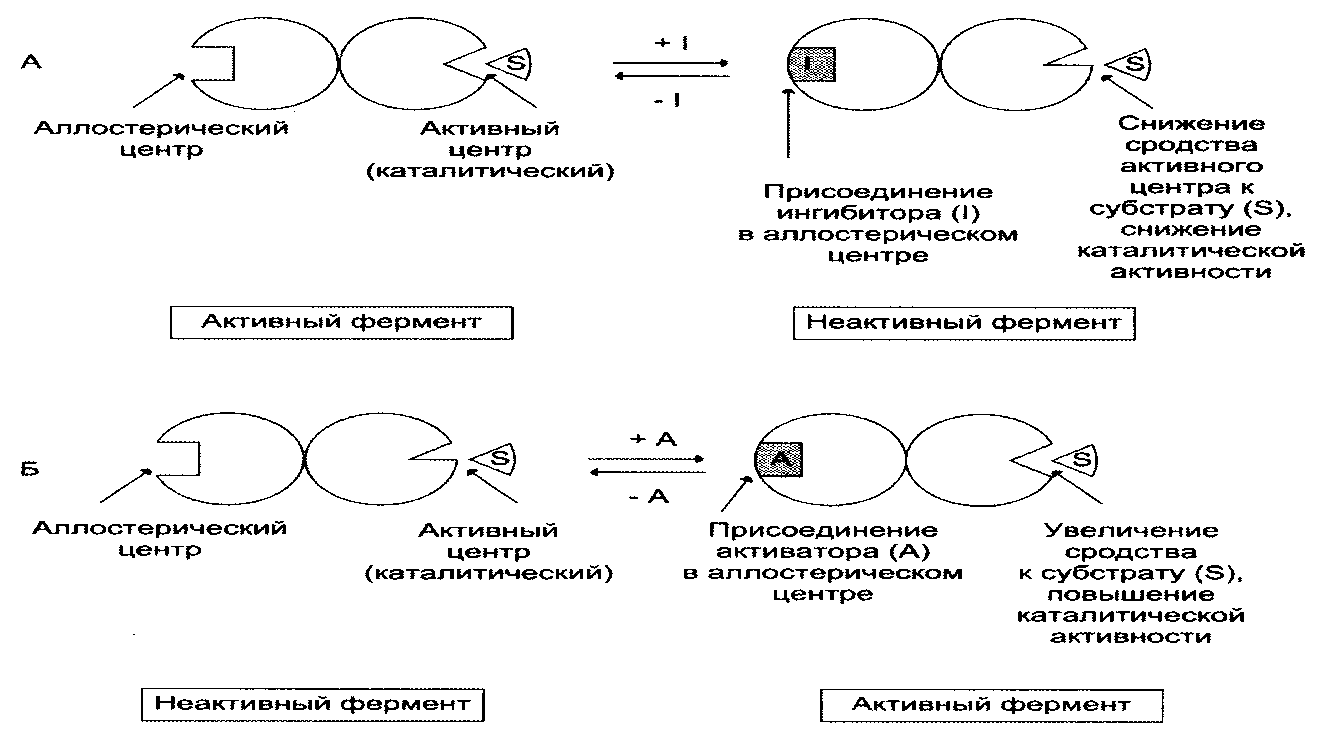 Локализация аллостерических ферментов в метаболическом пути. Скорость метаболических процессов зависит от концентрации веществ, использующихся и образующихся в данной цепи реакций. Такая регуляция представляется логичной, так как при накоплении конечного продукта он (конечный продукт) может действовать как аллостерический ингибитор фермента, катализирующего чаще всего начальный этап данного метаболического пути: 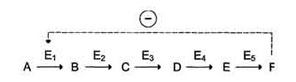 Фермент, катализирующий превращение субстрата А в продукт В, имеет аллостерический центр для отрицательного эффектора, которым служит конечный продукт метаболического пути F. Если концентрация F увеличивается (т.е. вещество F синтезируется быстрее, чем расходуется), ингибируется активность одного из начальных ферментов. Такую регуляцию называют отрицательной обратной связью, или ретроингибировани-ем. Отрицательная обратная связь - часто встречающийся механизм регуляции метаболизма в клетке. В центральных метаболических путях исходные вещества могут быть активаторами ключевых ферментов метаболического пути. Как правило, при этом аллостерической активации подвергаются ферменты, катализирующие ключевые реакции заключительных этапов метаболического пути: 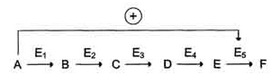 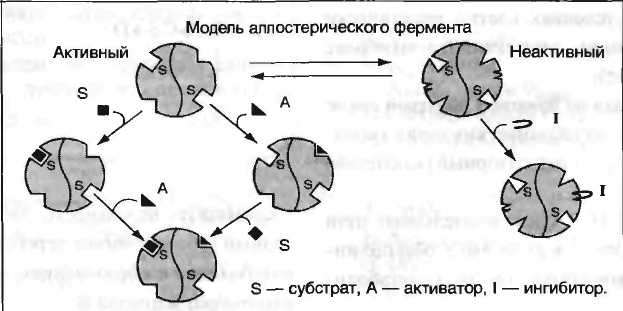 Каталитическая активность некоторых регуляторных ферментов может модулироваться низкомолекулярными аллостерическими эффекторами, обычно имеющими либо незначительное структурное сходство с субстратами или с коферментами регулируемого ими фермента, либо не имеющими его вообще. Ингибирование фермента, катализирующего одну из реакций в цепи, конечным продуктом этой цепи называют ингибированием по принципу обратной связи. В цепи реакций биосинтеза D из А, катализируемой ферментами при высоких концентрациях D обычно наблюдается ингибирование превращения А в В. Это не простое «обращение» реакции, связанное с накоплением промежуточных продуктов, а следствие того, что продукт D способен связываться с ферментом выступая в качестве его ингибитора. Таким образом, D действует как отрицательный аллостерический эффектор фермента, или ингибитор, действующий по принципу обратной связи. Следовательно, ингибирование под действием D регулирует синтез D. Обычно D связывается с ингибируемым ферментом в аллостерическом центре, удаленном от каталитического центра. В кинетическом плане ингибирование по принципу обратной связи может быть конкурентным, неконкурентным, частично конкурентным и смешанным. Ингибирование по принципу обратной связи характерно для биосинтетических путей. Очень часто ингибитор, действующий по принципу обратной связи, является последней малой молекулой перед синтезом макромолекулы (например, аминокислотой, если речь идет о синтезе белков, или нуклеотидом в синтезе нуклеиновых кислот). Регуляция по принципу обратной связи обычно происходит на первой функционально необратимой стадии, уникальной для данной цепи реакций биосинтеза. Примерами ингибирования по принципу обратной связи в микроорганизмах могут служить ингибирование фосфорибозил: АТР—пирофосфорилазы гистидином, антранилатсинтазы—триптофаном, аспартаттранскарбамоилазы — под действием СТР. В каждом случае регуляторный фермент участвует в цепи реакций биосинтеза единственного конечного продукта - His, Тrр или СТР. Цепь реакций биосинтеза часто бывает разветвленной— ее первые реакции дают начало синтезу сразу двух или большего числа метаболитов. На рис. 10.4 указаны вероятные участки в разветвленной цепи биосинтеза, по которым осуществляется простое ингибирование по принципу обратной связи (ингибиторами могут служить аминокислоты, пурины или пиримидины). являются предшественниками всех четырех конечных продуктов - предшественником предшественником только D. Последовательности являются линейными и могут подвергаться ингибированию конечными продуктами по принципу обратной связи.  19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования. В биологических системах часто встречается механизм регуляции активности ферментов с помощью ковалентной модификации аминокислотных остатков. Быстрый и широко распространённый способ химической модификации ферментов - фосфорилирование/дефосфорилирование. Модификации подвергаются ОН-группы фермента. Фос-форилирование осуществляется ферментами протеинкиназами, а дефосфорилирование - фосфопротеинфосфатазами. Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными. Изменение активности фермента, вызванное фосфорилированием, обратимо. Отщепление остатка фосфорной кислоты осуществляется ферментами фосфопротеинфосфатазами. Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро изменять активность ключевых ферментов метаболических путей в зависимости от условий внешней среды. Антагонистичные по функции гормоны противоположным образом влияют на фосфо-рилирование/дефосфорилирование ферментов, вызывая противоположные эффекты изменения метаболизма клетки. Например, под действием глюкагона (в период между приёмами пищи) в клетках происходит уменьшение синтеза энергетического материала - жира, гликогена и усиление его распада (мобилизация), вызванного фосфо-рилированием ключевых ферментов этих процессов. А под действием инсулина (во время пищеварения), наоборот, активируется синтез гликогена и ингибируется его распад, так как взаимодействие инсулина с рецептором активирует сигнальный путь, приводящий к дефосфорилированию тех же ключевых ферментов. 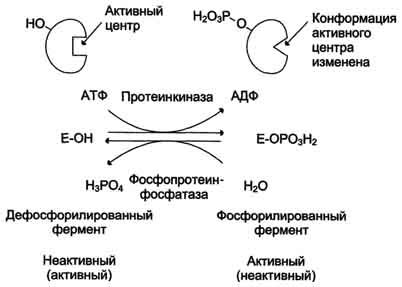 20. Ассоциация и диссоциация протомеров на примере протеинкиназы А и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции протеолитической активности ферментов. Протеинкиназы - группа ферментов, катализирующих перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (вызывают фосфорилирование белков). Механизмы активации различных протеинкиназ неодинаковы. В качестве примера регуляции каталитической активности ферментов ассоциацией или диссоциацией протомеров можно привести регуляцию активности фермента Протеинкиназы А. Протеинкиназа А(цАМФ-зависимая) состоит из 4 субъединиц 2 типов: 2 регуляторных (R) и 2 каталитических (С). Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3',5'-АМФ (цАМФ), по 2 на каждую субъединицу. Присоединение 4 молекул цАМФ к 2 регуляторным субъединицам приводит к изменению конфор-мации регуляторных протомеров и к диссоциации тетрамерного комплекса, при этом высвобождаются 2 активные каталитические субъединицы (рис. 2-32). Такой механизм регуляции обратим. Отщепление молекул цАМФ от регуляторных субъединиц приведёт к ассоциации регуляторных и каталитических субъединиц Протеинкиназы А с образованием неактивного комплекса. Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом Некоторые ферменты, функционирующие вне клеток (в ЖКТ или в плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определённых пептидных связей, что приводит к отщеплению части белковой молекулы предшественника. В результате в оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента. Рассмотрим механизм частичного протеолиза на примере активации протеолитического фермента трипсина (рис. 2-34). Трип-синоген, синтезируемый в поджелудочной железе, при пищеварении по протокам поджелудочной железы поступает в двенадцатиперстную кишку, где и активируется путём частичного протеолиза под действием фермента кишечника энтеропептидазы. В результате отщепления гексапептида с N-конца формируется активный центр в оставшейся части молекулы. Следует напомнить, что трипсин относят к семейству "сериновых" протеаз - активный центр фермента содержит функционально важный остаток Сер. Частичный протеолиз - пример регуляции, когда активность фермента изменяется необратимо. Такие ферменты функционируют, как правило, в течение короткого времени, определяемого временем жизни белковой молекулы. Частичный протеолиз лежит в основе активации протеолитических ферментов, белков свёртывающей системы крови и фибринолиза, белков системы комплемента, а также пептидных гормонов. 21. Изоферменты: происхождение, биологическое значение, примеры. Определение ферментов и изоферментного спектра плазмы крови с целью диагностики заболеваний. Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка, называют изоферментами, или изоэнзимами. Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента. Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов. По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой - изомерные формы. Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний. Изоформы лактатдегидрогеназы. Фермент лак-татдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты). Лактатдегидрогеназа - олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ, muscle - мышца) и Н (от англ, heart - сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы (рис. 2-35, А). ЛДГ1 и ЛДГ2наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 - в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента. Изоформы ЛДГ отличаются электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ. 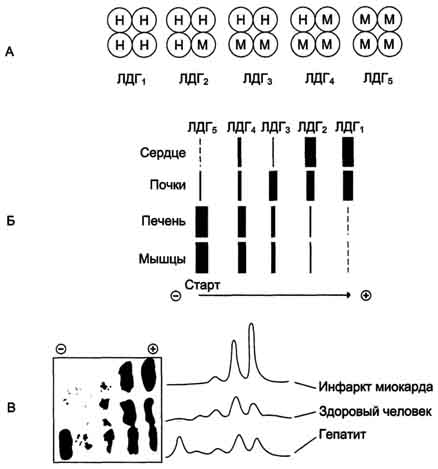 Появление в эволюции различных изоформ ЛДГ обусловлено особенностями окислительного метаболизма тканей. Изоферменты ЛДГ4 и ЛДГ5 (М-типы ЛДГ) работают эффективно в анаэробных условиях, ЛДГ, и ЛДГ2 (Н-типы) - в аэробных, когда пируват быстро окисляется до СО2 и Н2О, а не восстанавливается до молочной кислоты. При ряде заболеваний исследуют активность ЛДГ в плазме крови. В норме активность ЛДГ составляет 170-520 ЕД/л. Повышение активности наблюдают при острых поражениях сердца, печени, почек, а также при мегалобластных и гемолитических анемиях. Однако это указывает на повреждение лишь одной из перечисленных тканей. Для постановки диагноза необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. На рис. 2-35, В представлены электрофореграммы плазмы крови здорового человека, больного инфарктом миокарда и больного гепатитом. Выявление в плазме крови тканеспецифичес-ких изоформ ЛДГ используют в качестве диагностического теста повреждения данной ткани. Изоформы лактатдегидрогеназы. А - строение различных изоформ ЛДГ; Б - распределение на электрофореграмме и относительные количества изоформ ЛДГ в различных органах; В - содержание изоформ ЛДГ в плазме крови в норме и при патологии (электрофореграммы - слева и фотометрическое сканирование - справа). 22. Энзимопатии наследственные (фенилкетонурия) и приобретенные (цинга). Применение ферментов для лечения болезней. ЭНЗИМОПАТИИ (энзим[ы] + греч. pathos страдание, болезнь; син. ферментопатии) - общее название болезней, развивающихся вследствие отсутствия или снижения активности тех или иных ферментов - белков, выполняющих функцию специфических катализаторов превращения веществ в организме. Выделяют наследственные и приобретенные энзимопатии. Наследственные энзимопатии связаны с генетически обусловленной недостаточностью одного или нескольких ферментов (см. Наследственные болезни). Особенностью течения наследственных Э. является наличие скрытого периода, когда болезнь не имеет выраженных клин. симптомов, но может быть заподозрена или установлена на основании биохим. исследований крови, мочи или кала. Со временем в связи с ферментативным дефектом в организме накапливаются промежуточные продукты обмена веществ, нарушающие функцию тех или иных органов, что обусловливает появление клин. признаков болезни. Обычно первые клин. симптомы наследственных Э. обнаруживаются в раннем детском возрасте, однако в ряде случаев болезнь клинически проявляется у детей более старшего возраста или у взрослых. Проявления зависят от характера нарушения того или иного вида обмена веществ. Приобретенные энзимопатии. Одним из наиболее частых вариантов приобретенных Э. являются алиментарные Э. - патологические состояния, обусловленные стойкими нарушениями активности ферментов в связи с характером питания. Собственно алиментарные Э. могут быть обусловлены длительным дефицитом белка в питании (напр., при квашиоркоре), нарушением биосинтеза коферментов при витаминной недостаточности, угнетением синтеза металлоферментов при низком содержании в рационе соответствующих минеральных веществ. Кроме того, они могут возникать при несбалансированном питании в целом, напр. при нарушении соотношения аминокислот, жирных кислот, водо- и жирорастворимых витаминов или отдельных минеральных веществ. К развитию собственно алиментарных Э. может приводить также нарушение поступления пищевых веществ из жел. -киш. тракта в кровь при длительных поносах, атрофии слизистой оболочки кишечника и др. К алиментарным Э. относят и так наз. токсические Э., связанные с угнетением активности или биосинтеза отдельных ферментов и с неспецифическим угнетением синтеза белка различными естественными компонентами пищевых продуктов (ингибиторы протеолитических ферментов, антивитамины и др. ) или чужеродными веществами (напр., пестицидами), содержащимися в них. Использование ферментов в качестве терапевтических средств имеет много ограничений вследствие их высокой иммуногениости. Тем не менее энзимотерапию активно развивают в следующих направлениях: -заместительная терапия - использование ферментов в случае их недостаточности; -элементы комплексной терапии - применение ферментов в сочетании с другой терапией. Заместительная энзимотерапия эффективна при желудочно-кишечных заболеваниях, связанных с недостаточностью секреции пищеварительных соков. Например, пепсин используют при ахилии, гипо- и анацидных гастритах. Дефицит панкреатических ферментов также в значительной степени может быть компенсирован приёмом внутрь препаратов, содержащих основные ферменты поджелудочной железы (фестал, энзистал, мезим-форте и др.). В качестве дополнительных терапевтических средств ферменты используют при ряде заболеваний. Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей. Ферментные препараты рибонуклеазу и дезоксирибонуклеазу используют в качестве противовирусных препаратов при лечении аденовирусных конъюнктивитов, герпетических кератитов. Ферментные препараты стали широко применять при тромбозах и тромбоэмболиях. С этой целью используют препараты фибринолизина, стрептолиазы, стрептодеказы, урокиназы. Фермент гиалуронидазу (лидазу), катализирующий расщепление гиалуроновой кислоты, используют подкожно и внутримышечно для рассасывания контрактур рубцов после ожогов и операций (гиалуроновая кислота образует сшивки в соединительной ткани) (см. раздел 8). Ферментные препараты используют при онкологических заболеваниях. Аспарагиназа, катализирующая реакцию катаболизма аспарагина, нашла применение для лечения лейкозов:  Предпосылкой антилейкемического действия аспарагиназы послужило обнаружение в лейкоз-ных клетках дефектного фермента аспарагинсинтетазы, катализирующего реакцию синтеза аспарагина (см. схему ниже). Лейкозные клетки не могут синтезировать аспарагин и получают его из плазмы крови. Если имеющийся в плазме аспарагин разрушать введением аспарагиназы, то в лейкозных клетках наступит дефицит аспарагина и в результате - нарушение метаболизма клетки.  23. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротоцидурия. Б. "Запасные" пути синтеза пиримидиновых нуклеотидов Использование пиримидиновых оснований и нуклеозидов в реакциях реутилизации препятствует катаболизму этих соединений до конечных продуктов с расщеплением пиримидинового кольца. В ресинтезе пиримидинов участвуют некоторые ферменты катаболизма нуклеотидов. Так, уридинфосфорилаза в обратимой реакции может рибозилироватъ урацил с образованием уридина. Урацил + Рибозо-1-фосфат → Уридин + Н3РО4. Превращение нуклеозидов в нуклеотиды катализирует уридин-цитидинкиназа. |
