Значение биохимии в подготовке врача. Биологическая химия
 Скачать 8.33 Mb. Скачать 8.33 Mb.
|
                   
изучения структурной организации, анаболизма и катаболизма живой материи. Значение биохимии в подготовке врача. Биологическая химия (биохимия) — это наука, изучающая химический состав живых организмов, превращения веществ и энергии, лежащей в основе их жизнедеятельности. Совокупность этих превращений составляет биологический обмен веществ, который является основой той формы движения материи, которую мы называем жизнью. Живые организмы обладают необычными свойствами, отсутствующими в скоплении неживых молекул. К ним относятся следующие свойства: 1.1 Сложность и высокая степень организованности. Живые организмы представлены миллионами разных видов. 1.2 Любая составная часть организма имеет специальное назначение и выполняется строго определенную функцию. Это относится даже к индивидуальным химическим соединениям (липиды, белки и т.п.). 1.3Способность извлекать, преобразовывать и использовать энергию окружающей их среды – либо в форме органических питательных веществ, либо в виде энергии солнечного излучения Обмен веществ слагается из множества отдельных химических реакций, протекающих в живом организме и теснейшим образом связанных друг с другом. Данные экспериментальной биохимии свидетельствуют о взаимосвязи и неразрывности процесса поглощения и усвоения питательных веществ –ассимиляции и процесса их разложения и выделения – диссимиляции. Сопряженность и взаимосвязь отдельных реакций, происходящих при ассимиляции и диссимиляции питательных веществ в организме, проявляется также в сопряженности превращений энергии, происходящих в течение всей жизни организма. 1.4 Способность к точному самовоспроизведению. Цель биохимии состоит в том, чтобы понять, каким образом взаимодействия биомолекул друг с другом порождают описанные выше особенности живого состояния. Биохимию разделяют на: 3.1 Статическую, изучающую химический состав живой материи; 3.2 Динамическую, изучающую процессы обмена веществ в организме; 3.3 Функциональную, изучающую процессы, лежащие в основе определенных проявлений жизнедеятельности. Первая часть обычно именуется органической химией и излагается в специальном курсе, вторая и третья части являются собственно биохимией. Биологическая химия изучает молекулярные процессы, лежащие в основе развития и функционирования организмов. Биохимия использует методы «молекулярных» наук — химии, физической химии, молекулярной физики, и в этом отношении биохимия сама является молекулярной наукой. Однако главные конечные задачи биохимии лежат в области биологии: она изучает закономерности биологической, а не химической формы движения материи. С другой стороны, «молекулярные изобретения» природы, открываемые биохимиками, находят применение в небиологических отраслях знания и в промышленности (молекулярная бионика, биотехнология). В таких случаях биохимия выступает в роли метода, а предметом исследований и разработок являются проблемы, выходящие за пределы биологии. Место биохимии как молекулярного уровня биологических исследований. Уровни исследования являются отражением уровней структурной организации биологических систем, образующих иерархический ряд от наиболее простых систем (молекулы организмов, молекулярный уровень) до предельно сложной земной биологической системы (биосферный уровень). Действительные связи между отраслями биологии гораздо сложнее, чем можно представить с помощью таких простых схем. В частности, каждый более простой уровень организации живых систем (и, соответственно, уровень их исследования) является частью более сложных уровней. Самый первый уровень — молекулярный — уникален в том отношении, что он является составной частью систем всех других уровней биологии. Соответственно этому выделяют такие разделы биохимии, как, например, молекулярная генетика, биохимическая экология. Высший уровень — биосферный — включает в себя все другие уровни. Значение биохимических исследований. Из определения биологической химии вытекает, что это химия живых существ. Живая система от неживой отличается обменом веществ и энергии (метаболизмом). В результате обмена веществ (метаболизма) в биологические внут ренние среды нашего организма поступает боль шое количество продуктов обмена веществ (метаболитов), содержание которых у здорового человека варьирует незначительно и составляет гомеостаз внутренних сред организ ма (кровь, сыворотка, спинномозговая жидкость, моча, пищеварительные соки и др.). Практически любое заболевание начинается с по вреждения (нарушения) одной реакции в метабо лизме клетки, а затем оно распространяется на ткань, орган и целый организм. Нарушение метабо лизма ведет к нарушению гомеостаза в биологичес ких жидкостях организма человека, что сопровож дается изменением биохимических показателей. Большое значение клинико-биохимических методов исследования био логических жидкостей велико в медицине и важно для подготовки медицинских лаборатор ных техников. Достаточно напомнить, что только в крови человека можно определить современными методами биохимических исследований около 1000 показателей метаболизма. Биохимические показа тели биологических сред организма человека широко используются при: 1. постановке диагноза заболевания, особенно дифференциального диагноза; 2. выборе метода лечения; 3.контроле за правильностью назначенного ле чения; 4.результаты биохимических анализов служат одним из критериев излеченности патологическо го процесса; 5.скрининге (выявлении болезни на доклини ческой стадии); 6.мониторинге (контроле за течением заболе вания и результатом лечения); 7. прогнозе (информации о возможном исходе заболевания). Бурный рост биохимии привел к тому, что она подразделилась на разные отрасли: клиническую биохимию, молекулярную биохимию, биохимию спорта и биохимию человека. В процессе освоения дисциплины «Основы биохимии с методами клинико-биохимических исследований» перед нами встают задачи медицинской биохимии, заключающиеся в изучении: 1. строения и функций биомолекул, вхо дящих в состав тканей организма. 2. механизмов: · поступления пластичес ких и биологически активных веществ во внутрен нюю среду организма; · превращения поступив ших мономеров в биополимеры, специфичные для данного организма; · высвобождения, накоп ления и использования энергии в клетке; · образования и выведе ния конечных продуктов распада веществ в орга низме; · воспроизведения и пе редачи наследственных признаков организма; · регуляции всех перечисленных процессов. Основное внимание нашего курса будет уделяться изучению методов клинико-биохимических исследований, которые состоят из этапов. 2 Аминокислоты, входящие в состав белков, их строение и свойства. Биологическая роль аминокислот. Пептиды. Белки - полимерные молекулы, в которых мономерами служат аминокислоты. В белках человека встречают только 20-АК. А. Строение и свойства аминокислот 1. Общие структурные особенности аминокислот, входящих в состав белков Общая структурная особенность АК - наличие амино- и карбоксильной групп, соединённых с одним и тем же углеродным атомом. R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение. В водных растворах при нейтральном значении рН - АК существуют в виде биполярных ионов. В отличие от 19 остальных - АК, пролин - Иминокислота, радикал которой связан как с углеродным атомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру. 19 из 20 АК содержат в α-положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти АК в природе могут находиться в двух разных изомерных формах - L и D. Исключение составляет глицин, который не имеет асимметричного α-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L-изомеры аминокислот. Чистые L- или D-стереоизомеры могут за длительный срок самопроизвольно и неферментатив-но превращаться в эквимолярную смесь L- и D-изомеров. Этот процесс называют рацемизацией. Рацемизация каждой L-аминокислоты при данной температуре идёт с определённой скоростью. Это обстоятельство можно использовать для установления возраста людей и животных. Так, в твёрдой эмали зубов имеется белок дентин, в котором L-аспартат переходит в D-изомер при температуре тела человека со скоростью 0,01% в год. В период формирования зубов в дентине содержится только L-изомер, поэтому по содержанию D-аспартата можно рассчитать возраст обследуемого. Все 20 АК в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к α-углеродному атому. 2. Классификация аминокислот по химическому строению радикалов По химическому строению АК можно разделить на алифатические, ароматические и гетероциклические. В составе алифатических радикалов могут находиться функциональные группы, придающие им специфические свойства: карбоксильная (-СООН), амино (-NH2), тиольная (-SH), амидная (-CO-NH2), гидроксильная (-ОН) и гуанидиновая Названия аминокислот можно построить по заместительной номенклатуре, но обычно используют тривиальные названия. 3. Классификация аминокислот по растворимости их радикалов в воде АК с неполярными R: радикалы, имеющие алифатические углеводородные цепи (радикалы ала, вал, лей, изо, про и мет) и ароматические кольца (радикалы фен и три). АК с полярными незаряженными R: эти радикалы лучше, чем гидрофобные радикалы, растворяются в воде, т.к. в их состав входят полярные функциональные группы, образующие водородные связи с водой. К ним относят сер, тре и тир, имеющие гидроксильные группы, асн и глн, содержащие амидные группы, и цис с его тиольной группой. Цистеин и тирозин содержат соответственно тиольную и гидроксильную группы, способные к диссоциации с образованием Н+, но при рН около 7,0, поддерживаемого в клетках, эти группы практически не диссоциируют. АК с полярными отрицательно заряженными R: относят асн и глн аминокислоты, имеющие в радикале дополнительную карбоксильную группу, при рН около 7,0 диссоциирующую с образованием СОО- и Н+. Следовательно, радикалы данных аминокислот - анионы. Ионизированные формы глутаминовой и аспарагиновой кислот называют соответственно глутаматом и аспартатом. АК с полярными положительно заряженными R: α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Пептидная связь образуется между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой, т.е. является амидной связью. При этом происходит отщепление молекулы воды. 1. Строение пептида. Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют олигопептиды. Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, окгапептид и т.д. Пептиды, содержащие более 10 аминокислот, называют "полипептиды", а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Однако эти названия условны, так как термин "белок" часто употребляют для обозначения полипептида, содержащего менее 50 аминокислотных остатков. Например, гормон глюкагон, состоящий из 29 аминокислот, называют белковым гормоном. Мономеры аминокислот, входящих в состав белков, называют "аминокислотные остатки". Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную α-карбоксильную группу - С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца. Цепь повторяющихся атомов в полипептидной цепи -NH-CH-CO-носит название "пептидный остов". При названии полипептида к сокращённому названию аминокислотных остатков добавляют суффикс -ил, за исключением С-концевой аминокислоты. Например, тетрапептид Сер-Гли-Про-Ала читается как серилглицилпролилаланин. Пептидная связь, образуемая иминогруппой пролина, отличается от других пептидных связей, так как атом азота пептидной группы связан не с водородом, а с радикалом. Пептиды различаются по аминокислотному составу, количеству и порядку соединения аминокислот 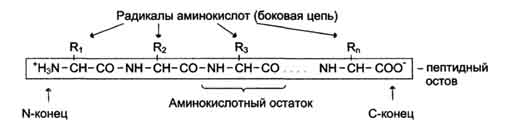 3 Первичная структура белков. Пептидная связь, ее характеристика (прочность, кратность, компланарность, цис- ,транс- изомерия). Значение первичной структуры для нормального функционирования белков (на примере гемоглобина S). Первичная структура — понятие, обозначающее последовательность амино кислотных остатков в белке Пептидная связь — основной вид связи, опреде ляющий первичную структуру Возможно и присутствие дисульфидных связей между двумя остатками цистеина в одной полипептидной цепи с образованием цистина Такая же связь (дисульфидный мостик) может возникать и между остатка ми цистеина, принадлежащими разным полипептидным цепям в белковой молекуле, сополимерном образовании. Аминокислотные остатки в пептидной цепи белков чередуются не случайным образом, а расположены в определённом порядке. Линейную последовательность аминокислотных остатков в полипептидной цепи называют "первичная структура белка". Первичная структура каждого индивидуального белка закодирована в участке ДНК, называемом геном. В процессе синтеза белка информация, находящаяся в гене, сначала переписывается на мРНК, а затем, используя мРНК в качестве матрицы, на рибосоме происходит сборка первичной структуры белка. Каждый из 50 000 индивидуальных белков организма человека имеет уникальную для данного белка первичную структуру. Все молекулы данного индивидуального белка имеют одинаковое чередование аминокислотных остатков в белке, что в первую очередь отличает данный индивидуальный белок от любого другого 2.Характеристика пептидной связи Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу. Связь между α-углеродным атомом и α-аминогруппой или α-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации. Пептидные связи обычно расположены в транс-конфигурации, т.е. α-углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве. Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, существующих в клетках (нейтральная среда, температура тела). В лабораторных условиях гидролиз пептидных связей белков проводят в запаянной ампуле с концентрированной (6 моль/л) соляной кислотой, при температуре более 105 °С, причём полный гидролиз белка до свободных аминокислот проходит примерно за сутки. В живых организмах пептидные связи в белках разрываются с помощью специальных протеолитических ферментов (от англ, protein -белок, lysis -разрушение), называемых также протеазами, или пептидгидролазами. Для обнаружения в растворе белков и пептидов, а также для их количественного определения используют биуретовую реакцию (положительный результат для веществ, содержащих в своём составе не менее двух пептидных связей). Замена аминокислоты на поверхности гемоглобина А В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались 2 β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал. В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают "слипаться", образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа. В оксигемоглобине S комплементарный участок "замаскирован" в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина S друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение рН, условия высокогорья, полёт на самолёте). Так как "серповидные" эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли "даже некроз клеток в данной области. Серповидно-клеточная анемия - гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина. После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям. Гетерозиготные индивидуумы, имеющие один нормальный ген НЬА, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются. Для диагностики наличия HbS в эритроцитах человека используют метод электрофореза, основанного на движении заряженных белков в электрическом поле. Так как в HbS отрицательно заряженные группы глутамата в β-цепях заменены незаряженным валином, HbS в щелочной среде будет двигаться медленнее, чем НЬА. Серповидно-клеточная: анемия - первый описанный пример молекулярной болезни. Почти все встречающиеся замены аминокислот на поверхности молекулы гемоглобина безвредны. Гемоглобин S - редкое исключение. |
