Белки общие свойства. 1. Белки структура и функции
 Скачать 2.19 Mb. Скачать 2.19 Mb.
|
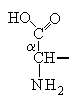
1. Белки. структура и функцииВ иерархии жизненно важных молекул белки (протеины) играют наиважнейшую роль. Они являются продуктом экспрессии генов ДНК и инструментом, при помощи которого геном управляет всеми метаболическими реакциями в клетке и функциями организма. Биологические функции белков 1. Каталитические белки (ферменты или энзимы) – в настоящее время выделено и идентифицировано более 2000 ферментов, катализирующих протекание разнообразных реакций в клетках и тканях. 2. Транспортные белки: – гемоглобин в составе эритроцитов переносит кислород от легких к тканям и углекислый газ из тканей в легкие; – альбумины плазмы крови – жирные кислоты, билирубин, многие биологически активные вещества, лекарственные вещества, ксенобиотики, анионы и катионы; – липопротеины крови переносят липиды (триацилглицеролы, фосфолипиды, холестерин) – гликопротеины крови в составе глобулиновой фракции транспортируют гемоглобин (гаптоглобин), железо (трансферрин), медь (церулоплазмин), витамин В12 (транскортин), антитела (иммуноглобулины) и др.; – мембранные транспортные белки (транслоказы или пермеазы) связывают специфические вещества и переносят их через бислой мембраны по градиенту концентрации без затрат энергии АТФ. 3. Защитные белки: – антитела (иммуноглобулины, синтезирующиеся в костном мозге) – предохраняют организм от чужеродных веществ с высокой молекулярной массой, они способны распознавать бактерии, вирусы и чужеродные белки, связываться с ними и подвергать их обезвреживанию; – комплемент крови – вызывают лизис (растворение) клеточных стенок бактерий; – фибриноген и тромбин – свертывающая система крови предохраняет организм от потери крови; – белки острой фазы – интерфероны (группа белков) регулируют реакцию клетки на вирусную инфекцию, они угнетают синтез всех белков в клетке «хозяина» и активируют фермент РНК-азу, в результате действия которого гидролизуются (расщепляются) все матричные и рибосомные РНК вириона (к белкам острой фазы относятся также лизоцим, С-реактивный белок, α1-кислый гликопротеин и др.). 4. Регуляторные белки – обеспечивают регуляцию клеточной и физиологической активности организма: – гормоны белковой, пептидной и аминокислотной природы – это гормоны гипоталамуса, гипотеза, поджелудочной железы (инсулин и глюкагон), щитовидной (кальцитонин, тироксин) и паращитовидной (паратирин) желез, надпочечников (адреналин) и др.; – белковые факторы регуляции биосинтеза ДНК, РНК и белков. 5. Сократительные белки: – актин и миозин – функционируют в составе сократительной системы мышечной ткани (актомиозин). 6. Структурные белки: – гидрофобные интегральные белки мембран клеток – способствуют стабилизации клеточных мембран (они не обладают функциональной активностью); – коллаген, эластин, ретикулин – белки соединительной ткани и эластиновых волокон кожи, сухожилий, костей, дентина, стекловидного тела и хрусталика глаза, эндотелиальных и эпителиальных клеток кровеносных сосудов и кожи, гладких мышц сосудов и матки и др.; – кератин волос и ногтей. 7. Рецепторные белки: – рецепторные белки на поверхности клеток или органелл клеток обеспечивают избирательное связывание различных регуляторов, например, гормонов, нейромедиаторов и др. веществ. 8. Генно-регуляторные белки: – ядерные белки гистоны компактезируют ДНК и при участии других белков обеспечивают активацию репликации (синтез ДНК) и транскрипции (синтез РНК). 9. Резервные и питательные белки: – конститутивные белки клеток могут использоваться как резервные на энергетические и пластические цели в экстремальных условиях или при голодании; – проламины и глютелины – резервные белки зерновых культур и глобулины – бобовых; – казеин и овальбумин – главные питательные белки молока и яиц. 1.1. Строение белковБелки являются высокомолекулярными, биологически активными азотсодержащие органическими соединениями, структурные компоненты которых представлены α-L-аминокислотами (α-амк). Таким образом, белки можно рассматривать как полимеры α-L-аминокислот. Структура аминокислотО 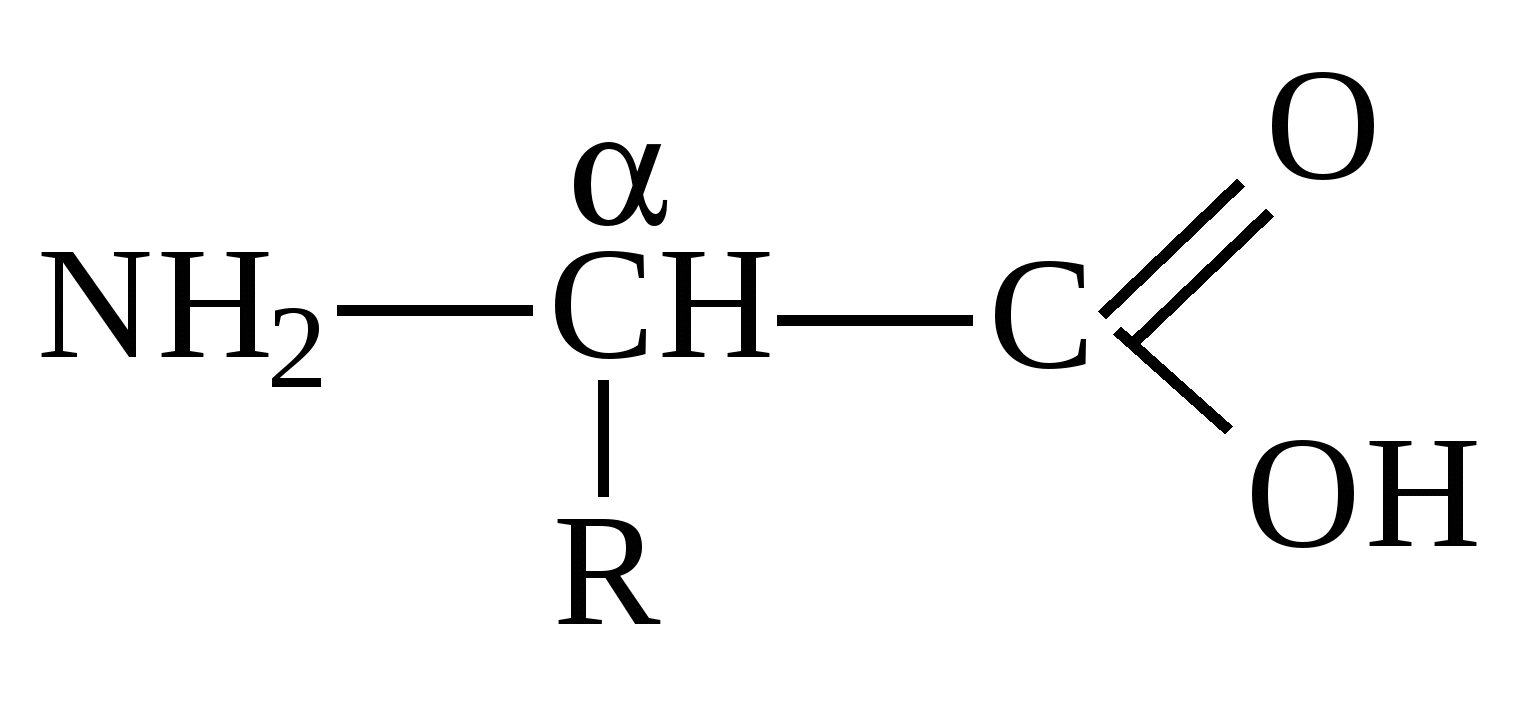 бщий вид формулы α-аминокислоты: α-Углеродный атом связан с радикалом (R) аминокислоты, а также с α-амино- и α-карбоксильной группами. В природе существует около 300 аминокислот, как свободных, так и полученных путем гидролиза белков и пептидов. В организме человека найдено 70 аминокислот, однако для синтеза новых белков в клетке животных, растений и микроорганизмов используются только 20 из них. Они получили название «протеиногенные аминокислоты». Структуры радикалов этих аминокислот представлены в табл. 1. Таблица 1 Структура радикалов протеиногенных аминокислот
Окончание таблицы 1
Остальные аминокислоты называют модифицированными, поскольку они образуются ферментативным путем из протеиногенных аминокислот после синтеза белка на рибосомах (например, оксипролин, оксилизин и др.) П 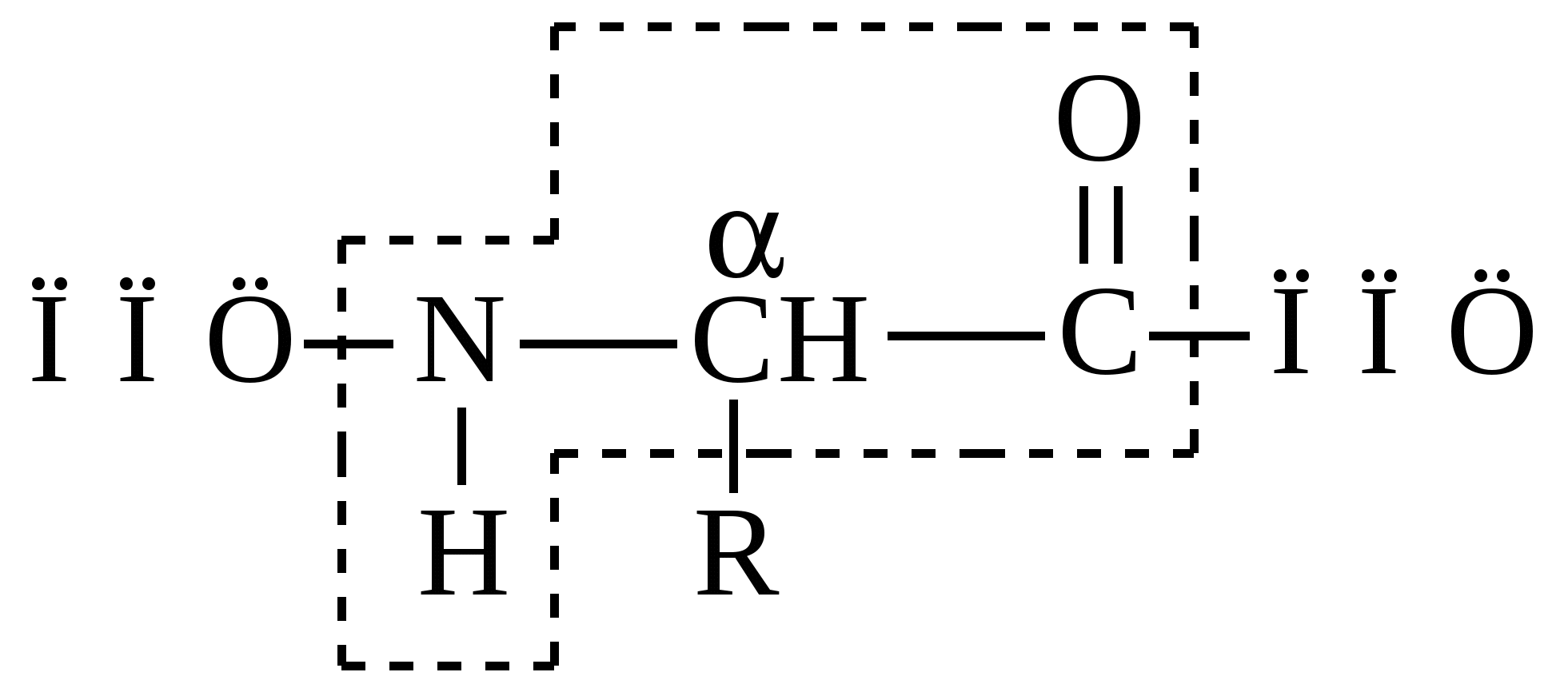 оследовательность аминокислот в цепи изображают начиная с N-концевой аминокислоты. С нее же начинается нумерация аминокислотных остатков. В полипептидной цепи (ппц) многократно повторяется группа: Э 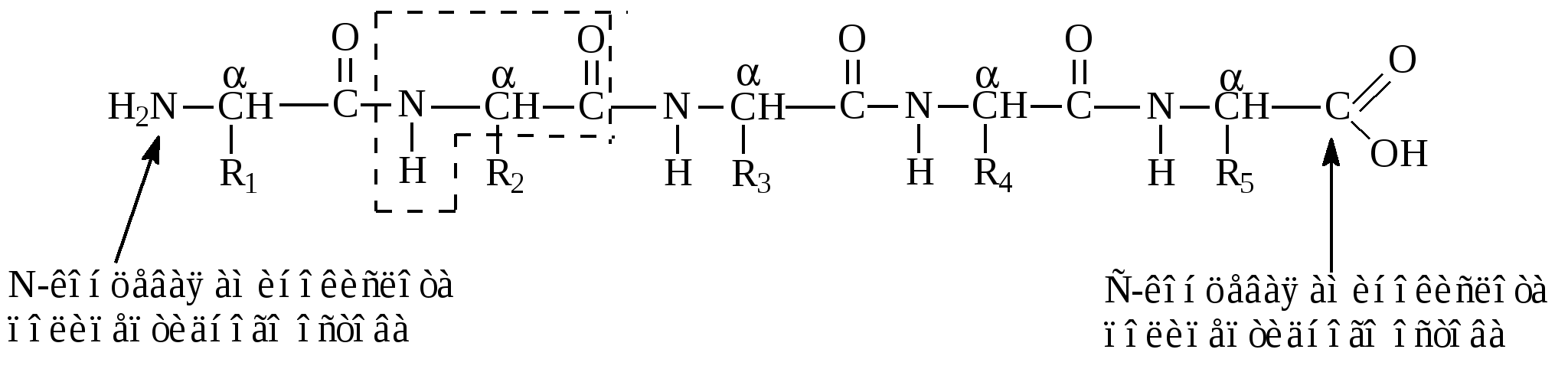 та группа формирует пептидный остов. Следовательно, полипептидная цепь состоит из остова (скелета), имеющего регулярную, повторяющуюся структуру, и отдельных боковых цепей радикалов аминокислот (R-групп): Среди протеиногенных аминокислот есть такие, которые в организме человека и животных не синтезируются поступают только с пищей. Таких аминокислот десять и их называют «незаменимыми»:
Аргинин и гистидин – это полузаменимые аминокислоты, так как могут синтезироваться в организме в ограниченном количестве. Абсолютная незаменимость остальных восьми аминокислот, универсальна для всех видов организмов животного происхождения. Остальные десять аминокислот – «заменимые» – могут синтезироваться в клетке из углеводов и глицерина или других аминокислот и метаболитов. Пептидная связь в молекуле белкаУ 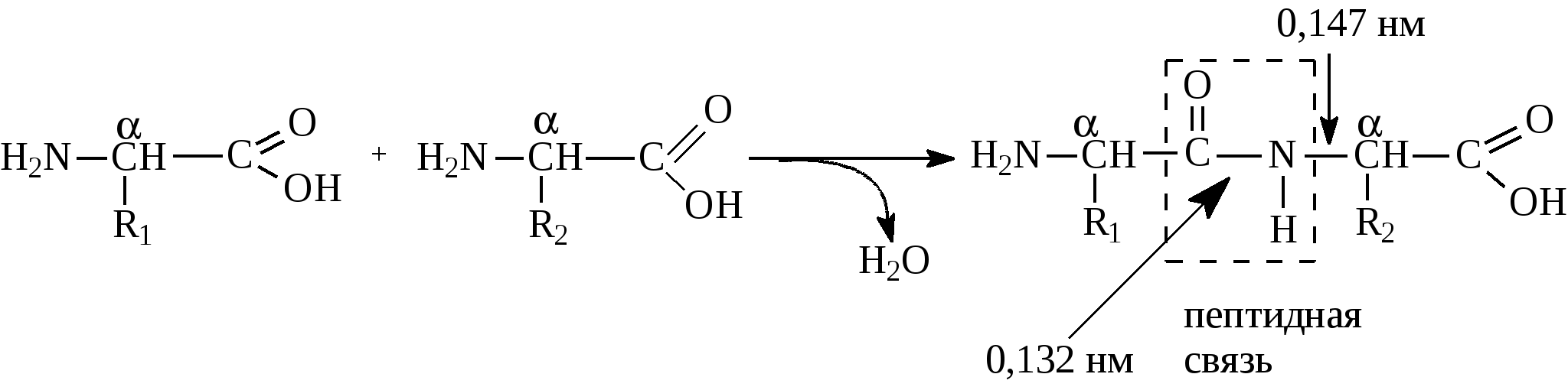 ниверсальным типом связи в белковой молекуле является пептидная связь. Образование пептидной связи можно представить как отщепление воды от α-карбоксильной группы первой аминокислоты и α-амино группы второй: Однако, расстояние между атомами «С» и «N» пептидной связи может изменяться от 0,132 нм до 0,127 нм, что характерно для непредельной связи: Р 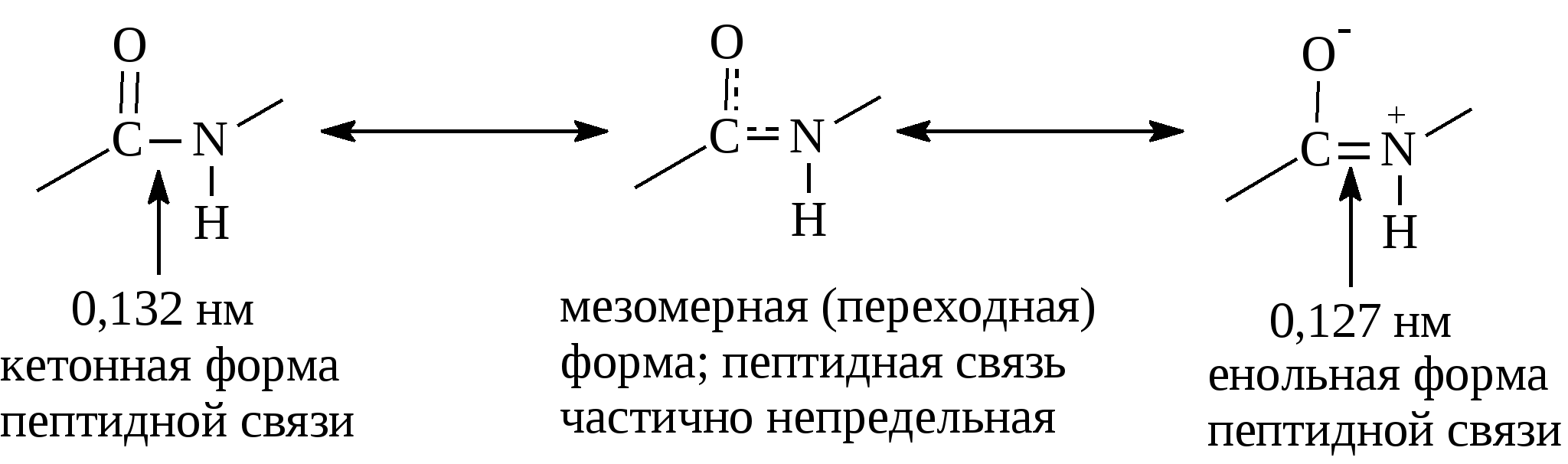 езонансная стабилизация пептидной связи придает ей характер частично двойной связи и этим можно объяснить жесткость связи между атомами углерода и азота пептидной связи. Свободное вращение атомов кислорода и водорода вокруг пептидной связи невозможно и все четыре атома пептидной группы лежат в одной плоскости (копланарны). Кроме того, атомы кислорода и водорода пептидной группы занимают транс-положение. Вокруг остальных связей полипептидного остова возможно свободное вращение. Такая полужесткость строения полипептидной цепи имеет важное значение для формирования более высокого уровня структурной организации белковой молекулы (вторичной, третичной и четвертичной структур). Номенклатура полипептидной цепи белковой молекулы: а 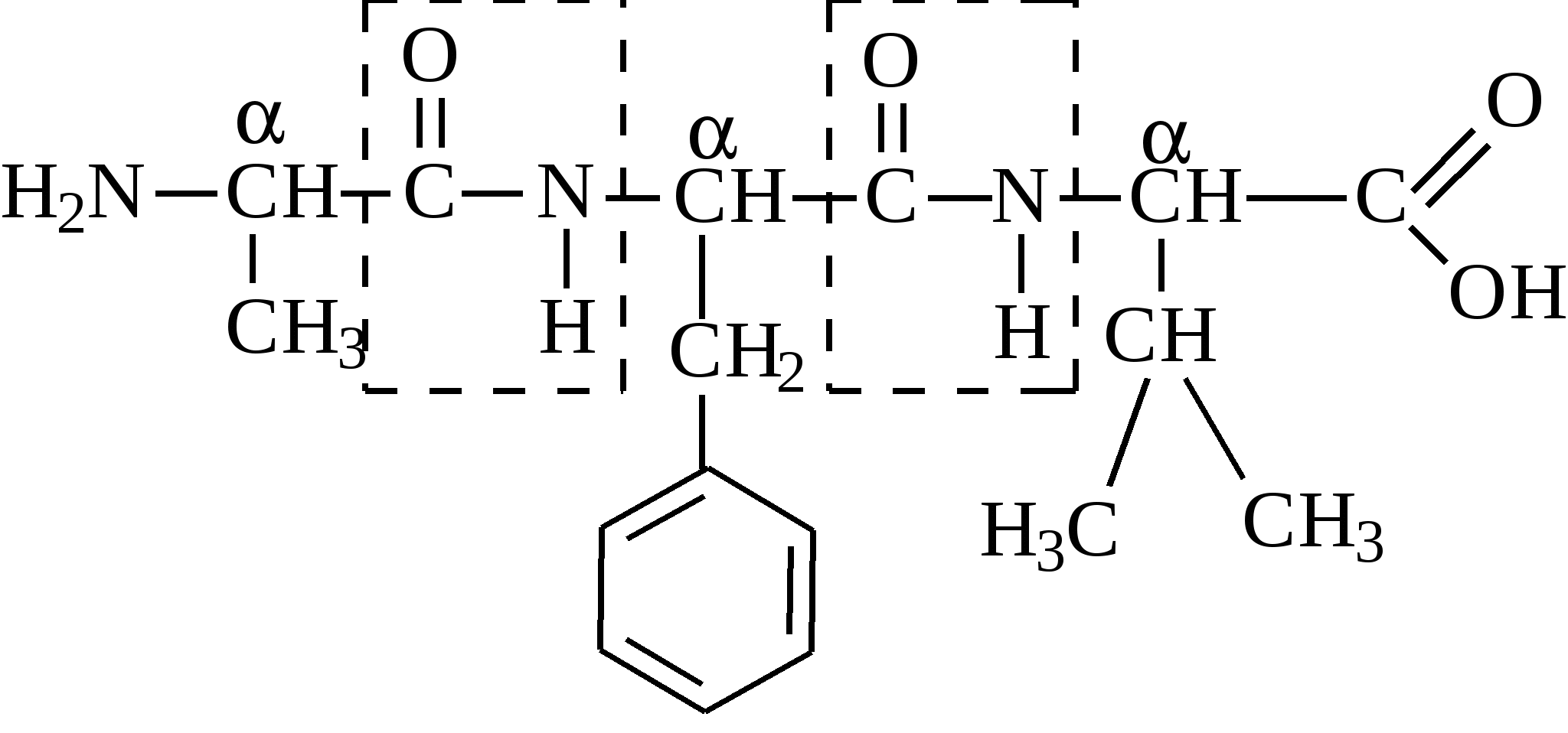 ланилфенилаланилвалин Трипептид включает три аминокислотных остатка. В зависимости от количества аминокислотных остатков в полипептидной цепи различают: – несложные пептиды (ди-, три-, тетра- и пентапептиды); – олигопептиды (включают 11-30 аминокислотных остатков); – полипептиды (включают от 30 до 50 аминокислотных остатков) – белки – это полипептиды с молекулярной массой от 5000 до 1 млн Дальтон, содержащие более 50 аминокислотных остатков, длина их полипептидной цепи может достигать сотен и тысяч остатков аминокислот (Дальтон, D, Да – единица массы, равная массе атома водорода (1,0000) по шкале атомных масс). Универсальной пробой на обнаружение белков в растворе служит биуретовая реакция: в щелочной среде ионы меди образуют комплексное соединение с атомами пептидных групп, окрашенное в сине-фиолетовый или розово-фиолетовый цвет. Эта реакция лежит в основе количественного определения белков в биологических жидкостях (в молоке, крови) и тканях растительного и животного происхождения, так как интенсивность окрашивания прямо пропорциональна количеству белка (количеству пептидных связей). Биологически активные пептидыГормоны гипоталамуса (вазопрессин, окситоцин, тиролиберин, соматостатин и др.) их называют нейропептиды. Г 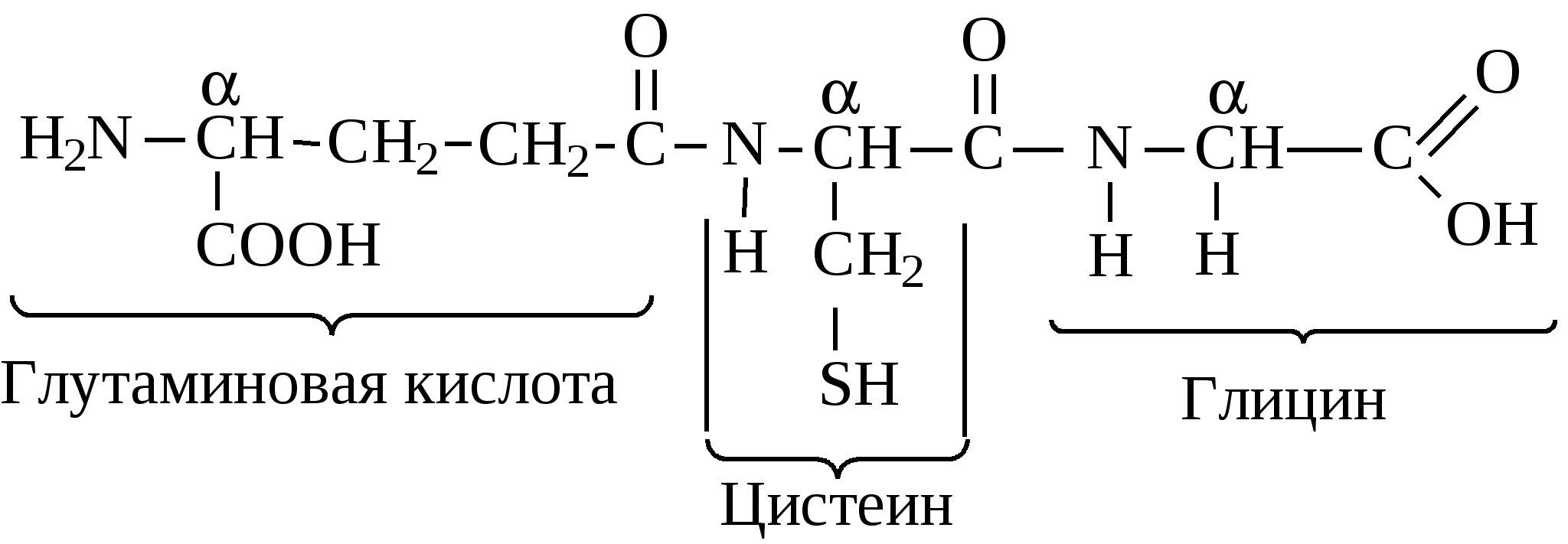 лутатион – это трипептид, входит в состав простетической группы ферментов класса оксидоредуктаз (Гл-SH), например, глутатионпероксидаза и глицеральдегидфосфатдегидрогеназа (фермент гликолиза): Это восстановленный глутатион. SH-Группа является каталитическим участком активного центра фермента, так как может окисляться и восстанавливаться: –2Н  Гл-SH + HS-Гл Гл-S-S-Гл Гл-SH + HS-Гл Гл-S-S-Глвосстановленная +2Н окисленная форма (имеет дисульфид- форма ную связь и называется цистин) Глутатион также принимает участие в транспорте аминокислот через мембрану клеток (особенно мозга), обезвреживает соединения ртути, ароматические углеводороды, перекисные соединения. Особенно много глутатиона содержится в дрожжах и зародыше пшеницы. Карнозин и ансерин – дипептиды, обнаружены в мышцах животных и человека. Они являются составной частью экстрактивных веществ мяса (бульонов): Содержание их в мясе достигает 0,2–0,3% от сырой массы продукта. Биологическая роль карнозина: он увеличивает амплитуду мышечного сокращения, предварительно сниженную утомлением, увеличивает эффективность работы ионных насосов мышечной клетки. 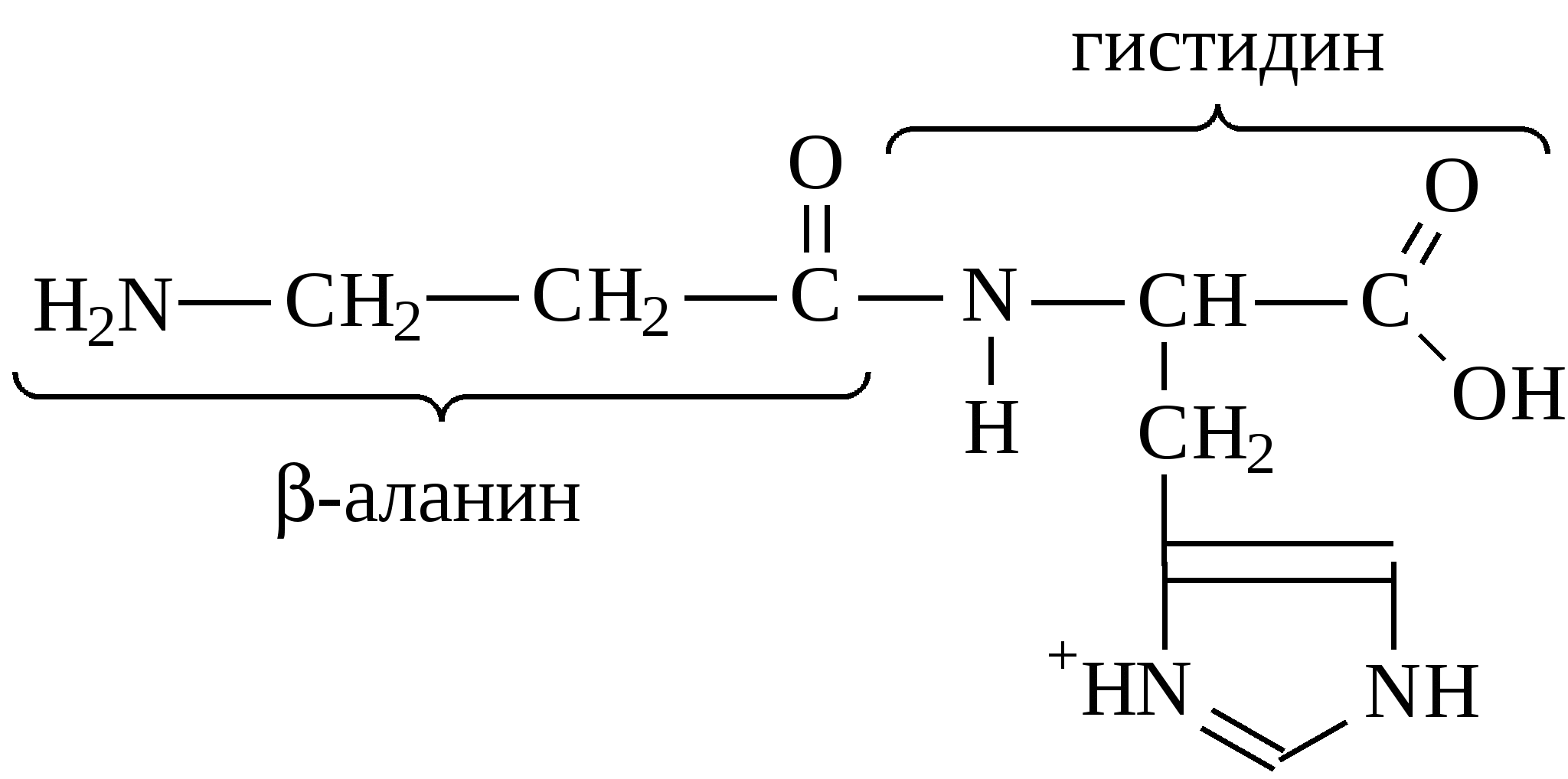 Ансерин также выполняет буферные функции за счет входящего в его состав имидазольного кольца гистидина: В 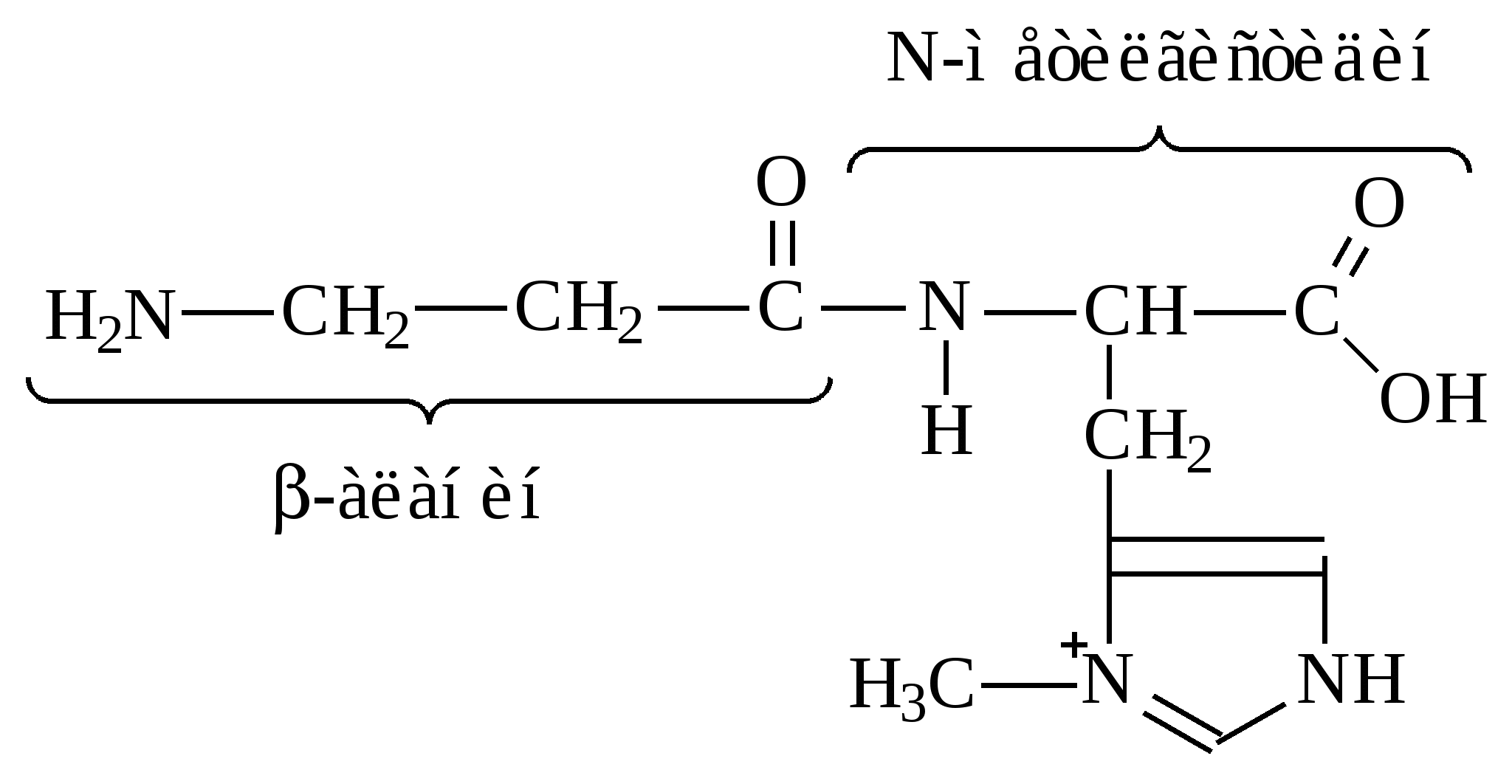 азоактивные пептиды: брадикинин, коллидин и ангиотензин. Они оказывают влияние на тонус сосудов (вазус – сосуд). Например, ангиотензин (асп-арг-вал-тир-иле-гис-про-фен) обладает сосудосуживающим действием и, следовательно, влияет на артериальное давление. Пептидные токсины. Они вырабатываются (синтезируются) микроорганизмами, ядовитыми грибами, пчелами, змеями, морскими моллюсками, скорпионами и рядом растений. Изучено 5 энтеротоксинов, продуцируемых бактериями Staphylococcus aureus и 7 нейротоксинов, вырабатываемых Clostridium botulinum. Токсины могут стать причиной пищевого отравления при употреблении молочных, мясных, рыбных, жидких яичных продуктов, а также салатов и кремовых начинок мучных кондитерских изделий. К наиболее сильнодействующим ядам относятся ботулинические токсины (эти токсины инактивируются при 80 0С и в кислой среде). Они могут вызывать смертельные пищевые отравления. Энтеротоксины могут вырабатываться также бактериями Salmonella и Clostridium perfringens. Вызывают расстройства работы кишечника, обморочные состояния и лихорадки. Чаще они содержаться в говядине, птице, рыбе, сыре, реже в фасоли. Они влияют на водно-солевой (электролитный) обмен и транспорт глюкозы в клетке, что приводит к обезвоживанию и гибели клеток кишечника. Гриб бледной поганки содержит 10 циклических пептидов (Мм≈1000) из них особо ядовит токсин α-аманитин. Яд пчел содержит апамин (18 аминокислот). Оказывает сильное влияние на центральную нервную систему. Яд морских моллюсков – конотоксин (13 аминокислот). Пептиды-антибиотики: Грамицидин S – это циклический антибиотик, синтезируемый бактериями Bacillus Brevis; Сурфактин – синтезируется бактериями Bacillus subtitles. Оба антибиотика применяют при борьбе с инфекционными заболеваниями, вызываемыми стрептококками и пневмококками. Антибиотики из группы пенициллина – вырабатываются плесневыми грибами Penicillium. По структуре это дипептид, состоит из D-валина и цистеина. Группа пенициллиновых антибиотиков эффективна при борьбе с инфекциями вызываемыми стафилококками и другими микроорганизмами. Вкусовые пептиды – сладкие и горькие пептиды. Аспартам – подсластитель, представляет собой метиловый эфир L-α-аспартил-L-фенилаланин:  Слаще сахарозы в 180 раз. Противопоказан больным фенилкетонурией. Пептиды горького вкуса – образуются при распаде белков (αs-казеина, β-казеина) в сырах и молоке. Содержат от 2 до 8 аминокислотных остатков. | |||||||||||||||||||||||||||||||||||

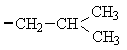
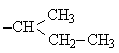
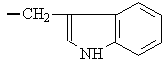
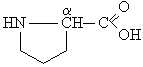
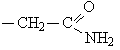
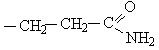
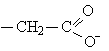
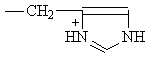
 циклические аминокислоты
циклические аминокислоты