Белки общие свойства. 1. Белки структура и функции
 Скачать 2.19 Mb. Скачать 2.19 Mb.
|
1.3. Физико-химические свойства белковФизико-химические свойства белков определяются их аминокислотным составом и пространственной структурой (организацией). Белки обладают следующими основными свойствами: – кислотно-основными; – буферными; – осмотическими; – оптическими; – растворимостью; – осаждаемостью; – денатурацией. Механизм растворения белков (гидратация)Белки – это гидрофильные вещества. Сначала сухой белок набухает, а затем переходит в раствор. При набухании молекулы воды проникают внутрь белка и связываются с полярными группами радикалов аминокислот. Плотная упаковка полипептидных цепей разрыхляется. Затем белки растворяются, т.е. молекулы белка отрываются от общей массы и переходят в раствор. Однако, не все молекулы белка, набухая, переходят в раствор. Например, коллаген только набухает (так ведут себя многие фибриллярные белки). Растворение белков связано с их гидратацией, т.е. образованием гидратной оболочки. Молекулы воды электростатически связываются с ионогенными и неионогенными полярными группами радикалов аминокислот (с их полными положительными и отрицательными зарядами, а также с частично положительными и частично отрицательными зарядами) (рис. 8). 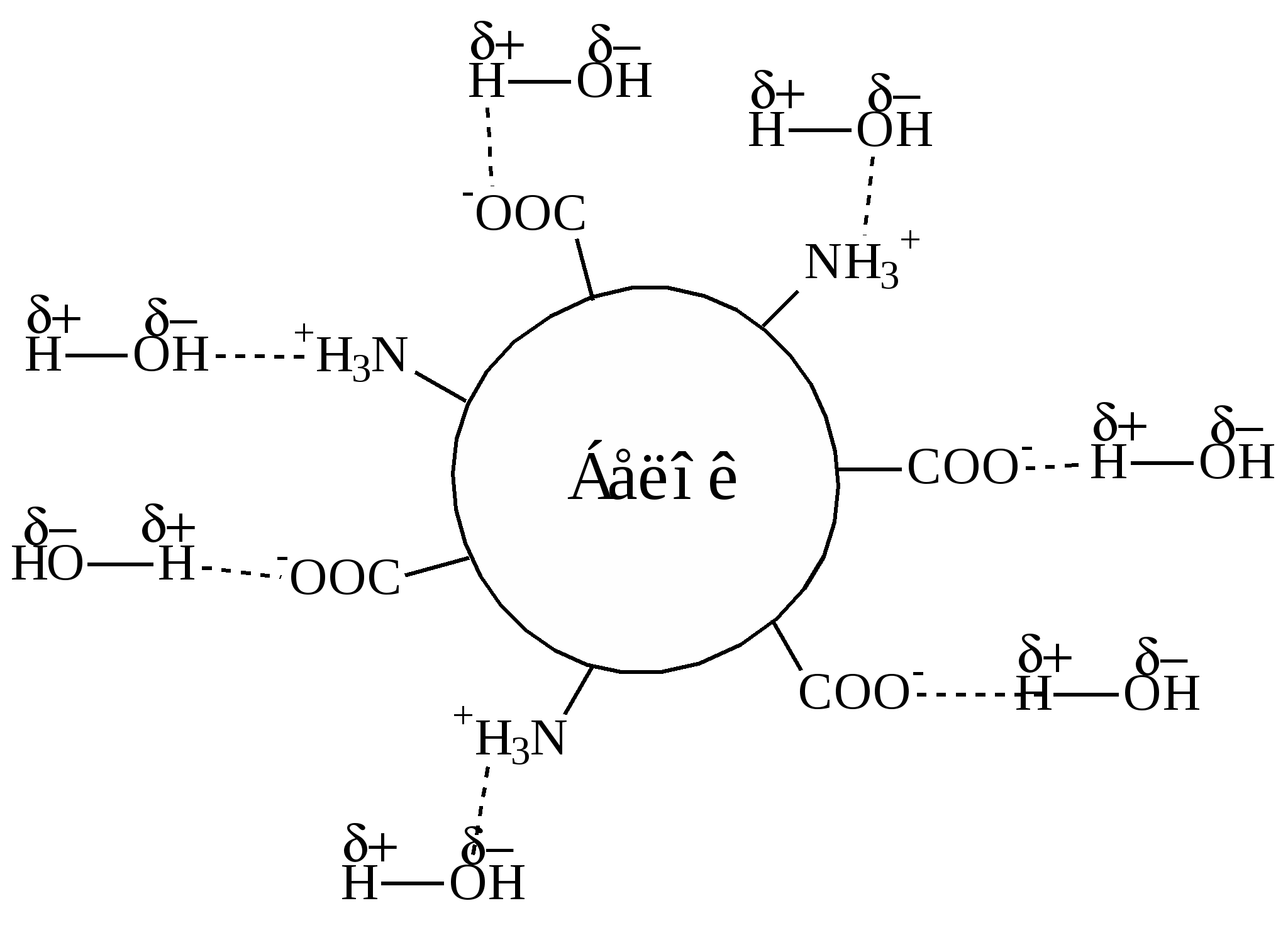 Рис. 8. Схема формирования гидратной оболочки Однако часть гидратной воды связывается с атомами пептидных групп водородными связями. Подобным образом преимущественно связывает воду коллаген, так как этот белок содержит много гидрофобных аминокислот. Количество воды, связанной с белком достигает 30–50 г на 100 г белка. Гидрофильных полярных групп значительно больше на поверхности белковой глобулы, чем в центре. На стабилизацию (устойчивость) белка в растворе влияют два фактора: – заряд белковой молекулы; – наличие гидратной оболочки. Оба фактора препятствуют коагуляции (конгломерации или склеиванию) белков и выпадению их в осадок. Между этими двумя факторами существует тесная взаимосвязь: чем больше полярных групп в белке, тем больше связывается воды и тем лучше растворимость белка. Например, такие глобулярные белки сыворотки крови и молока как альбумины хорошо растворимы даже в воде, а глобулины только в слабо-солевых растворах. Большинство фибриллярных белков плохо растворяются в воде и физиологических растворах или совсем не растворяются. Растительные белки – проламины – растворяются в 60–80%-ном спирте, а глютелины – в щелочах (0,1–0,2% раствор гидроксида натрия). Факторы, влияющие на растворимость белков:
Кислотно-основные свойства белков (электрические)Белки являются амфотерными полиэлектролитами. Амфотерность белкам придают кислотные и основные группы боковых радикалов аминокислот и концевые аминогруппа (NH3+) и карбоксильная группа (COO–) полипептидного остова, поскольку другие α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей. Факторы, влияющие на величину и знак заряда белковой молекулы 1. Влияние аминокислотного состава белковой молекулы на ее заряд (при условии нейтральной среды, рН=7): – если в белковой молекуле преобладают кислые аминокислоты (аспарагиновая и глутаминовая кислоты), то суммарный заряд белковой молекулы будет отрицательным (в нейтральной среде); – если в белковой молекуле преобладают основные аминокислоты (лизин, аргинин, гистидин), то суммарный заряд белковой молекулы будет положительным (в нейтральной среде). Слабая диссоциация SH-групп цистеина и фенольной (С6Н5–ОН) группы тирозина (это слабые кислоты) почти не влияет на амфотерность белков. Чем больше в белке кислых аминокислот, тем больше величина отрицательного заряда (большинство природных белков кислого характера). Чем больше в белке основных аминокислот, тем больше величина положительного заряда. Например, молекула альбумина (анионогенный белок) содержит в полипептидной цепи много дикарбоновых аминокислот и, следовательно, имеет отрицательный заряд. В крови, которая имеет рН 7,4, отрицательный заряд альбумина равен 18. Другой пример – гистоны, входящие в состав хроматина ядра клетки, содержат много аргинина и лизина, следовательно, гистоны – это катионогенные белки. 2. Влияние рН среды на заряд белковой молекулы Суммарный заряд белковой молекулы зависит от рН среды (в кислой среде заряд положительный, а в щелочной – отрицательный). – если среда щелочная, рН>7 Высокая концентрация гидроксильных ионов (ОН–) подавляет ионизацию слабой аминогруппы и белки приобретают отрицательный заряд: 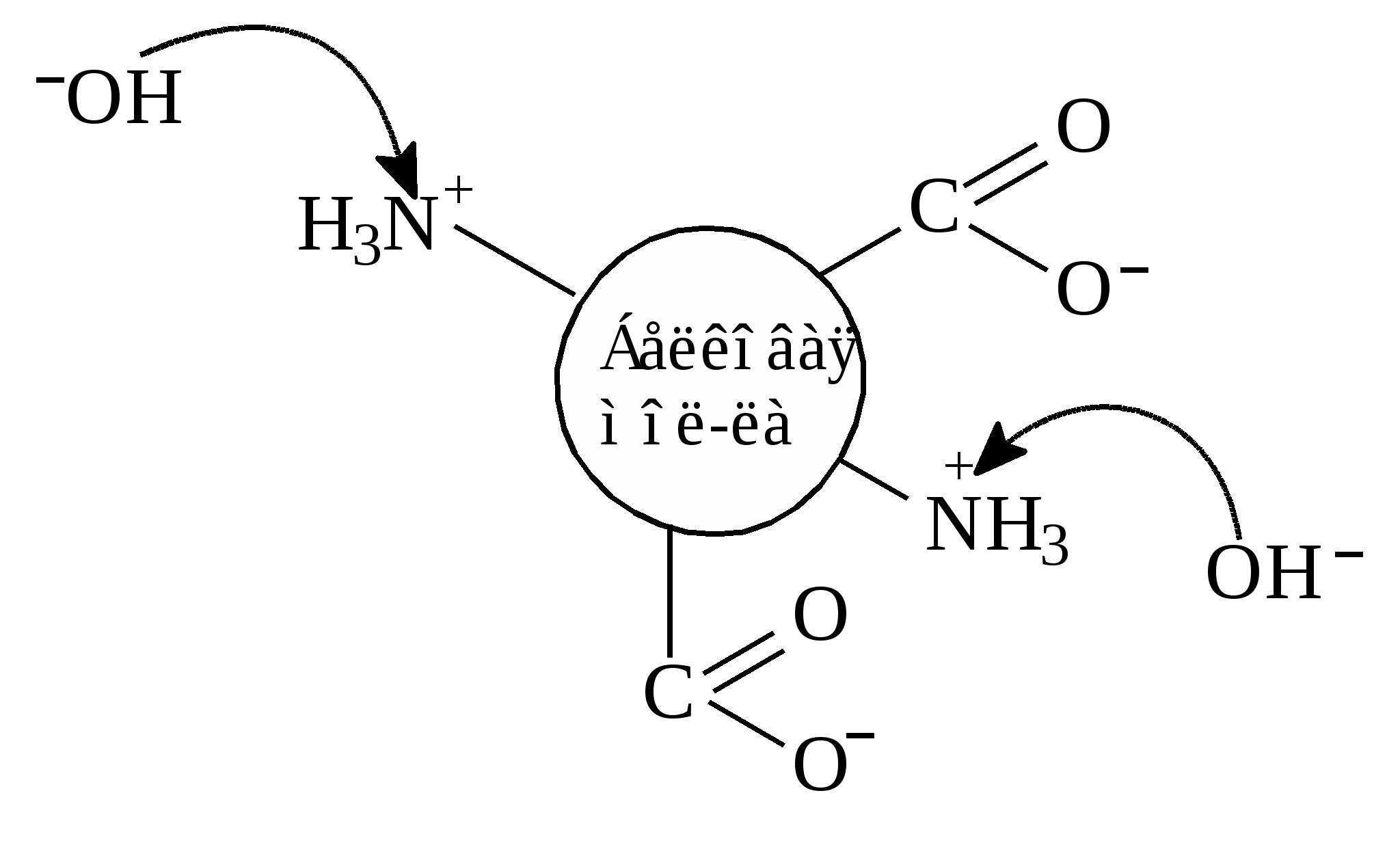 В поле постоянного электрического тока (при электрофорезе) белки в щелочной среде перемещаются к аноду; – если среда кислая, рН<7 Высокая концентрация водородных ионов подавляет диссоциацию слабой карбоксильной группы аминокислот, и белки приобретают положительный заряд: 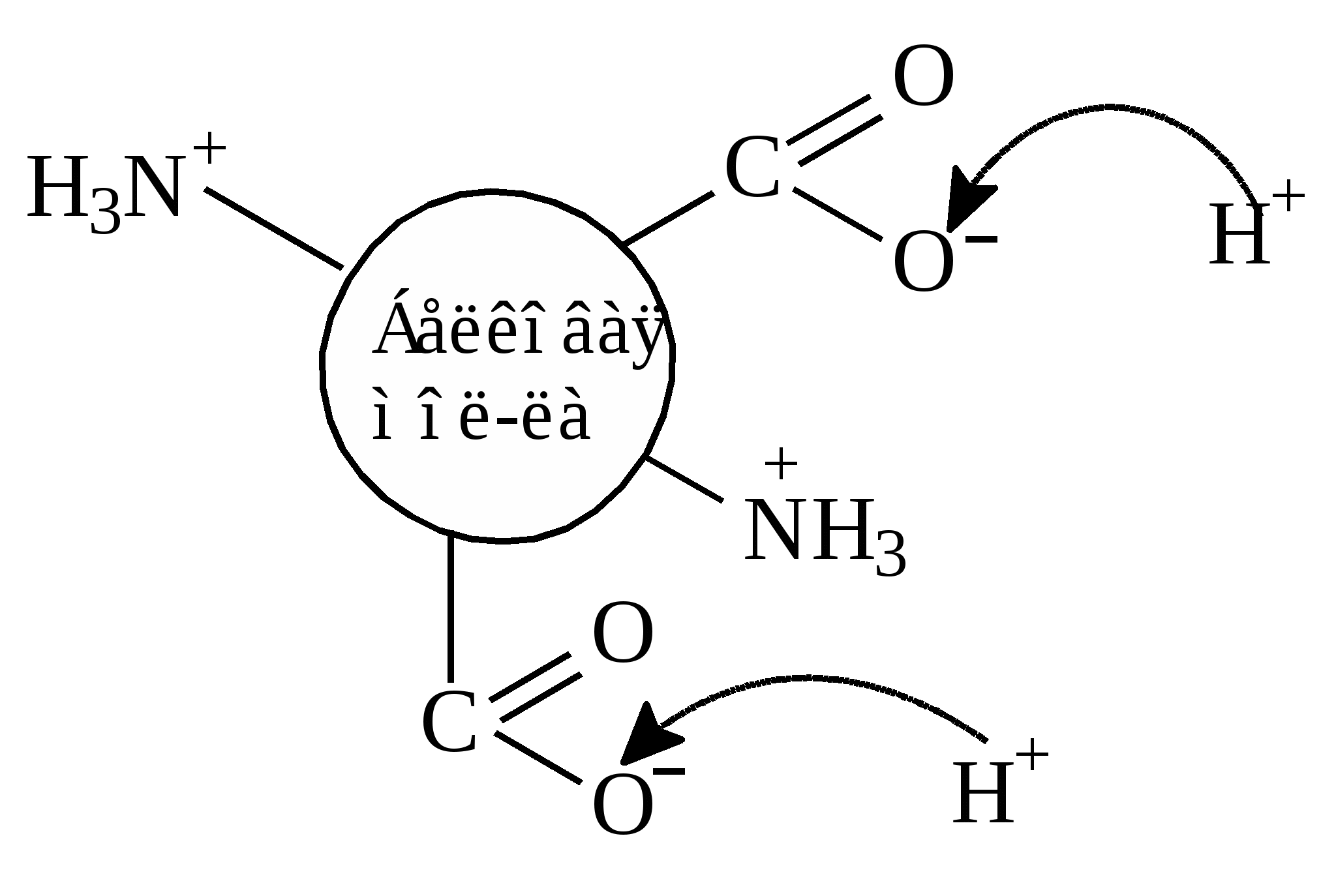 В поле постоянного электрического тока (при электрофорезе) в кислой среде белки перемещаются к катоду. То значение рН, при котором белок приобретает суммарный нулевой заряд, называется изоэлектрической точкой (рI) данного белка. Для белков основного характера рI лежит в щелочной среде, а для кислых белков – в кислой. В изоэлектрической точке белки теряют заряд, частично гидратную оболочку и устойчивость в растворе, молекулы белка коагулируют и осаждаются. На способности белков осаждаться в изоэлектрической точке основан метод выделения белков из смеси с другими белками. Например, при рН 4,7 из сыворотки крови можно осадить альбумины (т.к. для альбуминов рI=4,7), а глобулиновую фракцию при рН 6,0–7,3. Для гистонов рI 9,5–12,0. На способности белков приобретать заряд основан метод электрофоретического разделения белков на фракции. Так при электрофорезе белков сыворотки крови на хроматографической бумаге можно получить пять фракций, а в полиакриламидном геле (ПААГ) – до 17 фракций. ЭлектрофорезЭто электрофоретическое разделение белков сыворотки крови на фракции на хроматографической бумаге. Метод основан на способности белков приобретать заряд в растворе и перемещаться в поле постоянного электрического тока. Поскольку каждая фракция белков имеет свой аминокислотный состав, то при определенном значении рН (например, рН 8,6) все белки данной фракции будут иметь один знак заряда (–), но отличаться величиной заряда. Соответственно все они будут перемещаться в поле постоянного электрического тока в одну сторону, но с различной скоростью. Таким образом, на скорость передвижения белков в поле постоянного электрического тока влияют следующие факторы:
Электрофорез проводят в электрофоретических камерах, заполненных буфером, рН которого равен 8,6. Все белковые фракции сыворотки крови приобретают «отрицательный» заряд и следовательно будут перемещаться в поле постоянного электрического тока от катода (К–) к аноду (А+). Для того, чтобы белковые фракции «прошли путь и разделились» из смеси белков на фракции линия старта должна находиться ближе к катоду (рис. 9) 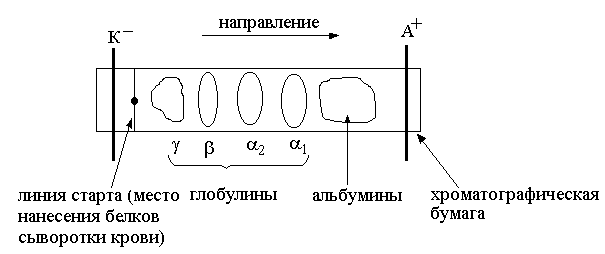 линия старта глобулины альбумины хроматографическая (место нанесения бумага белков сыворотки крови) Рис. 9. Электрофореграмма белков сыворотки крови на хроматографической бумаге Через 6–10 часов электрофорез останавливают, белки на полоске хроматографической бумаги фиксируют соляной кислотой (белки денатурируют) и окрашивают бромфеноловым синим красителем. На электрофореграмме проявляются окрашенные пятна фракций белков. Самая электроподвижная фракция – это низкомолекулярные белки (альбумины), которые обладают высокой величиной отрицательного заряда. Коллоидные и осмотические свойства белковВодные растворы белков являются устойчивыми и равновесными, они со временем не коагулируют и не требуют присутствия стабилизаторов. Поскольку белковые растворы гомогенны, то напоминают истинные растворы, однако высокая молекулярная масса белков придает их растворам свойства коллоидных систем: 1. Оптические свойства белковРастворы белков способны рассеивать лучи видимого света (эффект дифракции или явление Тиндаля). Луч света, проходя через раствор белка, преломляется и свет рассеивается. На данном физико-химическом свойстве белков основан метод количественного определения белка рефрактометрически (в чистых белковых растворах, например, в сыворотке крови). 2. Малая скорость диффузии – способствует равномерному распределению белков внутри клетки, между клеткой и кровью, а также препятствует скоплению белка в местах его биосинтеза. 3. Осмотические свойства белков Белки в клетке, межклеточной жидкости, в крови повышают осмотическое давление и вызывают явление осмоса, т.е. перемещение ионов Nа+ и воды через мембраны в раствор белка. Неспособность белков проникать через полупроницаемые мембраны вследствие высокой молекулярной массы используется в практике для очистки белков от низкомолекулярных примесей (солей, биогенных аминов, мочевины и др.) – процесс диализа. 4. Высокая вязкость белковых растворов С увеличением концентрации белка вязкость раствора повышается, поскольку повышаются силы сцепления между поверхностями белковых молекул. При повышении температуры вязкость белковых растворов понижается. Добавление некоторых солей кальция приводит к повышению вязкости, поскольку ионы Са2+ способствуют сцеплению молекул с помощью кальциевых мостиков. Иногда вязкость белкового раствора в присутствии Са2+ настолько увеличивается, что он теряет текучесть и превращается в гель. 5. Способность белков к образованию гелей Молекулы белка в растворе могут образовывать структурные сетки, внутри которых содержаться молекулы воды. Гелеобразующие свойства белков характеризуются способностью их коллоидного раствора из свободного диспергированного состояния переходить в связнодисперсное (с образованием систем, обладающих свойствами твердых тел). Упругие свойства геля зависят от концентрации белка, от рН, присутствия других белков, солей, ионов двухвалентных металлов (Са2+), полисахаридов. Физико-химические свойства гелей: прочность, твердость, эластичность, тиксотропия (способность обратимо переходить в текучее состояние и нетекучий гель), температура размягчения и плавления, степень набухания, способность к синерезису (отделение дисперсионной среды с сокращением объема геля). К подобного рода «универсальным» гелеобразователям относится желатин. Желатин – белковый продукт, представляет собой смесь линейных полипептидов с молекулярной массой 50–70 тыс. и их агрегатов, не имеющих запаха и вкуса. Аминокислотный состав желатина: глицин – 26–31%, пролин – 15–18%, гидроксипролин – 15%, глутаминовая кислота – 11–12%, аспарагиновая кислота – 6–7%, аланин – 8–11%, аргинин – 8–9%. Желатин получают из коллагена, содержащегося в костях, хрящах и сухожилиях животных. В коллагене 35% карбоксильных групп находится в амидированной форме (СОNH2). При получении желатина в процессе кислотной или щелочной экстракции нерастворимый коллаген превращается в растворимый желатин. В результате такой обработки амидные группы превращаются в карбоксильные (–СООН). Поэтому pI для амидированной формы желатина приблизительно 9,4, а рI для карбоксильной формы – 4,8 (эти границы варьируют). Гелеобразование легче протекает в растворах фибриллярных белков и в связи с этим пищевые студни готовят из костей, хрящей, мяса, где много фибриллярных белков. Коллагеновые белки костей, хрящей, кожи и других обладают высокой прочностью, упругостью и эластичностью, так как находятся в гелеобразном состоянии. Цитоплазма клетки тоже может переходить в гель. Осаждаемость белковМеханизм и характер осаждения может быть различным. Высаливание белков Осаждение белков растворами нейтральных солей высокой концентрации (насыщенные растворы). Сильным высаливающим эффектом обладают сульфаты натрия (Na2SO4) и аммония ((NH4)2SO4). Механизм высаливания связан с тем, что добавляемые катионы и анионы снимают гидратную оболочку и одновременно, возможно, нейтрализуют заряд белка (состояние близкое к изоэлектрической точке). При таком осаждении сохраняются нативные свойства белков (биологическая активность) и сохраняются все уровни структурной организации белковой молекулы. Если затем к осадку белка добавить воду, удалить диализом соль, то белок снова перейдет в раствор и будет проявлять биологическую активность. Высаливание используют для разделения белков сыворотки крови, молока, яичного белка на две фракции: альбумины и глобулины. Глобулины, как менее растворимые белки и с большей молекулярной массой осаждаются первыми, при 50%-ном насыщении раствора белка (NH4)2SO4 или Na2SO4, а альбумины при 100%-ном. Осаждение белков органическими водоотнимающими средствами Этанол, метанол, ацетон, снимают гидратную оболочку белковых молекул и белки осаждаются. Если после осаждения белков спирт быстро удалить, а к белку добавить воду или физиологический раствор, то белок вновь растворяется. Длительное воздействие данных реагентов на белок может вызвать их денатурацию. Осаждение белков в изоэлектрической точке Рассмотрено в разделе «Кислотно-основные свойства белков» и лабораторной работе «Физико-химические свойства белков». Денатурация белков При воздействии различных факторов на белок, сравнительно слабые связи (водородные, ионные, гидрофобные), ответственные за стабилизацию конформации белка (вторичную, третичную и четвертичную), разрушаются. Это приводит к потере биологической активности и физико-химических свойств белка (растворимость, оптические свойства, электрическая подвижность). Без изменения остается первичная структура. При денатурации белковая молекула увеличивается в размерах («набухает»), плотная упаковка нативного белка разрыхляется. Внутри белковой глобулы разрушаются гидрофобные связи (белковая молекула при этом как бы «выворачивается»). Белковая молекула теряет гидрофильные свойства и, следовательно, гидратную оболочку и приобретает гидрофобные (т.к. на поверхности глобулы появляются гидрофобные группы). Белковые молекулы коагулируют («склеиваются») и выпадают в осадок. Денатурирующие факторы: физические и химические. 1. Физические факторы – высокая температура, трение, давление, встряхивание, ультразвук, ионизирующие лучи, ультрафиолетовое облучение (УФО). 2. Химические факторы – концентрированные неорганические кислоты, крепкие щелочи, органические кислоты (уксусная кислота, трихлоруксусная, сульфосалициловая и др.), детергенты (моющие средства), некоторые амиды кислот (например, мочевина), алкалоиды, соли тяжелых металлов (ртути, меди, кадмия, цинка, бария, свинца) и другие (см. лабораторную работу «Физико-химические свойства белков»). Наиболее устойчивыми к действию денатурирующих агентов являются фибриллярные белки, а также гликопротеины и протеогликаны (углеводный компонент стабилизирует белковую молекулу). Ренатурация белков В некоторых случаях денатурация обратима. Так, например, кратковременное воздействие спирта или ацетона вызывает в верхнем слое белковой молекулы перераспределение ионных и водородных связей и частичную денатурацию. После быстрого удаления спирта, ацетона происходит самопроизвольное восстановление этих связей в водной фазе. Денатурирующее воздействие мочевины на белок можно также снять путем ее удаления (диализом или гемодиализом – искусственная почка). Мочевина образует водородные связи с атомами пептидных групп, т.е. встраивается во вторичную структуру: 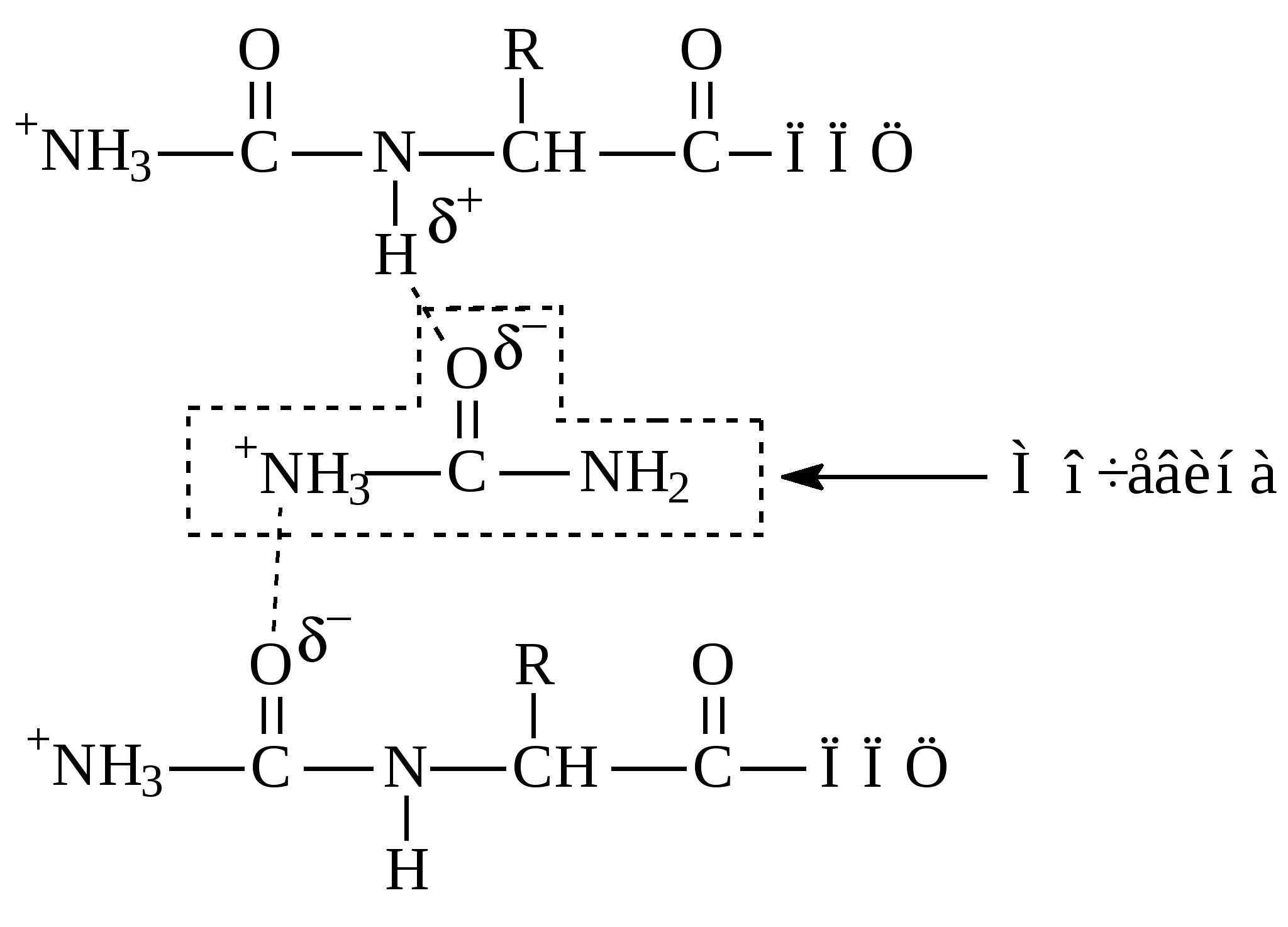 При нарушении функции почек в крови повышается концентрация мочевины, она поступает в клетки (ткани) и вызывает токсическое действие. Несбалансированное с углеводами белковое питание сопровождается накоплением мочевины в крови и тканях, поскольку аминокислоты, вставшие на путь окисления (энергетический обмен), дезаминируются с отщеплением аммиака. |
