|
|
Белки общие свойства. 1. Белки структура и функции
Белковая молекула имеет четыре типа структурной организации – первичная, вторичная, третичная и четвертичная.
Первичная структура
Линейная структура, представляющая собой строго определенную генетически обусловленную последовательность аминокислотных остатков в полипептидной цепи. Основной вид связи – пептидная (механизм образования и характеристика пептидной связи рассмотрены выше).
Полипептидная цепь обладает значительной гибкостью и в результате внутри цепочечных взаимодействий приобретает определенную пространственную структуру (конформацию).
В белках различают два уровня конформации пептидных цепей – вторичную и третичную структуры.
Вторичная структура белка
Это укладка полипептидной цепи в упорядоченную структуру благодаря образованию водородных связей между атомами пептидных групп одной полипептидной цепи или смежных цепей.
При формировании вторичной структуры водородные связи образуются между атомами кислорода и водорода пептидных групп:
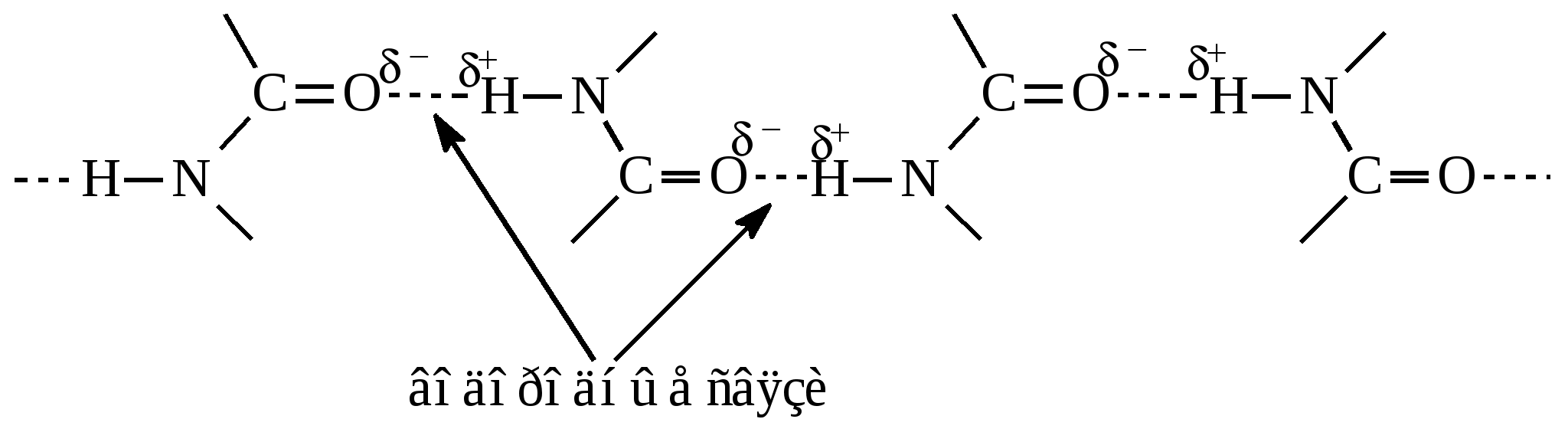
По конфигурации вторичная структура делится на два типа:
спиральные (α-спираль)
слоистоскладчатые (β-структура и кросс- β-форма).
α-Спираль имеет вид регулярной спирали. Формируется благодаря межпептидным водородным связям в пределах одной полипетидной цепи (рис. 1).
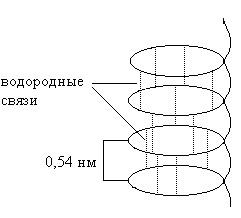
Рис. 1. Схема формирования α-спирали
Основные характеристики α-спирали:
– водородные связи образуются между пептидными группами каждого первого и четвертого аминокислотного остатка;
– витки спирали регулярны, на один виток приходится 3,6 аминокислотных остатков;
– боковые радикалы аминокислот не участвуют в образовании α-спирали;
– в образовании водородной связи участвуют все пептидные группы, что обуславливает максимальную стабильность α-спирали;
– поскольку все атомы кислорода и водорода пептидных групп вовлечены в образование водородных связей, то это приводит к снижению гидрофильности α-спиральных областей;
– α-спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипетидной цепи, отвечающей минимуму свободной энергии;
– препятствуют образованию α-спирали пролин и оксипролин – в местах их расположения регулярность α-спирали нарушается и полипептидная цепь легко изгибается (ломается), так как не удерживается второй водородной связью (рис.2).
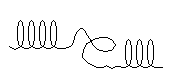
Рис. 2. Нарушения регулярности α-спирали
Атом азота α-иминогруппы пролина при образовании пептидной связи остается без атома водорода, следовательно не может участвовать в образовании водородной связи. Много пролина и оксипролина в полипептидной цепи коллагена (см. классификацию простых белков – коллаген).
Высокая частота α-спирали характерна для миоглобина и глобина (белок, входящий в состав гемоглобина). В среднем глобулярные (округлые или эллипсовидные) белки имеют степень спирализации 60–70%. Спирализованные участки чередуются с хаотическими клубками. В результате денатурации белка переходы спираль → клубок увеличиваются. На спирализацию (формирование α-спирали) влияют радикалы аминокислот, входящие в состав полипептидной цепи, например, отрицательно заряженные группы радикалов глутаминовых кислот, расположенные вблизи друг от друга, они отталкиваются и препятствуют образованию α-спирали (образуется клубок). По той же причине препятствуют образованию α-спирали близко расположенные аргинин и лизин, имеющие положительно заряженные функциональные группы в радикалах (см. пример протамины и гистоны).
Препятствуют формированию α-спирали также большие размеры радикалов аминокислот (например, радикалы серина, треонина, лейцина).
Таким образом, содержание α-спиралей в белках неодинаково.
β-Структура (слоисто-складчатая) – имеет слабо изогнутую конфигурацию полипептидной цепи и формируется с помощью межпептидных водородных связей в пределах отдельных участков одной полипептидной цепи или смежных полипептидных цепей. Различают две разновидности β-структуры:
– кросс-β-форма (короткая β-структура) – представляет собой ограниченные слоистые участки, образованные одной полипептидной цепью белка (рис. 3).
Рис. 3. Кросс-β-форма белковой молекулы
Большинство глобулярных белков включают короткие β-структуры (слоистые участки). Их состав может быть представлен следующим образом: (αα), (αβ), (βα), (αβα), (βαβ).
– полная β-структура. Этот тип характерен для всей полипептидной цепи, которая имеет вытянутую форму и удерживается межпептидными водородными связями между смежными параллельными или антипараллельными полипептидными цепями (рис. 4).
Рис. 4. Полная β-структура
В антипараллельных структурах связи более стабильны, чем в параллельных.
Белки с регулярной β-структурой более прочные, плохо или совсем не перевариваются в желудочно-кишечном тракте.
Формирование вторичной структуры (α-спирали или β-структуры) обусловлено последовательностью аминокислотных остатков в полипептидной цепи (т.е. первичной структурой белка) и, следовательно, генетически предопределено. Благоприятствуют образованию β-структуры такие аминокислоты как метионин, валин, изолейцин и аспарагиновая кислота.
Белки с полной β-структурой имеют фибриллярную (нитевидную) форму. Полная β-структура встречается в белках опорных тканей (сухожилий, кожи, костей, хрящей и др.), в кератине (белок волос и шерсти) (характеристику отдельных белков см. в разделе «Белки пищевого сырья»).
Однако не все фибриллярные белки имеют только β-структуру. Например, α-кератин и парамиозин (белок запирательной мышцы моллюска), тропомиозин (белок скелетных мышц) – относятся к фибриллярным белкам а вторичная структура у них – α-спираль.
Третичная структура белка
Это пространственная укладка α-спирали или полипептидной цепи в трехмерную структуру (конформацию). По форме третичной структуры белки делят на глобулярные (округлые) и фибриллярные (нитевидные).
Связи, стабилизирующие третичную структуру образуются между боковыми радикалами аминокислот и их функциональными группами. Связи могут быть сильными (ковалентными) и слабыми (полярными и ван-дер-ваальсовыми).
Гидрофобные (ван-дер-ваальсовы), ионные и водородные связи слабые, но так как они многократно повторяются в белке, то играют важную роль в формировании третичной структуры.
При укладке третичной структуры α-спираль или полипептидная цепь белка стремится принять энергетически (термодинамически) выгодную форму, характеризующуюся минимумом свободной энергии. В связи с этим гидрофобные радикалы аминокислот, избегая воды формируют ван-дер-ваальсовы связи внутри белковой молекулы, а гидрофильные группы аминокислот располагаются ближе к наружной поверхности и связывают воду. В центре белковой глобулы практически нет воды, а на ее поверхности формируется гидратная оболочка.
При укладке третичной структуры α-спираль приобретает определенную форму в трехмерном пространстве (рис. 5).
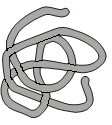
Рис. 5. Схема пространственной
структуры глобулярного белка
Типы связей, участвующие в формировании третичной структуры белка (рис. 6).
Слабые связи:
– гидрофобная связь (ван-дер-ваальсова) – образуется между гидрофобными (неполярными) радикалами аминокислот;
– водородные связи – образуются между полярными незаряженными радикалами аминокислот;
– ионные или электростатические связи – образуются между полярными заряженными радикалами аминокислот.
Сильные связи (ковалентные):
– дисульфидная связь – образуется между двумя молекулами цистеина
– псевдопептидная (ложнопептидная) связь – образуется между карбоксильной группой радикала одной аминокислоты и аминогруппой радикала другой аминокислоты;
– сложно-эфирная связь – образуется между гидроксильной группой серина или треонина и карбоксильной группой радикалов глутаминовой и аспарагиновой кислот.
В последнее десятилетие ученые открыли, что в клетке имеются специализированные белки и белки-ферменты, которые регулируют процесс сворачивания новосинтезированных полипептидных цепей в правильную нативную третичную структуру. К ним относятся:
– фермент пептдил-пролил-цис/транс-изомераза – приводит к образованию цис-конформации пептидной связи, образованной атомом азота пролина, что вызывает поворот полипептидной цепи на 180о (на данном участке полипептидной цепи регулярность α-спирали нарушена);
– фермент протеиндисульфидизомераза – катализирует расщепление неправильно образованных дисульфидных связей и формирует новые S-S-связи, характерные для нативного белка.
– шапероны и шаперонины – это каталитически неактивные белки (открыл Л.Эллис) – «семейство белков», помогают правильной нековалентной сборке трехмерной белковой конформации и препятствуют формированию функционально неактивных белковых структур. Синтез шаперонов резко усиливается при стрессовом температурном воздействии, поэтому их называют «белки теплового шока». Шапероны удерживают новосинтезированную полипептидную цепь на рибосомах в развернутом состоянии, а шаперонины обеспечивают условия для образования единственно правильной третичной структуры белка.
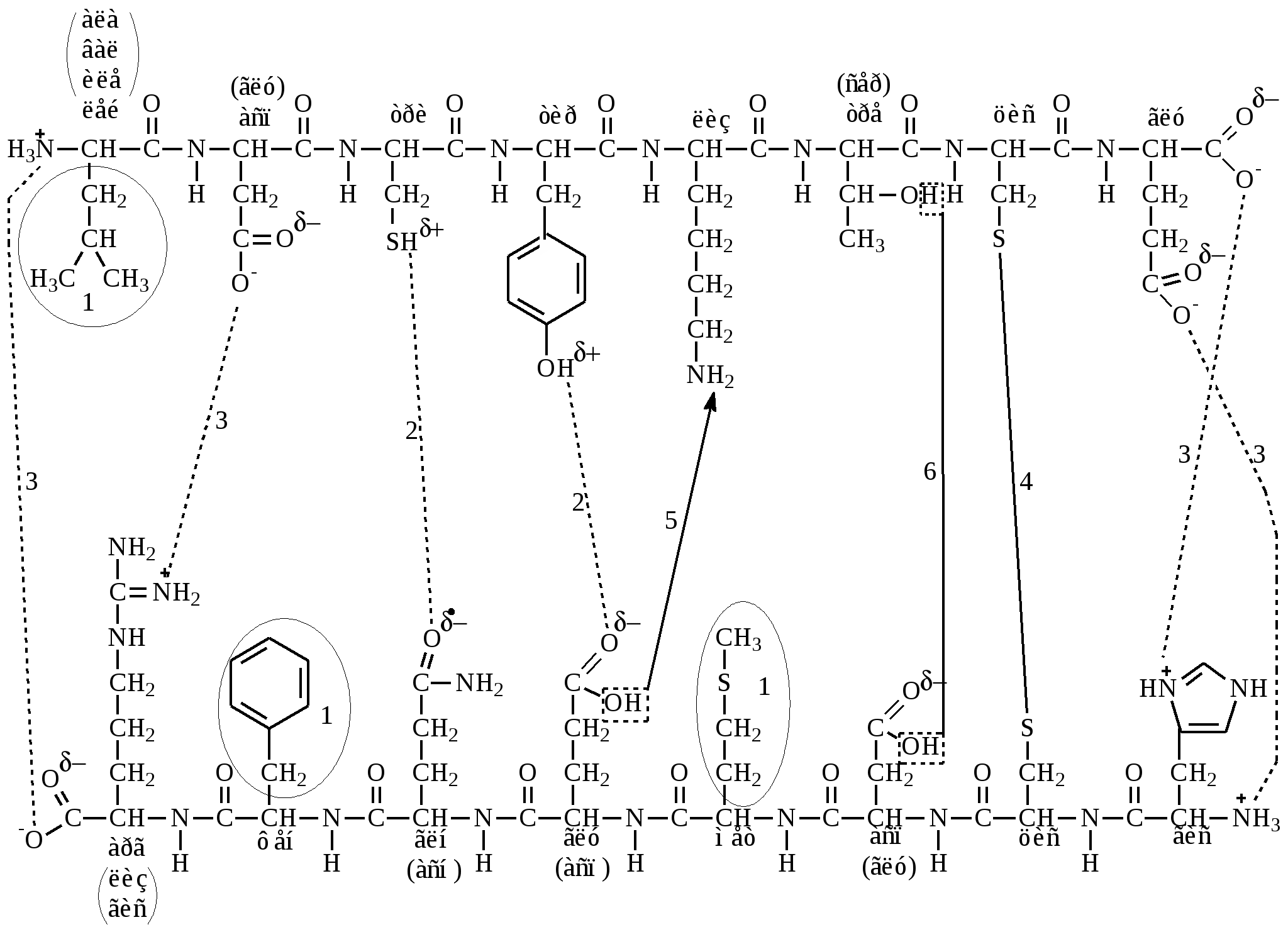
Рис. 6. Связи, участвующие в формировании третичной структуры белка
Четвертичная структура белка
Некоторые белки построены из нескольких полипептидных цепей, каждая из которых имеет вторичную и третичную структуры. Для таких белков введено понятие четвертичной структуры. Белок с четвертичной структурой называют олигомером, а его полипептидные цепи с третичной структурой – протомеры или субъединицы. Самостоятельной биологической активностью протомеры не обладают. Чаще встречаются димеры, тетрамеры и в пределах десяти, но может быть и больше (рис. 7).

Рис. 7. Четвертичная структура гемоглобина
Молекула состоит из четырех протомеров
(двух α-субъединиц и двух β-субъединиц глобина)
Стабилизация четвертичной структуры белка
Контакты между поверхностями субъединиц осуществляются посредством полярных групп радикалов аминокислот (водородные и ионные связи, иногда образуются и дисульфидные связи) или гидрофобных. Контактные поверхности взаимодействующих субъединиц комплементарны друг другу. Некоторые белки состоят из двух и более пептидных цепей, но они не являются полноправными глобулами и их нельзя отнести к группе олигомерных белков. Например, гормон инсулин состоит из двух полипептидных цепей, связанных между собой дисульфидными связями. Но он не относится к белкам с четвертичной структурой, так как его полипетидные цепи образовались путем частичного протеолиза единой полипептидной цепи.
Большинство белков-ферментов имеют четвертичную структуру. Это аспарагиновая аминотрансфераза (АСТ), синтаза жирной кислоты, лактатдегидрогеназа (ЛДГ), фруктозодифосфатаза, митохондриальная АТФ-аза, глутаминсинтетаза, ацетилSКоA-карбоксилаза и др.
Белки с молекулярной массой более 50 тысяч почти всегда являются олигомерными.
|
|
|
 Скачать 2.19 Mb.
Скачать 2.19 Mb.