1. Теоретическая часть 1 Физикохимические характеристики этилацетата
 Скачать 5.52 Mb. Скачать 5.52 Mb.
|
|
">http://allbest.ru СОДЕРЖАНИЕ Введение 1. Теоретическая часть 1.1 Физико-химические характеристики этилацетата 1.2 Применение этилацетата 1.2.1 Лабораторное применение 1.3 Требования безопасности 2. Технологическая часть 2.1 Синтез этилацетата в лаборатории 2.2 Производство этилацетата в промышленности 2.3 Получение этилацетата по реакции Тищенко Заключение Список использованных источников ВВЕДЕНИЕ Этилацетат находит широкое применение в различных областях промышленности, в основном, в качестве растворителя и экстрагента. Существующие промышленные методы получения этилацетата основаны на этерификации уксусной кислоты этиловым спиртом. В связи с тем, что этиловый спирт является продуктом синтеза, замена его на этилен в этом процессе несомненно может иметь практический интерес. Из-за специфических свойств его применяют в целом множестве областей индустрии, также растет потребность в многотоннажном производстве этилацетата. Промышленное получение этилацетата включает несколько методов: методом «реакции Тищенко», методом этерификации кислоты уксусной спиртом этиловым, при наличии ускорителя реакции, в роли которого могут выступать кислота серная, паратолуолсульфокислота или смолы (ионообменные), методом окисления (жидкофазного) н-бутана кислородом (воздухом) при получении уксусной кислоты (как побочный продукт получается этилацетат), методом алкилирования кислоты уксусной этиленом. Как растворитель, являясь активным растворителем нитро- и этилцеллюлозы, широко используется в производстве лакокрасочных материалов и чернил для печатающих машин. Также он входит в композиции растворителей нитроглифталевих, перхлорвиниловых и эпоксидних эмалей, разных смазочных масел, восков, полиэфирных лаков, красок, кремниорганических лаков и эмалей. В данной курсовой работе будут рассмотрены три основных метода получения ацетальдегида, а именно: синтез в лабораторных условиях, синтез в промышленности и производство по реакции Тищенко. Цель курсовой работы: ознакомиться с методом синтеза этилацетата по реакции Тищенко, провести расчёт материального и теплового баланса и изучить принципиальные схемы аппаратов данного производства. 1. Теоретическая часть 1.1 Физико-химические характеристики этилацетата Этилацетат CH3C(O)OC2H5, этиловый эфир уксусной кислоты - бесцветная, прозрачная, горючая жидкость с приятным запахом. Смешивается в любых соотношениях с бензолом, толуолом, хлороформом, диэтиловым эфиром, этанолом и рядом других органических растворителей. Ограниченно растворим в воде (до 12% по массе). В этилацетате, в свою очередь, растворяется до 9.7 массовых процентов воды. Этилацетат образует азеотропные смеси с водой (Tкип=70.4°C, 8.2% воды по массе), этиловым спиртом (71.8°C и 30.8%), метанолом (62.25°C и 44.0%), изопропиловым спиртом (75.3°C и 21.0%), циклогексаном (72.8°C и 54.0%), четыреххлористым углеродом (74.7°C и 57.0%) Этилацетат является умеренно полярным растворителем. Хорошо растворяет эфиры целлюлозы, смоляные масляные лаки, жиры, воски. Его химические свойства типичны для сложных эфиров. Легко гидролизуется до этанола и уксусной кислоты в щелочной среде. В кислой среде может быть переэтерифицирован. Таблица 1.1 Физико-химические характеристики этилацетата ГОСТ 8981-78.
Обладает сравнительно низкой токсичностью. Его пары раздражают слизистые оболочки глаз и дыхательных путей, при воздействии на кожу возможно развитие экземы и дерматита [2]. Этиловый спирт (этанол) С2Н5ОН — бесцветней жидкость, легко испаряющаяся (температура кипения 64,7 ºС, температура плавления -97,8 ºС, оптическая плотность 0,7930) . Спирт, содержащий 4—5 % воды, называют ректификатом, а содержащий только доли процента воды — абсолютным спиртом. Альдегид (муравьиный) – газ с весьма резким запахом. Другие низшие альдегиды – жидкости, хорошо растворимые в воде. Альдегиды обладают удушливым запахом, который при многократном разведении становится приятным, напоминая запах плодов. Альдегиды кипят при более низкой температуре, чем спирты с тем же числом углеродных атомов. В то же время температура кипения альдегидов выше, чем у соответствующих по молекулярной массе углеводородов, что связано с высокой полярностью альдегидов. Альдегиды характеризуются высокой реакционной способностью. Большая часть их реакций обусловлена наличием карбонильной группы. Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации. Физические свойства некоторых альдегидов представлены в таблице 1.2. Таблица 1.2 Физические свойства некоторых альдегидов
1.2 Применение этилацетата Этилацетат широко используется как растворитель, из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель нитратов целлюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом — растворитель в производстве искусственной кожи. Годовое мировое производство в 1986 году составляло 450—500 тысяч тонн. ацетальдегид этилацетат этерификация Как растворитель, являясь активным растворителем нитро- и этилцеллюлозы, широко используется в производстве лакокрасочных материалов и чернил для печатающих машин. Также он входит в композиции растворителей нитроглифталевих, перхлорвиниловых и эпоксидних эмалей, разных смазочных масел, восков, полиэфирных лаков, красок, кремниорганических лаков и эмалей. На эти цели расходуется до 30% всего производимого этилацетата. На стадии упаковывания различных товаров гибкими упаковочными материалами - как растворитель пленок и чернил при нанесении надписей и изображений трафаретным способом. Как реагент и как реакционная среда в производстве фармацевтических препаратов (метоксазол, гидрокортизон, рифампицин и т.д.). Один из самых популярных ядов, применяемых в энтомологических морилках для умерщвления насекомых. Насекомые после умерщвления в его парах гораздо мягче и податливее в препарировании, чем после умерщвления в парах хлороформа. Как компонент (пищевая добавка E1504) фруктовой эссенции, которую добавляют в прохладительные напитки, ликеры и кондитерские изделия. 1.2.1 Лабораторное применение Этилацетат часто используется для экстракции, а также для колоночной и тонкослойной хроматографии. Редко в качестве растворителя для проведения реакций из-за склонности к гидролизу и переэтерефикации. Для получения ацетоуксусного эфира 2CH3COOC2H5 + Na → CH3COCH2COOC2H5 + CH3CO2Na 1.3 Требования безопасности Этилацетат технический по степени воздействия на организм человека относится к числу малоопасных веществ (4 класс опасности). Пары этилацетата раздражают слизистые оболочки глаз и дыхательных путей. При действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м3.Этилацетат технический является легковоспламеняющейся жидкостью и образует в смеси с воздухом взрывоопасную смесь категории ПА, группы Т2 по ГОСТ 12.1.011. ЛД50 для крыс составляет 11.3 г/кг, показывая низкую токсичность. Пары этилацетата раздражают слизистые оболочки глаз и дыхательных путей, при действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м3. ПДК в атмосферном воздухе населенных мест 0.1 мг/м3[3].Температура вспышки — 2 °C, температура самовоспламенения — 400 °C, концентрационные пределы взрыва паров в воздухе 2,1-16,8 % (по объему).Безопасность при транспортировке. В соответстви с ДОПОГ (ADR) класс опасности 3, код по реестру ООН 1173. 2. Технологическая часть 2.1 Синтез этилацетата в лаборатории 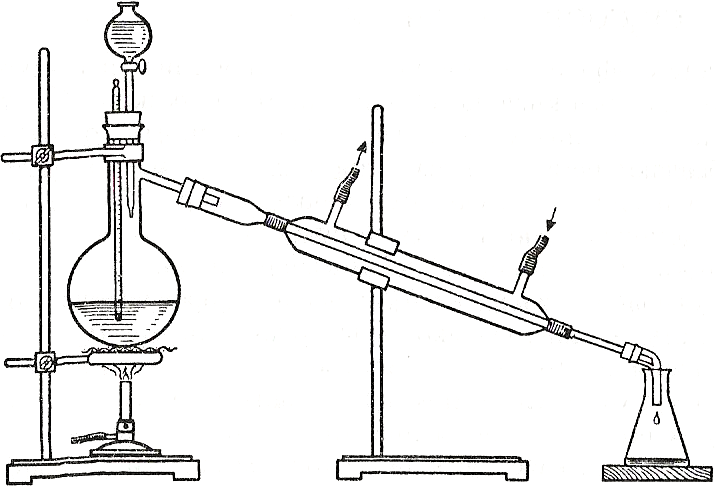 Рисунок 2.1 – Схема прибора для получения этилацетата Синтез осуществляют в приборе, изображенном на рисунке 2.1. В колбу Вюрца емкостью 100мл, снабженную капельной воронкой и соединительную с нисходящим холодильником, вливают 2,5 мл этилового спирта и затем осторожно при перемешивании приливают 1,5 мл концентрированной серной кислоты. Колбу закрывают пробкой, в которую вставлена капельная воронка. И нагревают на масляной (или металлической) бане до 140° С ( термометр погружен в баню). В колбу из капельной воронки постепенно приливают смесь из 2 мл этилового спирта и 4,5 мл ледяной уксусной кислоты. Приливание следует вести с такой же скоростью, с какой отгоняется образующий эфир. По окончании реакции (после прекращения отгона эфира) погон переносят в делительную воронку и взбалтывают с концентрированным раствором соды для удаления уксусной кислоты. Отделяют верхний эфирный слой и встряхивают его с насыщенным раствором хлористого кальция (для удаления спирта, который дает с хлористым кальцием кристаллическое молекулярное соединение СаCl2 * C2H5OH, нерастворимое в уксусноэтиловом эфире). Отделив эфир, сушат его прокаленным хлористым кальцием и перегоняют на водяной бане из колбы с дефлегматором. При температуре 71-75° С будет отгоняться смесь спирта и этилацетата, при 75-78° С переходит практически чистый уксусноэтиловый эфир. Выход составляет 20 г (65 % теоретического) [4]. 2.2 Производство этилацетата в промышленности Рассмотрим технологическую схему непрерывного производства этилацетата, изображенную на рисунке 2.2. Из напорного бака 1 исходная смесь реагентов, содержащая уксусную кислоту, этанол и серную кислоту в качестве катализатора, непрерывно поступает на реакцию через расходомер. Она вначале проходит теплообменник 2, в котором нагревается за счет паров, выходящих из реакционной колонны, и затем поступает на верхнюю тарелку эфиризатора 4. Благодаря обогреву куба колонны острым паром, образующийся этилацетат вместе с парами спирта и воды отгоняется из колонны, а жидкость при движении вниз по тарелкам обогащается водой. Время пребывания реакционной массы в эфиризаторе и соотношение исходных реагентов подбирают такими, чтобы кубовая жидкость содержала только небольшое количество непрореагировавшей уксусной кислоты (в ней остается также вся уксусная кислота). Эту жидкость выводят из куба, и после нейтрализации выводят в канализацию.  Рисунок 2.2 - Технологическая схема производства этилацетата 1 – напорный бак; 2 – теплообменник; 3 – конденсатор; 4 – эфиризатор; 5, 10 – ректификационные колонны; 6, 9 – конденсаторы-дефлегматоры; 7 – смеситель; 8 – сепаратор; 11 – холодильник; 12 – сборник; 13 – кипятильники. Пары, выходящие с верха реактора, содержат 70% спирта и 20% эфира. Они направляются на охлаждение и конденсацию вначале в теплообменник 2, где нагревают смесь исходных реагентов, а затем в конденсатор 3. Конденсат из аппарата 2 и часть конденсата из аппарата 3 возвращают на верхнюю тарелку реактора 4. Остальное его количество попадает в ректификационную колонну 5, предназначенную для отделения азеотропной смеси от водного спирта. Куб колонны 5 обогревается при помощи кипятильника 13, а флегму создают в аппарате 6, из которого часть конденсата возвращают на орошение. Кубовая жидкость колонны 5 состоит из спирта (большая часть) и воды. Она отводится из колонны и поступает на одну из нижних тарелок эфиризатора 4, чтобы обеспечить достаточное количество спирта в нижней части этой колонны и добиться более полной конверсии уксусной кислоты. Пары из колонны 5 конденсируются в аппарате 6, откуда часть конденсата идет на орошение, а остальное количество поступает в смеситель 7, где разбавляется примерно равным объемом воды (без этого, конденсат не расслоится, так как вода довольно хорошо растворима в смеси эфира со спиртом). Образовавшаяся эмульсия разделяется в сепараторе 8 непрерывного действия на два слоя – верхний, содержащий эфир с растворенным в нем спиртом и водой, и нижний, представляющий собой водный раствор спирта и эфира. Нижний слой возвращают на одну из средних тарелок колонны 5. Эфир-сырец из сепаратора 8 направляют на очистку от воды и спирта. Ее проводят в ректификационной колонне 10 путем отгонки низкокипящей тройной азеотропной смеси эфира, спирта и воды. Часть этой смеси после конденсатора 9 идет на орошение колонны 10, а остальное количество возвращается в смеситель 7. Этилацетат отводят из куба колонны 10 и после охлаждения в холодильнике 11 направляют в сборник 12. Некоторые эфиры получают по технологии, существенно отличающейся от описанной [5]. 2.3 Получение этилацетата по реакции Тищенко Реакция Тищенко, дающая возможность синтезировать сложные эфиры из альдегидов, является разновидностью реакции Канниццаро. При реакции Тищенко две молекулы альдегида конденсируются в отсутствие воды под каталитическим влиянием алкоголята алюминия с образованием соответствующего сложного эфира: 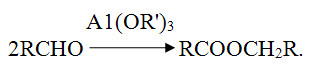 Этот процесс используют для производства этилацетата из ацетальде- гида. Катализатор состоит в основном из этилата алюминия, некоторого количества хлористого алюминия и небольших добавок окиси или этилата цинка. Конденсацию проводят при 0°, медленно прибавляя ацетальдегид к смеси этилацетата и этилового спирта. После этого реакционную смесь выдерживают до тех пор, пока конверсия альдегида не достигнет 98%. Продукты реакции перегоняют. Первая фракция представляет собой непрореагировавший альдегид и некоторое количество смеси этилацетата и этилового спирта. Эту фракцию возвращают в реактор. Вторая фракция содержит 75% этилацетата и 25% этанола. Ее применяют для приготовления катализатора. Третья фракция является чистым этилацетатом. Общий выход этилацетата из ацетальдегида равен 97—98% . Этот метод можно использовать для получения симметричных сложных эфиров из высших альдегидов. С этим процессом отчасти сходен синтез сложных эфиров из спиртов, который проводят под давлением при 220° в присутствии меди или хромита меди . Этиловый спирт в этих условиях превращается с высоким выходом в этилацетат [6]. Реакция идет, по-видимому, с промежуточным образованием ацетальдегида: 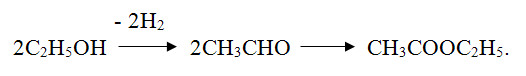 ЗАКЛЮЧЕНИЕ В данной курсовой работе всесторонне изучены несколько различных способов синтеза этилацетата, а именно получение данного сложного эфира как в лабораторных условиях, так и в промышленности. В теоретической части был рассмотрен процесс этерификации, были изучены физико-химические свойства этилацетата, а также области его применения в различных сфера быта и промышленности. В технологической части изучены принципиальные схемы установок, на которых осуществляется синтез этилацетата, рассмотрены механизмы работы с установками по синтезу целевого продукта. Изучен метод синтеза этилацетата из ацетальдегида в присутствии каталитической системы Al-Zn по реакции Тищенко. В расчетной части были рассчитаны стандартные тепловые коэффициенты для всех протекающих реакций, составлен материальный и тепловой баланс сложного химического процесса. Список ИСПОЛЬЗОВАННЫХ Источников [1] Тутурин Н. Н.,. Этерификация // Энциклопедический словарь Брокгауза и Ефрона: в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907 [2] И. Л. Кнунянц, Химическая энциклопедия, М.:1998, стр. 494 [3] X.Беккер, Г.Домшке, Э.Фангхенель, Органикум, М.:«Мир», 1992 [4] Г. В. Голодников, Т. В. Мандельштам, Практикум по органическому синтезу, Л.:«Ленинград», ун-та, 1976, стр. 376 [5] Н. Н. Лебедев, Химия и технология основного органического и нефтехимического синтеза, М.:«Химия», 1988, стр. 592 [6] Р. Гольдштейн, Химическая переработка нефти, М.:«Издательство иностранной литературы», 1961 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
