Безопасная больничная среда Стерилизация. Виды и методы стерилизации Студент должен знать
 Скачать 1.45 Mb. Скачать 1.45 Mb.
|
|
Безопасная больничная среда Стерилизация. Виды и методы стерилизации Студент должен знать: условия дезинфекции и стерилизации; способы и этапы предстерилизационной очистки (обработки); методы контроля качества предстерилизационной очистки и стерилизации; методы и режимы стерилизации; сроки годности стерильных объектов. Студент должен уметь: определять стерильность объекта по сроку годности и по индикаторам; проводить деконтаминацию инструментов; упаковывать шприцы и иглы в крафт-бумагу; упаковывать шприцы и иглы в мягкую бязевую упаковку; работать с острыми предметами; оказать себе помощь в случае попадания биологической жидкости на кожу и слизистые оболочки п при травмировании использованными предметами; обращаться со стерильным биксом. Вопросы для самоподготовки Деконтаминация медицинских инструментов. Что такое стерилизация? Какой документ лежит в основе стерилизации и дезинфекции? Методы и режимы стерилизации. Режим стерилизации в автоклаве резиновых изделий. Режим стерилизации в автоклаве металлических изделий. Методы проверки качества стерилизации. Правила пользования стерильным биксом. Меры профилактики заражения ВИЧ-инфекцией и гепатитом в ЛПУ. Стерилизация - уничтожение всех микроорганизмов и их вегетативных форм, например, спор (обеспложивание) - обеспечивает гибель в стерилизуемом материале вегетативных и споровых форм патогенных и непатогенных микроорганизмов. Стерилизации должны подвергаться все предметы или отдельные детали диагностической аппаратуры, которые соприкасаются с раной, кровью и другой биологической жидкостью. А также инъекционными приборами, с поврежденными слизистыми оболочками и др. Стерилизация - является важнейшим звеном в комплексе неспецифической профилактики ВБИ (внутрибольничной инфекции), фактором передачи возбудителей которых, служат нестерильные изделия медицинского назначения, но во всех случаях, стерилизация является последним барьером, защищающим пациента от таких инфекций. Стерилизация медицинского оборудования – процедура санитарно-гигиенической обработки изделий, представляющих эпидемиологическую опасность и способных стать источником распространения инфекционных заболеваний. Большинство медицинских инструментов непосредственно взаимодействуют с физиологическими жидкостями и тканями организма человека. Во избежание заражения и микробного обмена контактирующих сред проводят стерилизацию – обязательную в медицине процедуру, направленную на поддержание здоровой и безопасной атмосферы в учреждениях медицинского профиля. В настоящее время разработано несколько способов обработки медицинских изделий с применением различных видов стерилизационного оборудования. Выделяют физические и химические методы стерилизации. В основу физических (термических) методов заложена паровая, воздушная, инфракрасная или гласперленовая технологии. Соответственно, обработка инструмента производится с помощью водяного насыщенного пара, сухого горячего воздуха, инфракрасного излучения или сильно разогретых стеклянных шариков. Виды стерилизации: 1. централизованная и 2. децентрализованная. Централизованная стерилизация – Весь материал для стерилизации после дезинфекции поступает в центральное стерилизационное отделение (ЦСО), где и проводится предстерилизационная обработка (ПСО) и стерилизация, специально обученным медперсоналом. Децентрализованная стерилизация – Весь материал, требуемый стерилизации, дезинфицируют, проводят предстерилизационную обработку (ПСО), затем стерилизуют на местах (например, в частных стоматологических кабинетах). У нас в стране введен отраслевой стандарт «Стерилизация и дезинфекция изделий медицинского назначения» (ОСТ 42 - 21 - 2 - 85). Этим стандартом установлены методы, средства и режимы стерилизации и дезинфекции. 1. Термическая (физическая) стерилизация: Наибольшее распространение в российских ЛПУ получила классическая стерилизация медицинского оборудования горячим паром или воздухом. Это обусловлено удобством термической технологии: инструмент может обрабатываться в упаковке, после завершения процедуры на его поверхности не остается остатков химических препаратов. Новые модели термических стерилизаторов отличаются поддержанием стабильных температурных параметров и высокой скоростью работы. К стерилизационному оборудованию сегодня предъявляются высокие требования. К ним относятся: высокая активность и эффективность; безвредность для людей и окружающей среды; совместимость с материалами, используемыми в медицинской промышленности; широкий диапазон настроек и режимов; возможность точной дозировки и контроля над процессом; удобство эксплуатации. Несколько режимов стерилизационной обработки позволяют поддерживать требуемые параметры в рабочей камере в течение всего сеанса обработки. Новейшая стерилизующая техника является полностью автоматизированной, оснащается звуковой сигнализацией, визуальными индикаторами, системой самонаблюдения, самотестирования и самоблокировки. Производители медицинского стерилизационного оборудования постоянно работают над поиском технологий, позволяющих осуществлять стерилизацию в максимально быстром и безопасном режиме. Разрабатываются новые химические средства, дающие возможность осуществлять бережную обработку технически сложных инструментов, выполненных из разнородных материалов. Одновременно совершенствуется автоматика стерилизующих установок: расширяются возможности индикации процессов, повышается надежность внешнего и внутреннего контроля. Эталонная стерилизующая техника должна обеспечивать полноценную обработку изделий любой конструкции, выполненных из любых материалов при минимальных затратах времени, быть полностью управляемой, экономичной и экологически безопасной, поддерживать обработку упакованного инструмента и не оставлять на обрабатываемой поверхности остатков стерилизующих препаратов. Качество стерилизации медицинского оборудования зависит как от полезных характеристик применяемого оборудования и химических составов, так и от добросовестности и ответственности медицинского персонала. Каждому из этих факторов необходимо уделять внимание: оборудование должно обновляться, персонал – проходить стажировки и обучаться работе с новыми установками. Всё стерилизационное оборудование должно подвергаться профилактическому ремонту и периодическому контролю его состояния и функциональности. Неадекватная стерилизация медицинского оборудования чревата серьёзными последствиями: вспышками внутрибольничных инфекций, операционными осложнениями, высоким риском для здоровья медперсонала и пациентов. Поэтому к вопросу закупки стерилизационного оборудования следует подходить со всей ответственностью, отдавая предпочтение надежной и качественной продукции известных фирм-производителей. Стерилизация воздушным методом (сухим жаром)
Стерилизация паровым методом (автоклавирование)
Стерилизация в среде нагретых шариков (гласперленовый метод) В стерилизаторах, стерилизующим средством в которых является среда нагретых стеклянных шариков (гласперленовые шариковые стерилизаторы), стерилизуют изделия, применяемые в стоматологии (боры зубные, головки алмазные и др.). Изделия стерилизуют в неупакованном виде и используют сразу же. Ясно, что этот метод применим при децентрализованной стерилизации Разработана также стерилизация ультразвуком и электротоками разной частоты, которая ещё не приобрела практического значения для деятельности лечебных учреждений. Особенности плазменной стерилизацииПла́зма (от греч. πλάσμα «вылепленное», «оформленное») — частично или полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы. Образуется из нейтральных атомов (или молекул) и заряженных частиц (ионов и электронов).Около 30% инструментов, деталей оборудования и вспомогательных приспособлений в современных медицинских учреждениях являются термолабильными и неустойчивыми к воздействию агрессивных химических препаратов. К ним относятся электронные и оптоволоконные инструменты, изделия из полимерных материалов, датчики мониторов, зонды и катетеры и другие устройства. Неустойчивость медицинских изделий к высокой температуре не позволяет стерилизовать их в сухожаровых шкафах и автоклавах. Химические способы также не подходят для стерилизации инструментов указанного типа. Поэтому клиники нуждаются в эффективных технологиях обработки оборудования, позволяющих уничтожить все формы микроорганизмов, не повреждая его. Пероксидно - плазменная стерилизацияП  ероксидно-плазменная стерилизация — это воздействие на инструменты плазмой перекиси (пероксида) водорода, образующейся при низких температурах под влиянием электромагнитного поля. ероксидно-плазменная стерилизация — это воздействие на инструменты плазмой перекиси (пероксида) водорода, образующейся при низких температурах под влиянием электромагнитного поля.Обработка медицинских изделий производится при температуре 35-50°C, что обеспечивает сохранность термолабильного оборудования. Катион водорода и гидроксид-ион, являющиеся основными активными элементами плазмы перекиси водорода, не разрушают металлы, полимеры, стекло и другие материалы, из которых изготавливаются медицинские приборы и инструменты. Губительное воздействие плазмы на все формы микроорганизмов обеспечивается высокой окислительной способностью гидроксид-иона и катиона водорода, а также молекул перекиси водорода. Плазменная стерилизация позволяет уничтожить как вегетативные формы бактерий, так и их споры, а также вирусы. Данный метод эффективен в отношении устойчивых во внешней среде микроорганизмов, к которым относятся вирус гепатита B, микобактерии туберкулеза, синегнойная палочка и другие патогенные и условно-патогенные микробы. Процесс обработки инструментов в плазменном стерилизатореВ первую очередь инструменты должны пройти предстерилизационную обработку, к которой относятся дезинфекция высокого уровня и механическая очистка с использованием моющих средств. Далее оборудование и приспособления должны высохнуть, после чего их необходимо упаковать в специальные полиэтиленовые пакеты, имеющие индикаторы эффективности стерилизации. Затем оборудование помещается в плазменный стерилизатор. Этот прибор работает в автоматическом режиме, поэтому процесс стерилизации не требует контроля со стороны медицинского персонала. Время стерилизации зависит от выбранного режима и концентрации используемого раствора перекиси водорода. Стерилизатор PS-100 обеспечивает эффективную обработку инструментов в течение 50 минут при использовании 60%-ного пероксида водорода. Преимущества плазменной стерилизацииЭкономичность, безопасность и высокая эффективность относятся к преимуществам плазменной стерилизации. Экономичность Стерилизатор PS-100 расходует 2,5 мл 60%-ного раствора перекиси водорода за один цикл обработки изделий. Это уменьшает расход химических средств стерилизации медицинским учреждением. Сокращение времени обработки инструментов снижает расход электроэнергии. Кроме этого, плазменный стерилизатор PS-100 имеет небольшие физические размеры, что сокращает необходимую для его установки площадь. Плазменный метод является щадящим по отношению к стерилизуемым инструментам и оборудованию. Это позволяет увеличить количество циклов использования и стерилизации дорогостоящих медицинских устройств. Безопасность В процессе плазменной стерилизации не образуются опасные для человека и окружающей среды отходы. Поэтому PS-100 можно эксплуатировать в помещениях, не имеющих специальных вентиляционных систем. Стерилизация происходит в условиях низкой температуры и нормального атмосферного давления, что уменьшает вероятность травмирования персонала даже при нарушении техники безопасности. Эффективность Плазменный метод эффективен при обработке различных медицинских изделий, которые не поддаются другим видам стерилизации из-за угрозы выхода из строя. При этом надежность стерилизации контролируется с помощью индикаторов. В плазменном стерилизаторе оборудование обрабатывается в специальных пакетах, что позволяет сохранять его стерильность до очередного использования без проведения повторной обработки. 2. Химическая стерилизация: Химические методы основаны на газовой (воздействие окисью этилена), плазменной (обработка парами перекиси водорода в низкотемпературной плазменной среде), жидкостной (обработка химическими растворами – альдегид-, кислород- содержащими) технологиях. Химические стерилизующие составы обязаны обладать высоким бактерицидным действием (в том числе в отношении устойчивых бактерий и микробов), хорошей проникающей способностью и токсикологической безопасностью. Поводом к развитию химической стерилизации послужило распространение эндоскопических приборов, некоторые рабочие части которых не выдерживают высоких температур, применяемых в физических стерилизующих установках.
Стерилизация газом Газовая стерилизация применяется для эндоскопических инструментов, принадлежностей для анестезии и реанимации, изделий из пластических масс. Для этих целей применяют пары формалина, оксид этилена в смеси с бромидом метила. Для стерилизации используются автоматические газовые камеры. Медицинские изделия упаковывают в полиэтиленовую плёнку, в пергаментную бумагу, в бумажные пакеты. Газовым методом следует стерилизовать лишь те объекты, которые не выдерживают стерилизацию в автоклаве и в сухожаровом шкафу. В промышленном масштабе стерилизуют изделия для однократного применения (шприцы, иглы, полимерные катетеры, зонды и т. д.). Срок стерильности устанавливает завод (до 5 лет, в зависимости от упаковки). Способ стерилизации озоном, применяется при децентрализованной стерилизации 3. Радиационная (лучевая) стерилизация Лучевая стерилизация применяется на предприятиях медицинской промышленности, выпускающих изделия одноразового пользования. Стерилизующим агентом служат радиационные лучи - Υ и β. Доза облучения не должна бать менее 2,5 Мрад (25000 Гр). Эта доза, обладая достаточным бактерицидным действием, не вызывает наведенной радиации, что особенно важно при стерилизации. Срок стерильности до 5 лет (в зависимости от упаковки). Радиационная стерилизация имеет ряд преимуществ. Прежде всего, она позволяет обеспложивать предметы из термолабильных (не переносящих высокой температуры) материалов, которые всё чаще и чаще применяются в клинической практике (эндопротезы, шовный материал, лекарственные растворы, шприцы, катетеры и др.). Стерилизацию можно проводить в герметичной упаковке. Контроль качества стерилизации Проверку температурного режима осуществляют с помощью максимальных ртутных термометров, которые помещают в контрольные точки стерилизаторов. Для контроля температуры используют также химические индикаторы (индикаторы типа ИС, химические тесты), которые помещают в контрольные точки. Индикаторы типа ИС представляют собой полоску бумаги с нанесенным на неё индикаторным слоем и предназначены для оперативного визуального контроля совокупности параметров (температура и время) режимов работы паровых и воздушных стерилизаторов. Для проверки качества стерилизации в автоклавах используют -индикаторы - ИС - 120 (НПФ «Винар» и НПФ «АНВ») для щадящего режима и индикаторы - ИС - 132 (НПФ «Винар» и НПФ «АНВ») для основного режима. Для проверки качества стерилизации в сухожаровых шкафах используют индикаторы - ИС - 160 (НПФ «Винар» и НПФ «АНВ») для щадящего режима и индикаторы - ИС - 180 (НПФ «Винар» и НПФ «АНВ») для основного режима. Бактериологический контроль работы стерилизационной аппаратуры осуществляют с помощью биотестов на основании гибели спор термоустойчивых организмов. Биотесты представляют собой дозированное количество спор тест-культуры Bacillus stearotemophilus ВКМ В-718. Эти биотесты применяются в автоклавах. В сухожаровых шкафах применяют биотесты с культурой Bacillus licheniformis шт. G ВКМ В-1711 D. Биотест упаковывают (для предупреждения вторичного обсеменения после стерилизации). Упакованные тесты помещают в контрольные точки стерилизаторов и стерилизуют. Поле стерилизации биотесты направляются в бактериологическую лабораторию, где с них делается посев на питательную среду. Основанием для заключения об эффективности работы стерилизационной аппаратуры является отсутствие роста тест-культуры всех биотестов в сочетании с удовлетворительными результатами. Физического контроля (термовременные индикаторы (стелетесты и стелеконты) и т. д.). Химические методы контроля с помощью химических веществ (мочевина, бензойная кислота, тиомочевина, аскорбиновая кислота и др.) уже устарели и их сейчас не используют. Кроме того, в ЛПУ проводится плановый контроль службой СЭН 2 раза в год и бактериологической лабораторией ЛПУ - 1 раз в месяц, а контроль стерильности инструментария, перевязочного материала, операционного поля, рук хирурга и медсестры - 1 раз в неделю. Правила пользования стерильным биксом Транспортировать стерильные биксы в непромокаемых мешках. Если транспортировка проводилась без мешка, то перед использованием бикс следует обработать снаружи 1% раствором хлорамина, проверить окошки, которые должны бать закрыты. Вымыть руки (гигиенический уровень). Прочитать на бирке дату и время стерилизации. Отметить дату вскрытия на бирке. Вскрыть бикс, проверить тест на стерильность. Держать крышку открытой не более 30 секунд. Не держать крышку за внутреннюю сторону. Заправлять пелёнку, в которую завернут стерильный материал в бикс или, если будет использован сразу весь материал, то заправлять не обязательно. доставать из бикса стерильный материал только длинными инструментами (корнцангом или длинным пинцетом). После вскрытия бикса он считается стерильным в течение рабочей смены. Если бикс случайно «запачкан», то надо открыть окошки бикса (если бикс старый) и зачеркнуть на бирке дату стерилизации и на новых и на старых. Нестерильный бикс поставить отдельно от стерильных биксов. Домашнее задание: Лекции. С.А.Мухина, И.И.Тарновская. Практическое руководство к предмету «Основы сестринского дела», стр. 51 - 56. Учебно-методическое пособие по основам сестринского дела, стр. 264 - 273. Из интернета: Биологические методы контроля Использование бактериологических культур для подтверждения надежности стерилизаиионных мероприятий называют бактериологическим контролем. Биологический индикатор (БИ) - устройство, содержащее определенное количество жизнеспособных микроорганизмов, обладающих высокой резистентностью к инактивации в стерилизационном процессе. Резистентность биоиндикатора, предназначенного для конкретного метода стерилизации, должна быть охарактеризована количественно. Например, характеристиками индикатора для стерилизации паром должны быть величины D10 и Z; первая означает время, в течение которого при определенной температуре микробная популяция уменьшается в 10 раз, вторая - увеличение (уменьшение) температуры (oС), при которой величина D10 уменьшается (увеличивается) в 10 раз. Простота интерпретации результата - если погибла более многочисленная популяция более резистентного тест-организма в БИ, то должна погибнуть и остальная микрофлора в данном стерилизационном цикле, делает биоиндикаторы весьма привлекательными при организации надежной стерилизации. В зависимости от дизайна индикаторы могут быть раздельными, в которых микробная тест-культура после стерилизационного цикла переносится в стерильную питательную среду для последующего инкубирования, и автономными, в которых тест-культура, нанесенная на инертный носитель, и питательная среда (в отдельной ампуле) помещены в одну упаковку и стерилизуются вместе. После стерилизации ампула со средой разрушается, и индикатор инкубируется. Биологические индикаторы раздельного типа рекомендуется применять в случае невозможности размещения автономных индикаторов в (на) стерилизуемом изделии, при оценке надежности стерилизации отдельных частей стерилизуемого изделия, определения наиболее труднодоступных для стерилизации мест. Существенным недостатком биоиндикаторов раздельного типа является необходимость создания асептических условий для переноса тест-организма после стерилизации в питательную среду, чтобы избежать контаминации индикатора. Причем риск получения ложного результата всегда остается. Автономные биоиндикаторы лишены этого недостатка. Но у них имеется свой, связанный с возможностью уменьшения чувствительности питательной среды при температурной (паровая, воздушная) стерилизации. Наличие микробного роста в биоиндикаторе может определяться после инкубирования по увеличению мутности микробной суспензии, по изменению окраски рН-индикатора или то и другое одновременно. В последние годы разработаны индикаторы, в которых наличие микроорганизмов, сохранивших жизнеспособность после стерилизации, определяется по флуоресценции. Эти индикаторы имеют значительное преимушество, т. к. из-за высокой чувствительности флуоресцентного способа индикации ответ о качестве стерилизации могут давать в течение 1 часа после окончания цикла стерилизации вместо 24-48 часов. Таким образом, БИ относятся к типу интегрированных многопараметровых индикаторов, в которых все факторы летальности одинаково влияют как на тест-организм в индикаторе, так и контаминирующую микрофлору на стерилизуемом изделии. При создании БИ выбирается тест-организм, резистентность которого к конкретному стерилизационному процессу превышает резистентность контаминирующей микрофлоры. Кроме того, количество этих микроорганизмов в БИ должно превышать суммарную популяцию на стерилизуемых изделиях. А так как кинетика гибели тест-объекта и контаминанта подчиняется одному закону, то соблюдение требований по резистентности и количеству микроорганизмов в БИ предусматривает большой запас вероятности полной гибели контаминирующей микрофлоры. Помещенные внутри стерилизуемых изделии БИ могут свидетельствовать и документально подтверждать достижение критических параметров стерилизации непосредственно в изделиях. Таким образом, в настоящее время существует достаточное количество средств контроля стерилизации для объективного суждения о ее надежности, но отсутствует система их оптимального использования. Под системой контроля стерилизации подразумевается комплекс методов с указанием объема и периодичности их проведения и описанием порядка действий персонала в различных ситуациях. Системы контроля должны быть адекватны методу стерилизации, типу стерилизатора и его оснащенности штатными контрольно-измерительными устройствами, степени физического и морального износа. Контролю должны подвергаться все критические параметры метода стерилизации. Персонал, выполняя предусмотренные системой контроля мероприятия, должен получить возможность сделать заключение о соответствии стерильной продукции требуемым нормам. Создание такой системы особенно актуально в странах СНГ, где до настоящего времени эксплуатируется морально и физически устаревшее стерилизационное оборудование. Химическая, плазменная и др. методы стерилизацииСтерилизация (от лат. sterilis – бесплодный) – уничтожение всех патогенных и непатогенных организмов на любой стадии развития. Поставляемое нашей компанией оборудование для стерилизации позволяет достичь 100% стерильности материала. Ко многим средствам стерилизации устойчивы споры микроорганизмов, поэтому в отношении изделий медицинского назначения стерилизующими считаются средства со спороцидным действием. Изделия медицинского назначения, которые входят в контакт с физиологическими жидкостями пациента, растворами для инъекций, со стерильными в норме тканями, относятся к разряду критических. Эти изделия несут опасность инфицирования и требуют стерилизации после каждого однократного использования. Кроме медицинских инструментов стерилизацию также проходят перевязочные материалы, спецодежда медработников, резиновые перчатки и т.д.  Основные этапы стерилизацииСовременные стерилизационные приборы отличаются небольшим сроком воздействия и высокой степенью автоматизации, то есть участие человека в процессе стерилизации сведено к минимуму. Процесс стерилизации предполагает комплекс подготовительных работ: мытье изделий медицинского назначения, дезинфекция, сушка, комплектация и упаковка. Поэтому продолжительность стерилизации зависит от методов п  редстерилизационной очистки. Средства такой очистки, кроме высокой эффективности и удобства применения, должны быть также максимально безопасны для человека и окружающей среды. редстерилизационной очистки. Средства такой очистки, кроме высокой эффективности и удобства применения, должны быть также максимально безопасны для человека и окружающей среды.Методы стерилизацииДля применения в лечебных учреждениях разрешено несколько методов стерилизации. По способу воздействия их можно в целом разделить на физические и химические. К физическим (термическим) методам относятся паровая стерилизация (автоклавирование водяным паром под давлением), воздушный (обработка сухим горячим воздухом), инфракрасное излучение и гласперленовый (обработка в среде нагретых стеклянных шариков). Эти методы считаются традиционными. Большинство медицинских учреждений используют высокоэффективный и экономичный метод паровой стерилизации, подходящий для большинства предметов медицинского назначения. Этот метод обеспечивает стерильность не только поверхности изделия, но и всего изделия целиком. В России до сих применяется воздушная стерилизация, хотя в большинстве развитых стран от нее постепенно отказываются. Для такой стерилизации применяются сухожаровые шкафы. Физические методы стерилизации предполагают использование высокотемпературного режима от 121°С, что не подходит для большинства современных медицинских приборов и сложных инструментов. Это послужило основанием к повсеместному распространению низкотемпературных методов стерилизации. К химическим (низкотемпературным) методам, применяемым в медицине, относятся газовый, жидкостный и плазменный методы стерилизации. Жидкостная стерилизация проводится при помощи химических растворов. Стерилизация растворами химических веществ считается вспомогательным методом, но имеет два важнейших преимущества: во-первых, это возможность обработки объектов из термочувствительных материалов (инструменты, содержащие пластик, силикон, оптоволоконные, микрооптические, микрохирургические и т.п. ); во-вторых, она наиболее дешева по сравнению с другими методами. Среди газовых выделяются этиленоксидный и формальдегидный. Газовую стерилизацию проводят в стационарных установках для стерилизации. Газовая стерилизация Этиленоксидом Оксид этилена – одно из самых востребованных веществ в медицинских учреждениях мира. Несомненным достоинством газовой стерилизации этиленоксидом является щадящий температурный режим, позволяющий обрабатывать изделия из пластика, полимерных материалов и оптику. Подготовленные, высушенные и упакованные медицинские изделия помещают в газовую камеру стерилизационного прибора, герметично закрывают, удаляют воздух до определенного уровня давления и подают в камеру газ. ФормальдегидФормальдегид имеет низкую проникающую способность и больше подходит для качественной дезинфекции, чем для стерилизации. Температура при стерилизации парами формальдегида должна быть не меньше 80°С, что ставит под сомнение определение этого метода как низкотемпературного. Кроме того, некоторые медицинские изделия не могут быть обработаны парами формальдегида (полые инструменты, с каналами и отверстиями). Оба эти метода имеют недостатки: высокая токсичность агентов и длительная вентиляция стерильных изделий. Плазменный методПлазменный метод позволяет создать биоцидную среду на основе водного раствора пероксида водорода, а также низкотемпературной плазмы. Это самый современный метод стерилизации, известный на сегодняшний день. Он позволяет стерилизовать любые медицинские изделия, от полых инструментов до кабелей, электроприборов и вообще тех изделий, которые чувствительны к высокой температуре и влаге. Однако перевязочный материал, белье, жидкости не подлежат плазменной стерилизации. Минимальное время обработки в плазменном стерилизаторе – от 35 минут, рабочая температура – 36-60°С. Одно из основных преимуществ этого метода – отсутствие токсичных отходов, образуются только кислород и водный пар. Плазменная стерилизация уничтожает все формы и виды микроорганизмов. Плазма образуется под воздействием сильного электромагнитного излучения в атмосфере паров перекиси водорода. В вакуумную камеру на специальные стеллажи закладываются медицинские изделия. Под действием электромагнитного поля возникает также ультрафиолетовое излучение. Плазменные стерилизаторы – перспективное оборудование, но для большинства российских медицинских учреждений слишком дорогостоящее. Оборудование для стерилизацииСовременное оборудование для стерилизации бывает различных типов и видов. Для термочувствительных медицинских изделий, таких как эндоскопы, катетеры, микрохирургический инструмент и т.д. применяются установки для стерилизации при помощи низкотемпературных методов. Для стерилизации обычных изделий применяются автоклавы или инфракрасные шкафы. Автоклав Автоклав представляет собой установку для стерилизации паром под давлением. Он используется как для обеззараживания нечувствительных к температуре и влажности медицинских инструментов, так и для обработки халатов, перчаток, перевязочного материала. Сухожаровой шкафСтерилизация в сухожаровом шкафу происходит при помощи циркуляции внутри него горячего воздуха. Это оборудование используется для термической стерилизации медицинских инструментов. Преимущество сухожаровых шкафов в том, что инструменты при обработке остаются сухими, благодаря чему не создается риск возникновения коррозии. В настоящее время все большей популярностью пользуются полностью автоматические стерилизационные приборы. Они оснащаются микропроцессором с несколькими программами стерилизации, которые можно при необходимости перепрограммировать под свои нужды. Оборудование для стерилизации выпускается двух типов: встроенное в стену и свободной установки. Габариты стерилизационных установок также бывают различны. В настоящее время существуют стерилизаторы с объемом стерилизационных камер от 10 до 100 литров.
Устройство и работа ЦСО интернет Все изделия, поступающие в ЦСО, проходят несколько этапов технологической цепочки: прием и разборка, предстерилизационная обработка на различных типах оборудования, либо вручную, контроль качества обработки, комплектование и упаковка, непосредственно стерилизация и выдача (доставка) в клинические отделения. Планировка ЦСО должна обеспечить достаточный набор производственных помещений для выполнения всех технологических операций. В типовых проектах больниц предусмотрены ЦСО из расчета площадей 0,14 кв.м. на одну койку. В то же время зарубежные проекты предусматривают 0,5 - 0,7 кв. м. на одну койку в зависимости от количества коек и профиля лечебного учреждения. Скорее всего, они правы. В соответствии с существующими нормативно-методическими документами, ЦСО должно располагать набором помещений, которые разделяются на 2 зоны: нестерильную и стерильную. Это положение нуждается в корректировке. Современное центральное стерилизационное отделение должно иметь 3 зоны: "грязную", "чистую" и "стерильную". "Грязная" зона - это помещения, в которых находится использованный инструментарий и материалы; представлены комнатой для приема материала в контейнерах из отделений и двумя моечными помещениями - одно для непосредственно инструментов и материалов, а другое - для транспортных тележек, на которых осуществляется перевозка контейнеров по лечебному учреждению. "Грязная" зона сообщается с "чистой" только через моечные автоматы проходного типа и посредством закрывающегося передаточного окна (для передачи инструментов, вымытых, продезинфицированных и высушенных вручную). В состав "грязной" зоны целесообразно включить гардероб для верхней одежды и санузлы общего пользования. "Чистая" зона - это те помещения, что расположены непосредственно за мойками. Там находятся инструменты и материалы уже чистые, но еще не стерильные. К этим помещениям относятся комнаты упаковки и подготовки к стерилизации инструментов, подготовки и упаковки текстиля, изготовления перевязочных материалов, различные складские помещения и комнаты для персонала, одетого в спецодежду (халаты, головные уборы, специальная обувь). Вход в "чистую" зону осуществляется через санпропускник. "Стерильная" зона - это, собственно, склад стерильного материала. Он отделен от "чистой" зоны проходными стерилизаторами. Это помещение особой чистоты, куда вход разрешен только через санпропускник, строго ограниченному персоналу, в специальной одежде, к примеру, обязательно в масках. Предусматриваются также служебные помещения, изолированные от функциональных. Это коридоры, канцелярия, комната персонала, не одетого в спецодежду, комната подготовки воды и др. Помещения необходимо распланировать таким образом, чтобы потоки грязных, чистых и стерильных материалов и инструментов не пересекались. Оптимальная, с точки зрения автора, схема ЦСО представлена на схеме: 
Типовая схема устройства Центрального стерилизационного отделения ЛПУ.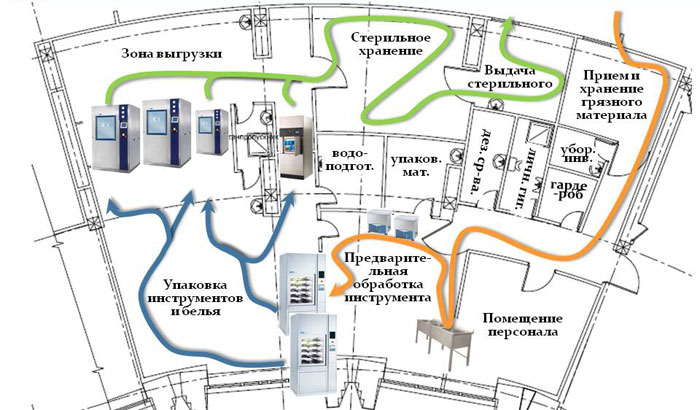 |
