Лекция Спирты. Гидроксисоединения к органическим гидроксисоединениям
 Скачать 360 Kb. Скачать 360 Kb.
|
|
Гидроксисоединения К органическим гидроксисоединениям относятся вещества, содержащие одну или более гидроксильных групп –ОН, связанных с углеводородным радикалом. В зависимости от характера углеводородного радикала эти соединения подразделяют на две большие группы: спирты R–OH фенолы Ar–OH, где R – алкил, алифатический углеводородный радикал со свободной валентностью при насыщенном sp3-атоме углерода; Ar – арил, ароматический радикал, свободная валентность которого принадлежит sp2-атому углерода бензольного кольца (например, радикал фенил C6H5–). Радикал бензил C6H5–CH2– является арилалкилом (свободная валентность находится при насыщенном атоме углерода), поэтому соединение C6H5–CH2–ОН относится к спиртам. Спирты Cпирты (от лат. spiritus — дух) – производные углеводородов, молекулы которых содержат одну или несколько гидроксильных групп –ОН, связанных с насыщенными (sp3) атомами углерода. Классификация. Номенклатура. Изомерия Спирты классифицируют по трём структурным признакам. По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа -ОН), многоатомные (две и более групп -ОН). Современное название многоатомных спиртов – полиолы (диолы, триолы и т.д). Примеры: двухатомный спирт – этиленгликоль (этандиол) HO–СH2–CH2–OH трехатомный спирт – глицерин (пропантриол-1,2,3) HO–СH2–СН(ОН)–CH2–OH В зависимости от того, с каким атомом углерода (первичными, вторичными или третичными) связана гидроксигруппа, различают спирты первичные R–CH2–OH, вторичные R2CH–OH, третичные R3C–OH. Например:  В многоатомных спиртах различают первично-, вторично- и третичноспиртовые группы. Например, молекула трехатомного спирта глицерина содержит две первичноспиртовые (HO–СH2–) и одну вторичноспиртовую (–СН(ОН)–) группы. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на предельные – алканолы (например, СH3CH2–OH) и циклоалканолы (циклобутанол  и др.); и др.);непредельные – алкенолы (CH2=CH–CH2–OH), алкинолы (CH≡C–CH2–OH), циклоалкенолы и т.п.; ароматические  Предельные одноатомные спирты Гомологический ряд предельных одноатомных спиртов повторяет аналогичный ряд алканов и соответствует общей формуле CnH2n+1OH. Номенклатура и изомерия Номеклатура. Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо). Например:  Нумерация ведется от ближайшего к ОН-группе конца цепи. Цифра, отражающая местоположение ОН-группы. По другому способу названия одноатомных спиртов производят от названий радикалов с добавлением слова "спирт" (название класса). В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропиловый спирт, изопропиловый спирт.  Изомерия спиртов изомерия положения ОН-группы (начиная с С3) например:  изомерия углеродного скелета (начиная с С4)  межклассовая изомерия с простыми эфирами (начиная с С2)  Строение гидроксильной группы Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:  Атому кислорода в спиртах R-O-H свойственна sp3-гибридизация. В образовании его связей с атомами C и H участвуют две 2sp3-атомные орбитали, валентный угол C–О–H близок к тетраэдрическому (около 108,5°). Каждая из двух других 2sp3-АО кислорода занята неподеленной парой электронов. Физические свойства Являясь производными углеводородов, низшие спирты менее летучи и имеют аномально высокие температуры кипения и плавления; значительно лучше растворимы в воде, что обусловлено ассоциацией за счет водородных связей.  Способность растворяться в воде уменьшается с увеличением углеводородного радикала и от многоатомных гидроксисоединений к одноатомным. Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Химические свойства Спирты не обладают ярко выраженной кислотностью или основностью. Связи С-О и О-Н в молекуле спирта полярны. Поэтому все реакции спиртов можно разделить на три группы: I. Реакции, идущие с участием только атома водорода гидроксильной группы; II. Реакции, идущие с замещением или отщеплением всей ОН-группы; III. Реакции окисления. I. Реакции с участием атома водорода ОН-группы 1. Образование алкоголятов Одноатомные спирты реагируют с активными металлами (Na, K, Mg, Al и др), образуя соли – алкоголяты (алкоксиды):  2. Образование сложных эфиров (реакция этерификации) при взаимодействии спиртов с органическими кислотами в присутствии сильных минеральных кислот:  Взаимодействие кислот и спиртов протекает обратимо (обратный процесс – гидролиз сложных эфиров). Название сложного эфира строится по названию углеводородного радикала в молекуле спирта (метил, этил и т.д.) с добавлением названия анионного остатка кислоты (ацетат, нитрат, сульфат, фосфат и т.п.). Часто сложные эфиры называют как спиртовые производные кислот, используя тривиальные названия последних. Например: метиловый эфир уксусной кислоты (метилацетат), этиловый эфир муравьиной кислоты (этилформиат). Примеры реакций образования сложных эфиров: 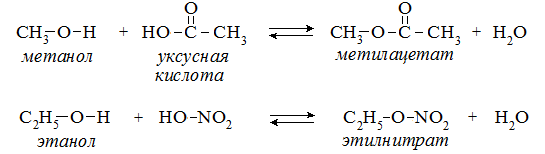 II. Реакции с участием всей ОН-группы 3. Дегидротация спиртов Отщепление воды от молекул спирта (дегидратация спиртов) происходит при действии концентрированной серной кислоты и в зависимости от температуры может идти как внутримолекулярная или межмолекулярная реакция. Внутримолекулярная дегидратация спиртов осуществляется при повышенной температуре и приводит к образованию алкенов (реакция элиминирования):  В тех случаях, когда возможны два направления реакции, например:  дегидратация идет преимущественно в направлении I, то есть по правилу Зайцева – с образованием более замещённого алкена (водород отщепляется от менее гидрогенизированного атома углерода). Легкость внутримолекулярной дегидратации спиртов уменьшается в ряду: третичные > вторичные > первичные. Межмолекулярная дегидратация спиртов с образованием простых эфиров происходит при более низкой температуре, чем внутримолекулярная реакция:  Активность спиртов при межмолекулярной дегидратации: СН3ОН > первичные > вторичные > третичные. 4. Реакции замещения Замещение гидроксила ОН на галоген происходит в реакции спиртов с галогеноводородами: R–OH + HX Образованию R–X способствует катализатор – сильная кислота (например, конц. H2SO4). При этом спирты проявляют свойства слабых оснований.  III. Реакции окисления Окисление спиртов можно производить, действуя на них K2Cr2O7 или KMnO4 в сильнокислой среде, при этом действие окислителя направляется на тот углеродный атом, который связан с ОН-группой. Из первичных спиртов образуются альдегиды, из вторичных – кетоны. Окисление третичных спиртов требует более жестких условий, протекает с разрывом С-С связей, ближайших к ОН-группе, и приводит к смеси карбоновых кислот и кетонов.   Получение спиртов 1. Метанол в промышленности получают из синтез-газа, катализаторы – оксиды Zn, Cr, Al: CO + 2H2 2. В промышленном производстве этанола, наиболее распространённого из спиртов, используется ряд методов: а) ферментативное брожение глюкозы C6H12O6, полученной из пищевого сырья (зерновых культур, картофеля) или отходов сахарного производства по схеме: C6H12O6 → 2C2H5OH + 2CO2 в) гидратация этилена (синтетический спирт) CH2=CH2 + H2O (Н+) → CH3CH2OH Последний метод наиболее экономичный. 3. Вторичные и третичные спирты образуются при кислотной гидратации алкенов.Присоединение воды к несимметричным алкенам идет по правилу Марковникова:  4. Щелочной гидролиз галогеноуглеводородов: 5. Восстановление альдегидов и кетонов:  Двухатомные спирты Двухатомные спирты (гликоли) содержат в молекуле две гидроксильные группы при разных углеродных атомах. Общая формула таких спиртов CnH2n(OH)2. Номенклатура. По систематической номенклатуре названия двухатомных спиртов производят от названия предельных углеводородов с добавлением суффикса –диол и указанием положения гидроксильных групп в углеродной цепи. По рациональной номенклатуре сохраняются названия от соответствующих алкенов с прибавлением слова «гликоль». Например:  Изомерия двухатомных спиртов зависит от строения углеродной цепи и расположением в ней гидроксильных групп. В зависимости от их положения различают α-гликоли (гидроксильные группы находятся у рядом стоящих углеродных атомов), β-гликоли (гидроксильные группы расположены в 1,3-положении), γ-гликоли (гидроксильные группы расположены в 1,4-положении) и т.д. α-гликоль β-гликоль γ-гликоль бутандиол-1,2 бутандиол-1,3 бутандиол-1,4   α-гликоль α-гликоль β-гликоль бутандиол-2,3 2-метилпропандиол-1,2 2-метилпропандиол-2,3 Физические свойства Низшие гликоли – сиропообразные, сладкие на вкус, растворимые в воде вещества. Гликоли кипят при более высокой температуре и имеют большую плотность, чем соответствующие им (с тем же числом углеродных атомов) одноатомные спирты. Это объясняется присутствием в молекуле второй гидроксильной группы, что ведет к образованию дополнительных водородных связей. Химические свойства В химических реакциях двухатомные спирты могут реагировать одной или двумя гидроксильными группами. 1. Образование гликолятов. В отличие от одноатомных спиртов двухатомные спирты легко вступают во взаимодействие не только со щелочными металлами, но и с оксидами и гидроксидами металлов. Образующиеся вещества называют гликолятами: HO–CH2–CH2–OH + 2NaOH гликолят натрия Такие спирты, в отличие от одноатомных, взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи и образуют внутрикомплексные соли меди(II), имеющие глубокую синюю окраску (качественная реакция):  гликолят меди 2. Гидрогалогенирование  3. Окисление. При окислении этиленгликоля образуется ряд продуктов:  Получение 1. Гликоли получают окислением алкенов щелочным раствором KMnO4 (реакция Вагнера):  2. Гидролиз дигалогенпроизводных алканов (с атомами галогена при разных углеродных атомах)  Трехатомные спирты Трехатомные спирты содержат три гидроксильные группы при разных углеродных атомах. Важным представителем трехатомных спиртов является глицерин:  глицерин (пропантриол-1,2,3) Номенклатура и изомерия. Для названия трехатомных спиртов по систематической номенклатуре необходимо к названию соответствующего алкана добавить суффикс – триол. Изомерия трехатомных спиртов, как и двухатомных, определяется строением углеродной цепи и положением в ней трех гидроксильных групп. Химические свойства По химическим свойствам глицерин во многом напоминает этиленгликоль. Он может реагировать одной, двумя или тремя гидроксильными группами. 1. Образование глицератов. Глицерин взаимодействует со щелочными металлами, а также с гидроксидами тяжелых металлов, образует глицераты:  глицерин глицерат меди 2. Образование сложных эфиров. С органическими и минеральными кислотами глицерин образует сложные эфиры:  Получение 1. Глицерин можно получать гидролизом растительных и животных жиров  2. Синтез глицерина из пропилена (промышленный способ):  |
