Классификация основных классов неорганических веществ. Составление формул и номенклатура химических соединений.
Важнейшими классами неорганических соединений являются оксиды, кислоты, основания и соли.
Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления (– 2).
При написании формулы оксида символ элемента, образующего оксид, ставится на первое место, а кислорода – на второе. Общая формула оксидов: ЭхОу.
Особую группу кислородных соединений элементов составляют пероксиды. Обычно их рассматривают как соли пероксида водорода Н2О2, проявляющего слабые кислотные свойства. У пероксидов атомы кислорода химически связаны не только с атомами других элементов, но и между собой (образуют пероксидную группу – О–О–).
По реакционной способности оксиды можно разделить на солеобразующие и несолеобразующие (безразличные). В свою очередь, солеобразующие оксиды подразделяются на основные, кислотные и амфотерные.
Основными называются такие оксиды, которым соответствуют основания. Например, Na2O, CaO являются основными оксидами, так как им соответствуют основания NaOH, Ca(OH)2.
Получение основных оксидов
1.Взаимодействие металла с кислородом.: 4 Li + O2 → 2 Li2O.
2.Разложение при нагревании кислородных соединений: карбонатов, нитратов, оснований.
1. Взаимодействие с водой. По отношению к воде основные оксиды делятся на растворимые и нерастворимые
Na2O + H2O → 2NaOH;
CaO + H2O → Ca(OH)2.
2. Основные оксиды взаимодействуют с кислотами, образуя соль и воду. CaO + H2SO4 → CaSO4 + H2O
3. Основные оксиды взаимодействуют с кислотными, образуя при этом соль
Кислотными называются такие оксиды, которым соответствуют кислоты. Например, CO2, P2O5, SO3 являются кислотными оксидами, так как им соответствуют кислоты H2CO3, H3PO4, H2SO4.
Амфотерными называются такие оксиды, которые в зависимости от условий проявляют основные или кислотные свойства, то есть обладают двойственными свойствами.
1.Амфотерные оксиды не взаимодействуют с водой.
2.Амфотерные оксиды взаимодействуют с кислотами.
Al2O3 + 6 HCl → 2 AlCl3 + 3 H2O
3. Амфотерные оксиды взаимодействуют с основаниями.
Al2O3 + 2 NaOH¾¾® 2 NaAlO2 + H2O Al2O3 + 2NaOH+ 3H2O® 2Na[Al(OH)4 ]
4. Амфотерные оксиды взаимодействуют с основными и кислотными оксидами.
Al2O3 + 3 SO3 ¾¾® Al2(SO4)3
Гидроксиды – это сложные многоэлементные химические соединения, в состав которых входят атомы какого-либо элемента, кислорода и водорода. Поэтому гидроксиды делятся на три большие группы:
1.Гидраты кислотных оксидов, называемые кислотами, например, H2SO4.
2.Гидраты основных оксидов, называемые основаниями, например, Ba(OH)2.
3.Гидраты амфотерных оксидов, называемые амфотерными гидроксидами, например, Be(OH)2.
Основания – это электролиты, диссоцирующие в водном растворе с образованием
катиона металла (или иона аммония NH4+) и гидрокс группы .ОН
Способы получения щелочей и оснований
1. Растворимые в воде основания (щелочи) получают при взаимодействии щелочных и щелочно-земельныхметаллов с водой.
2Na + 2Н2O → 2NaOH + H2-
2. Растворимые в воде основания (щелочи) получают при взаимодействии оксидов щелочных и щелочно-земельныхметаллов с водой.
Na2O + H2O → 2NaOH
3. Щелочи можно получить электролизом водных растворов соответствующих солей (Например, гидроксид натрия можно получить электролизом раствора соли NaCl).
2 NaCl + 2 H2O → 2 NaOH + H2- + Cl2- Катод: 2 H2O + 2e– → H2 + 2 OH– Анод: 2 Cl– – 2e– → Cl2
4. Малорастворимые или нерастворимые в воде основания получают путем взаимодействия растворов соответствующих солей с растворами щелочей.
Кислоты – это электролиты, диссоцирующие в водном растворе с образованием катиона
водорода Н+ и аниона кислотного остатка.
По химическому составу, а именно по отсутствию или наличию атомов кислорода в молекулах, кислоты делятся на кислородсодержашие (H2SO4, HNO3) и бескислородные (H2S, HF, HCl).
Способы получения кислот
1. Взаимодействие кислотного оксида с водой
Исключение составляют SiO2, TeO2, TeO3, MoO3, WO3, которые с водой не взаимодействуют. 2. Если кислотный оксид не растворим в воде, то соответствующие им кислоты получают
косвенным путем, а именно, действием другой кислоты на соответствующую соль.
3. Бескислородные кислоты получают путем взаимодействия неметаллов с водородом с последующим растворением продуктов в воде.
Соли – это электролиты, диссоцирующие в водном растворе с образованием катионов
основных остатков и анионов кислотных остатков.
Соли подразделяются на средние, кислые и основные.
Химическая формула - изображение состава вещества с помощью символов химических элементов, числовых индексов и некоторых других знаков.
 имическая формула - изображение состава вещества с помощью символов химических элементов, числовых индексов и некоторых других знаков. имическая формула - изображение состава вещества с помощью символов химических элементов, числовых индексов и некоторых других знаков.
Графические формулы химических соединений.
Молекулы неорганических соединений могут быть охарактеризованы с помощью графических формул. Графические формулы показывают количество связей между элементами в молекулах соединений.
При составлении графических формул следует пользоваться понятием «валентность», которое для большинства оксидов в этом случае может быть заменено понятием «степень окисления». Каждая валентность условно обозначается черточкой (в этом смысле единице степени окисления независимо от знака соответствует валентный штрих). Число валентных штрихов должно соответствовать абсолютной величине степени окисления. Второй принцип построения графических формул заключается в том, что в большинстве молекул оксидов атомы элементов, если их больше одного, соединяются через кислород.
Графические формулы молекул гидроксидов составляют присоединением гидроксо-групп и атомов кислорода к иону металла.
Для составления графической (структурной) формулы вещества необходимо:
Определить валентность всех химических элементов, образующих вещество.
Записать знаки всех химических элементов, образующих вещество, каждый в количестве, равном числу атомов данного элемента в молекуле.
Соединить знаки химических элементов черточками. Каждая черточка обозначает электронную пару, осуществляющую связь между химическими элементами и поэтому одинаково принадлежит обоим элементам.
Число черточек, окружающих знак химического элемента, должно соответствовать валентности этого химического элемента.
При составлении формул кислородсодержащих кислот и их солей атомы водорода и атомы металлов связываются с кислотообразующим элементом через атом кислорода.
Атомы кислорода соединяют друг с другом только при составлении формул пероксидов.
3)Получение химических соединений. Важнейшие свойства химических соединений.
Хими́ческое соедине́ние — сложное вещество, состоящее из химически связанных атомов двух или более элементов (гетероядерные молекулы). Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью (азот, кислород, иод, бром, хлор, фтор, предположительно астат). Инертные (благородные) газы и атомарный водород нельзя считать химическими соединениями.
Химические соединения получают в результате химических реакций. Сложные вещества могут разлагаться с образованием нескольких других веществ. Образование химических соединений сопровождается выделением (экзотермическая реакция) или поглощением (эндотермическая реакция) энергии. Физические и химические свойства химических соединений отличаются от свойств веществ, из которых они получены. Химические соединения разделяются на неорганические и органические.
Химические соединения делят на классы: неорганические и органические.
К сложным веществам относятся, например, вода - H 2 O, молекулы которого состоят из двух атомов Водорода и одного атома Кислорода, серная кислота - H 2 SO 4, молекулы которого состоят из двух атомов водорода, одного атома Серы и четырех атомов кислорода, т.. Обычно свойства химического соединения совершенно отличны от свойств составляющих его элементов. Каждая молекула воды содержит два атома водорода и один атом кислорода, а вода по своим химическим свойствам совсем не похожа ни на водород, ни на кислород. Состав воды отражен в ее химической формуле - Н20. Таким образом, химическая формула кратко фиксирует, какие типы атомов и в каком относительном количестве входят в состав молекулы.
Очень важной характеристикой являются проявляемые физические свойства веществ
Агрегатное состояние при различных условиях, в том числе при стандартных.
Температуры кипения, плавления, замерзания, испарения.
Органолептические характеристики: цвет, запах, вкус.
Растворимость в воде и других растворителях (органических, например).
Плотность и текучесть, вязкость.
Электро- и теплопроводность, теплоемкость.
Электрическая проницаемость.
Радиоактивность.
Абсорбция и эмиссия.
Индуктивность.
К данной группе относятся все возможные виды взаимодействий рассматриваемой молекулы с другими простыми и сложными веществами. То есть это непосредственно химические реакции. Для каждого вида соединения они строго специфичны. Однако выделяют общие групповые свойства для целого класса веществ.
Особенности взаимодействия химических элементов с кислотами и щелочами
Элементы I группы главной подгруппы называются щелочными металлами. Строение их внешней электронной оболочки отражается формулой: ns1. Щелочноземельными называются кальций, стронций, барий и радий. Эти элементы располагаются во II группе главной подгруппе периодической системы. Находящийся в этой же группе магний несколько уступает им в активности, но имеет похожие свойства, поэтому его целесообразно рассматривать вместе со щелочноземельными металлами, тогда как бериллий образует катион с большой концентрацией заряда, вследствие чего его свойства резко отличаются от свойств остальных элементов группы и имеют диагональное сходство с алюминием. Строение внешней электронной оболочки элементов II группы отражается формулой: ns2. Таким образом, все эти металлы являются s-элементами.
Взаимодействие со сложными веществами
С водой щелочные и щелочноземельные металлы активно взаимодействуют, металлы подгруппы калия – с воспламенением и взрывом. При этом получаются гидроксиды соответствующих металлов и водород. Магний не растворяется в холодной воде из-за плохой растворимости Mg(OH)2, при нагревании реакция идет. При этом магний растворяется в растворе хлорида аммония, причиной чего является кислая в результате гидролиза среда раствора данной соли и тот факт, что гидроксид магния является более сильным основанием, чем гидроксид аммония.
Взаимодействие с кислотами
С кислотами-неокислителями щелочные металлы реагируют со взрывом, металлы II группы спокойно. Исключение составляют металлы, на поверхности которых образуется нерастворимая солевая пленка: Li, Mg, Ca, Sr, Ba не реагируют с ортофосфорной кислотой, Li, Mg, Ca, Sr – с плавиковой, Sr, Ba – с серной.
С кислотами-окислителями металлы I группы реагируют также излишне активно, а металлы II группы нормально, но способны максимально восстановить эти кислоты. В частности, разбавленную азотную они восстанавливают до катиона аммония, а концентрированную серную – до сероводорода.
Со щелочами в обычных условиях взаимодействия не происходит (если не считать, что попав в раствор щелочи, они прореагируют с водой).
астворимые основания реагируют с кислотами; кислотными оксидами; с некоторыми солями, если образуются газ, осадок или вода; с амфотерными оксидами и гидроксидами.
КОН + НС1  КС1 + Н2О
2КОН + SО2  К2S04 + Н2О
2КОН + СuС12 2КС1 + Сu(ОН)2 
Нерастворимые основания реагируют с кислотами, некоторыми кислотными оксидами, разлагаются при нагревании на воду и оксид металла:
Сu(ОН)2 + Н2SО4 СuSО4 + 2Н2О
Кислоты взаимодействуют с металлами, стоящими в ряду напряжений до водорода; с основными и амфотерными оксидами и гидроксидами; с солями, если при этом образуется осадок, газ или малодиссоциирующее веществом
H2SО4 +Zn  ZnSO4 + H2
Н2 SО4 + ZnО ZnSО4 + Н2О
Н2SО4 + К2СО3  К2SО4 + Н2О +СО2
5.Атом, химический элемент, молекула, количество вещества, моль.
Молекула - мельчайшая частица вещества, сохраняющая св-ва данного вещества.
Моль - кол-во вещества в граммах, численно равное атомной или молекулярной массе
Простое вещество – это вещество, состоящее из атомо одного вида
Сложное вещество – из 2 и более атомов разного вида.
АТОМ (от греч. atomos — неделимый), мельчайшая частица химического элемента, сохраняющая его свойства. В центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома; вокруг движутся электроны, образующие электронные оболочки, размеры которых (10-8 см) определяют размеры атома. Ядро атома состоит из протонов и нейтронов.
Эквивалент – реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль).
МОЛЬ - это КОЛИЧЕСТВО ВЕЩЕСТВА, равное 6,02.1023 структурных единиц данного вещества – молекул (если вещество состоит из молекул), атомов (если это атомарное вещество), ионов (если вещество является ионным соединением).
Хими́ческий элеме́нт — это совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке.
Относительная и абсолютная атомная и молярная массы.
Относительная атомная масса показывает, во сколько раз масса атома данного элемента больше 1/12 части массы атома изотопа углерода 12С, т. е. атомной единицы массы.
Относительная атомная масса является безразмерной величиной, но допускается обозначение ее величины в атомных единицах массы (а.е.м.).
Значения величин относительных атомных масс элементов приведены в периодической системе Д.И. Менделеева. Эти величины представляют собой усредненное значение массы атома какого-либо элемента с учетом существующих в природе изотопов этого элемента и их количества. Для обычных расчетов следует пользоваться округленными значениями относительных атомных масс элементов
Аналогично понятиям абсолютная масса атома и относительная атомная масса можно сформулировать понятия абсолютная масса молекулы и относительная молекулярная масса. Абсолютная масса молекулы (m)мол. – масса молекулы химического вещества, выраженная в килограммах (граммах).
Относительная молекулярная масса (Мr) (или просто молекулярная масса) – масса молекулы, выраженная в атомных единицах массы.
7.Газовые законы, закон Авогадро, уравнение Менделеева-Клапейрона. Закон сохранения массы, закон постоянства состава.
Закон сохранения массы.
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения массы является частным случаем общего закона природы – закона сохранения материи и энергии. На основании этого закона химические реакции можно отобразить с помощью химических уравнений, используя химические формулы веществ и стехиометрические коэффициенты, отражающие относительные количества (число молей) участвующих в реакции веществ.
Закон постоянства состава
Закон постоянства состава (Ж.Л. Пруст, 1801—1808гг.) — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами.
Закон Авогадро
Следствия закона
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём..
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
уравнению состояния идеального газа или Уравнения Клапейрона-Менделеева.
 
Бойля - Мариотта при постоянной температуре t°, давление, производимое данной массой газа, обратно пропорционально объему газа:

- Гей - Люссака при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре:
 . .
- Шарля: при постоянном объеме давление газа изменяется прямо пропорционально абсолютной температуре.

- Объединенный закон Бойля - Мариотта, Гей - Люссака и Шарля:
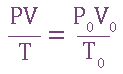
Определение молярных масс эквивалентов простых и сложных веществ, веществ в реакциях. Закон эквивалентов.
Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Эквивалентной массой называется масса 1 эквивалента вещества.
Молярный объем эквивалента представляет собой объем одного моль эквивалентов газообразного вещества при нормальных условиях.
законом эквивалентов (И. Рихтер.). массы реагирующих друг с другом веществ пропорциональны молярным массам их эквивалентов.
Закон эквивалентов можно записать в следующем виде:

Определение и основные понятия термодинамики, химическая термодинамика (термодинамическая система, фаза, компонент, энергия). Классификация и свойства термодинамических систем.
Химическая термодинамика изучает законы взаимного превращения различных видов энергии, состояние равновесия, а также возможность, направление и предел протекания самопроизвольных процессов. Вопрос о скорости протекания химических процессов термодинамика не рассматривает. Химическая термодинамика основана на трех законах (постулатах), иначе называемых началами термодинамики. Эти законы не доказываются, а являются обобщением множества опытных данных, накопленных человечеством. На основе этих законов получены многочисленные следствия, которые лежат в основе строгого описания окружающего нас мира.
Термодинамическая система – это совокупность материальных объектов, выбранных нами произвольно для изучения, которая отделена от всего окружающего (называемого внешней средой) некоторой границей (условной или реальной).
Изолированная система – это система, которая не может обмениваться с окружающей средой ни веществом, ни энергией и имеет постоянный объем.
Закрытая система – это система, которая не может обмениваться с окружающей средой веществом (т.е. имеет постоянную массу), но может обмениваться энергией (в форме теплоты или работы).
Открытая система – это система, которая может обмениваться с окружающей средой и веществом, и энергией.
Кроме того, системы могут быть гомогенными (однородными), которые состоят из одной фазы, и гетерогенными(неоднородными), состоящими из двух или более фаз.
Термодинамические параметры состояния системы – (температура, объем, давление и т.д.) – это определенные измеряемые свойства системы, характеризующие ее состояние.
Состояние системы – это совокупность термодинамических параметров системы.
Энергия – мера способности системы совершать работу.
Фаза – это гомогенная часть гетерогенной системы, имеющая одинаковый состав, физические и химические свойства, отделённая от других частей системы поверхностью, при переходе через которую свойства системы меняются скачком. Фазы бывают твёрдые, жидкие и газообразные. Гомогенная система всегда состоит из одной фазы, гетерогенная – из нескольких. По числу фаз системы классифицируются на однофазные, двухфазные, трёхфазные и т.д.
Компонент – всякое вещество, входящее в систему, которое из неё можно выделить и которое может существовать отдельно от системы. По числу компонентов системы классифицируются на однокомпонентные, двухкомпонентные, трёхкомпонентные и т.д.
10.Термохимия. Определение, термохимическое уравнение, экзо- и эндотермические процессы. Законы термохимии ( закон Лаувазье-Лапласса, закон Гесса).
|
 Скачать 489.52 Kb.
Скачать 489.52 Kb.
 имическая формула - изображение состава вещества с помощью символов химических элементов, числовых индексов и некоторых других знаков.
имическая формула - изображение состава вещества с помощью символов химических элементов, числовых индексов и некоторых других знаков.