Конспект урока ОВР. Окислительновосстановительные реакции
 Скачать 448.69 Kb. Скачать 448.69 Kb.
|
|
Выполнил Ходжаниязов Тойлы Тема: Окислительно-восстановительные реакции 8 класс Цели урока: Познакомить учащихся с новой классификацией химических реакций по признаку изменения степеней окислений элементов – окислительно-восстановительными реакциями, охарактеризовать единство и непрерывность процессов окисления и восстановления, систематизировать знания о типах химических реакций, о степени окисления химических элементов. Тип урока: комбинированный (урок + презентация). Задачи урока: Образовательная – рассмотреть сущность окислительно-восстановительных процессов, научить применять «степени окисления» для определения процессов окисления и восстановления. Научить учащихся уравнивать записи окислительно-восстановительных реакций методом электронного баланса. Воспитательная - продолжить развитие логического мышления, умения наблюдать, анализировать, сравнивать, находить причинно-следственные связи, делать выводы. Формировать основы научного мировоззрения, совершенствовать трудовые навыки, культуру межличностных отношений, умение слушать друг друга, оценивать свою работу. Методы обучения: частично-поисковый – самостоятельная работа в группах, беседа с целью ответа на поставленные проблемные вопросы, фронтальный опрос. Урок включает в себя элементы ИКТ (на протяжение всего урока используется презентация). Контроль: оценочно-стимулирующий – тестирование. Ход урока: I. Организационный момент, актуализация знаний. Проверка домашнего задания. Фронтальный опрос. Даны вещества: NaOH, MgCl2, K2CO3, AlCl3, H3PO4, K2SO4, HNO3, CuSO4, Zn(NO3)2. В формулах этих веществ определите: а) заряды ионов; б) степени окисления всех химических элементов, входящих в состав.
II. Изучение нового материала. 1. Слайд 2. Понятие ОВР. 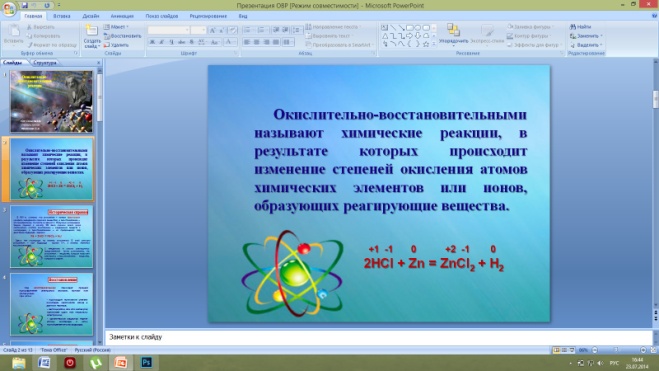 Многообразие классификаций химических реакций по различным признакам (направлению, числу и составу реагирующих и образующих веществ, использованию катализатора, тепловому эффекту) можно дополнить еще одним признаком. Этот признак – изменение степени окисления атомов химических элементов, образующих реагирующие вещества. +1 +5 -2 +1 -1 +1 -1 +1 +5 -2 AgNO3 + HCl = AgCl + HNO3 В этой реакции степени окисления атомов химических элементов после реакции не изменились. +1-1 0 +2 -1 0 2HCl +Zn = ZnCl2 + H2 А в этой реакции – взаимодействие соляной кислоты с цинком – атомы двух элементов, водорода и цинка, изменили свои степени окисления: водород с +1 на 0, а цинк – с 0 на +2. Следовательно, в этой реакции каждый атом водорода получил по одному электрону +1 0 2H + 2ē → H2 А каждый атом цинка – отдал два эектрона 0 +2 Zn - 2ē → Zn Химические реакции, в результате которых происходит изменение степеней атомов химических элементов или ионов, образующих реагирующие вещества, называют окислительно-восстановительными реакциями. 3. Слайды 5-7. Восстановление. 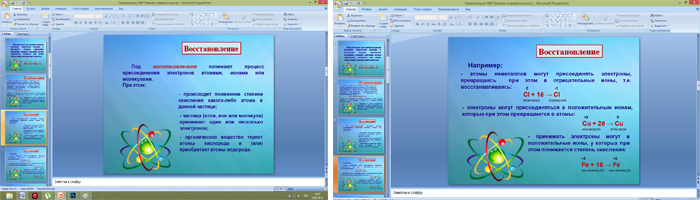 Под восстановлением понимают процесс присоединения электронов атомами, ионами или молекулами. Степень окисления при этом понижается. Например, атомы неметаллов могут присоединять электроны, превращаясь при этом в отрицательные ионы, т.е. восстанавливаясь: 0 -1 Cl + 1ē → Cl атом хлора хлорид-ион Электроны могут присоединяться и к положительным ионам, которые при этом превращаются в атомы: +2 0 Cu + 2ē → Cu ион меди (II) атом меди Принимать электроны могут и положительные ионы, у которых при этом степень окисления понижается: +3 +2 Fe + 1ē → Fе ион железа (IV) ион железа (II) Атомы, ионы или молекулы, принимающие электроны, называют окислителями. 4. Слайды 8-11. Окисление. Единство двух процессов. 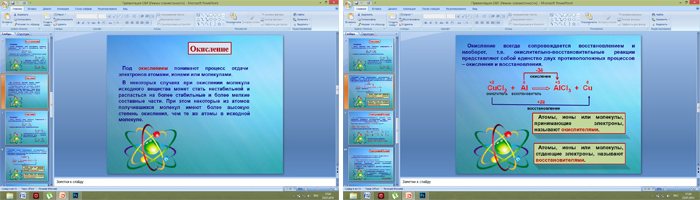 Под окислением понимают процесс отдачи электронов атомами, ионами и молекулами. Например, атомы металлов, теряя электроны, превращаются в положительные ионы, т.е. окисляются: 0 +1 Na - 1ē → Na атом натрия ион натрия Отдавать электроны могут отрицательные ионы: -1 0 Cl - 1ē → Cl хлорид ион атом хлора Терять электроны могут и некоторые положительные ионы с низшими степенями окисления: +1 +2 Cu - 1ē → Cu ион меди (I) ион меди (II) Можно отметить, что при этом степень окисления повышается. Атомы, ионы или молекулы, отдающие электроны, называются восстановителями. Окисление всегда сопровождается восстановлением и наоборот, т.е. окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления. 6. Слайд 19. Биологическое значение окислительно-восстановительных процессов.  Окислительно-восстановительные реакции являются самыми распространенными и играют большую роль в природе и технике. Они являются основой жизни на Земле. С ними связаны дыхание и обмен веществ в живых организмах, гниение и брожение, фотосинтез в зеленых частях растений и нервная деятельность человека и животных. Они лежат в основе металлургических процессов и круговорота элементов в природе. С их помощью получают аммиак, щелочи, азотную, соляную и серную кислоты и многие другие ценные продукты. Благодаря окислительно-восстановительным реакциям происходит превращение химической энергии в электрическую в гальванических и топливных элементах и аккумуляторах. Они широко используются в мероприятиях по охране природы. III. Закрепление материала. Фронтальный опрос, тест, домашнее задание.
На дом: § 43 учебника, упр. 1,3,7,8. Литература: О.С.Габриелян. Химия. 8 класс. М.Дрофа.2013. О.С.Габриелян, И.П.Воскобойникова, А.В.Яшукова. Настольная книга учителя. Химия. 8 класс. М. Дрофа. 2012. | ||||||||||||||||||||||||||||||||||||||||||||||||||
