Применение ик спектрометрии для установления структуры химических соединений
 Скачать 171.06 Kb. Скачать 171.06 Kb.
|
ПРИМЕНЕНИЕ ИК – СПЕКТРОМЕТРИИ ДЛЯ УСТАНОВЛЕНИЯ СТРУКТУРЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙПри исследовании строения органических молекул широко используется взаимодействие вещества с электромагнитным излучением в широком интервале частот. Таблица 1 - Электромагнитный спектр
Для наблюдения спектров поглощения при любых длинах волн необходимы основные элементы:
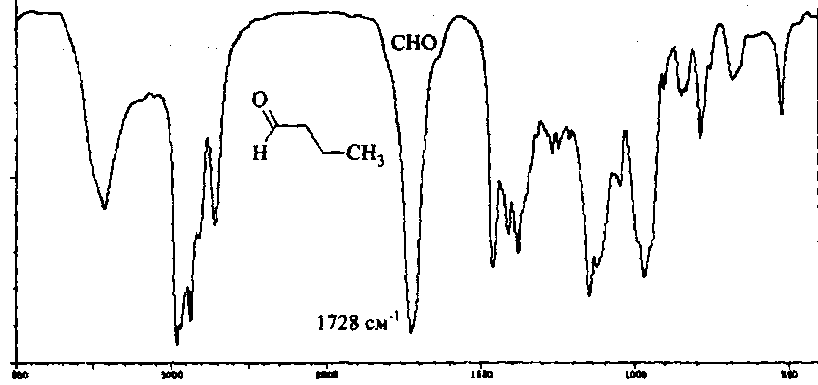
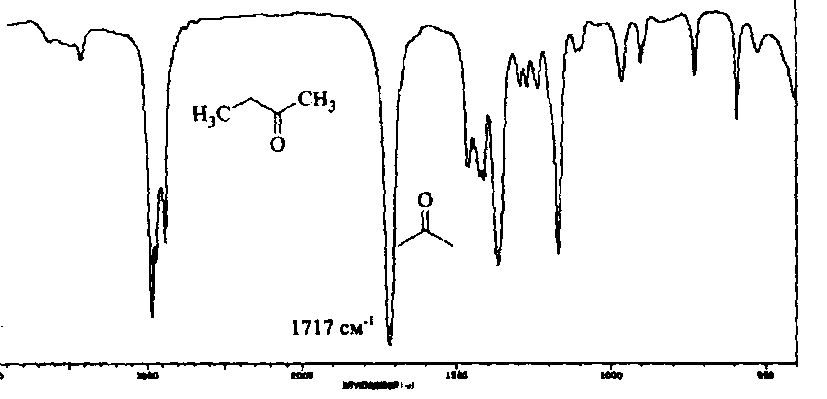
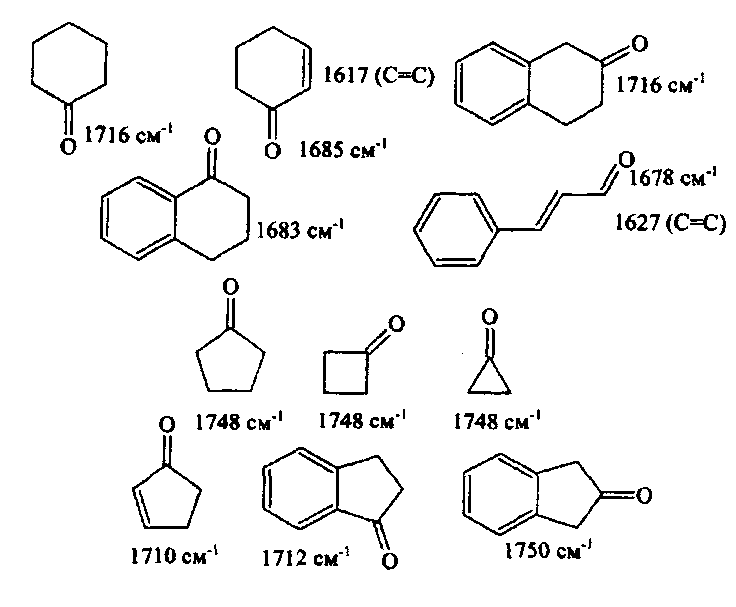
Область электромагнитного спектра, которая изучается при помощи спектральных приборов, основанных на оптическом методе разложения излучения, называется областью оптических спектров. Вращательным спектрам соответствует энергия перехода порядка 10-2 – 10-3 ккал/моль; они находятся в далекой инфракрасной и микроволновой областях. Колебательные спектры связаны с изменением колебательной энергии и для большинства молекул появляются в средней и ближней инфракрасных областях. Энергия переходов составляет 1 – 10 ккал/моль. Электронные спектры возникают в результате переходов между электронными состояниями и наблюдаются в ультрафиолетовой, видимой и ближней инфракрасной областях. Энергия переходов – более 100 ккал/моль. ИК-спектроскопияКолебательные спектры - инфракрасные (ИК) спектры поглощения и спектры комбинационного рассеяния (КР) - применяются для изучения строения молекул и для молекулярного спектрального анализа. Молекула имеет квантованные энергетические уровни. Энергия молекулы Е состоит из вращательной, колебательной и электронной энергий: Е = Е вр. + Е кол. + Е эл. Поглощение излучения вызывает изменения в энергии этих состояний, в результате чего возникают электронные, колебательные и вращательные спектры. Каждая из этих трех форм энергии квантуется, т.е. молекулы имеют набор дискретных энергетических состояний (энергетических уровней). Колебательная энергия обусловлена колебаниями атомов, составляющих молекулу, около положений равновесия. В результате переходов между уровнями колебательной энергии при одном и том же электронном состоянии (обычно основном) возникает колебательный спектр молекулы. Исследования колебаний молекулы можно проводить по спектрам поглощения в ИК области спектра и с помощью комбинационного рассеяния света. Частота поглощения света определяется соотношением vкол. = Eкол. /h = Eкол.1–Eкол.2/h где h - постоянная Планка, 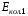 и и 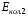 - колебательные энергетические уровни. - колебательные энергетические уровни. Полагается, что электронные и вращательные состояния не меняются. Разность энергии между двумя последовательными колебательными состояниями составляет 0,5-0,05 эВ. Переход между ними связан с поглощением кванта энергии с частотой 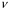 = 4000 - 100 см–1, или с длиной волны = 4000 - 100 см–1, или с длиной волны 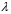 =2,5 - 100 =2,5 - 100 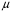 . Следовательно, этот переход относится к инфракрасной области спектра ( . Следовательно, этот переход относится к инфракрасной области спектра (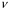 (см–1) = 104/ (см–1) = 104/ 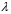 ( (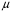 ), ), 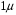 =10–6м). Если через образец пропустить ИК свет от источника сплошного излучения, то свет с частотой =10–6м). Если через образец пропустить ИК свет от источника сплошного излучения, то свет с частотой 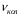 будет поглощаться, и на фоне сплошного спектра будет наблюдаться полоса поглощения с частотой будет поглощаться, и на фоне сплошного спектра будет наблюдаться полоса поглощения с частотой 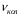 . . В общем случае нелинейная молекула, состоящая из N атомов, имеет 3N-6 основных колебательных степеней свободы (3N-5 колебательных степеней свободы для линейной молекулы). Колебания, в процессе которых изменяются лишь длины валентных связей, называются валентными. Колебания с изменением в основном валентных углов – деформационные колебания. Многие колебания сложных молекул нельзя отнести к указанным выше типам, поскольку они сопровождаются изменениями, как валентных связей, так и валентных углов. 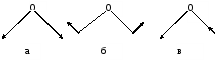 Рис. 1. - Нормальные колебания молекулы воды: а - валентное симметричное, б - деформационное симметричное, в - валентное асимметричное На рис. 1 изображены три нормальных колебания молекулы воды. Стрелками показаны относительные смещения атомов в каждом из трех колебаний, т.е. дано наглядное представление о форме колебаний. В ИК спектре активны только те колебания, при которых происходит изменение дипольного момента молекулы. В спектре КР активны колебания, приводящие к изменению дипольного момента, индуцированного возбуждающим светом. Наиболее полная информация о колебательном спектре молекулы может быть получена при сочетании обоих методов. Некоторые частоты можно привести в соответствие с колебаниями определенных атомов или групп атомов в молекуле; их принято называть характеристическими. Например, гомологический ряд моноолефинов - углеводородов, содержащих одну двойную связь между атомами углерода, характеризуется наличием поглощения при частоте в области 1650 см –1. Эта полоса поглощения связана с валентными колебаниями связи С=С. Ацетиленовые соединения имеют полосу поглощения в области 2100см –1, относящуюся к валентным колебаниям связи СС. Для высокосимметричных молекул различные колебания могут иметь одинаковые частоты, вследствие чего в спектрах таких соединений появляется вместо нескольких полос – одна – происходит вырождение. Характеристические колебания возникают при слабом взаимодействии колебания некоторой группы атомов или связей с колебаниями остальной части молекулы. В этом случае частота колебания данной группы или связи в основном зависит только от строения этой группы и характера рассматриваемой связи. Поэтому ряд различных молекул, содержащих данную группу атомов или связей, в общем случае будет характеризоваться разными колебательными спектрами, однако в каждом из них будет присутствовать одна или несколько одинаковых или почти одинаковых частот, характеристических для данной группы атомов или связей. Установление характеристических частот позволяет, не проводя никаких расчетов, определить по спектру присутствие в молекуле различных групп и связей и тем самым устанавливать строение молекулы – существование характеристических частот является основой молекулярного спектрального анализа. Обычно положение характеристической частоты изменяется внутри некоторого интервала, который определяется как внешними, так и внутренними факторами. Например, если двойная связь находится на краю цепи, то 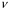 (С=С) равна 1648 см–1 . Если двойная связь находится между двумя одиночными связями (например, Н3С-СН=СН-СН3 ), то вследствие появления цис- и транс-изомерии в спектре обнаруживаются две частоты 1658 и 1674 см–1. Наличие двойной связи на краю цепи, но около разветвления (например, РСН2-HС=СН2, Р-разветвление), проявляется частотой с волновым числом, несколько более высоким, чем 1650 см–1. Двойная связь в середине цепи, но около разветвления (РСН2-HС=СН-СН2Р) характеризуется волновым числом 1668 см–1. Видно, что по значению частоты в области 1650 см–1 можно определить не только сам факт существования двойной связи, но ее положение и непосредственное окружение. (С=С) равна 1648 см–1 . Если двойная связь находится между двумя одиночными связями (например, Н3С-СН=СН-СН3 ), то вследствие появления цис- и транс-изомерии в спектре обнаруживаются две частоты 1658 и 1674 см–1. Наличие двойной связи на краю цепи, но около разветвления (например, РСН2-HС=СН2, Р-разветвление), проявляется частотой с волновым числом, несколько более высоким, чем 1650 см–1. Двойная связь в середине цепи, но около разветвления (РСН2-HС=СН-СН2Р) характеризуется волновым числом 1668 см–1. Видно, что по значению частоты в области 1650 см–1 можно определить не только сам факт существования двойной связи, но ее положение и непосредственное окружение.ИК спектры поглощения измеряются как для самих соединений, так и для их растворов. Жидкие соединения наносят в виде пленки на пластинки из материала, прозрачного в исследуемой области. Твердые вещества изучают в виде суспензии в вазелиновом масле (или запрессовывают в пластинки с KBr). Само вазелиновое масло имеет сильные полосы поглощения в области валентных и деформационных колебаний С–Н. Надо учитывать возможность взаимодействия вещества с бромидом калия. В случае раствора надо подбирать растворитель, который не имеет интенсивных полос поглощения в исследуемой области, инертен по отношению к изучаемому соединению и можно приготовить раствор концентрацией 0,1 М, 1 М. Существенное значение имеет материал кювет (обычно их готовят из кристаллов NaCl, KBr, LiF, CaF2. Характеристические частоты зависят от физического состояния образца (газ, жидкость, твердое вещество, раствор). Величина смещения полос поглощения при переходе от газа к жидкости весьма непостоянна. Она может достигать 100 см–1, но обычно меньше 25 см –1. В кристаллическом состоянии полосы поглощения становятся более узкими, часто расщепляются, могут появляться новые полосы. При кристаллизации изменяются частоты колебаний. Положение и интенсивность характеристических полос изменяются при переходе от одного растворителя к другому, что связано со специфическими и неспецифическими взаимодействиями растворителя с растворенным веществом. Изменение частот колебаний в молекулах зависит как от растворителя, так и от взаимодействующей группы. Качественный анализ по колебательным спектрамКачественный анализ по колебательным спектрам предполагает определение молекулярной структуры, молекулярного состава и идентификации неизвестных веществ. Количественное соотношение компонентов при этом не указывается, или дается оценка - много, мало, очень мало, следы. Проведение анализа сопряжено с интерпретацией ИК и КР спектров. Следует иметь в виду, что спектр содержит такое огромное количество информации, что даже самый умелый практик может пользоваться только её частью. Необходимо подчеркнуть, что не все неизвестные вещества можно идентифицировать по колебательным спектрам. Во многих случаях всё, чего можно достигнуть, - это только ориентировочно определить основные функциональные группы. Следует рассматривать спектр в целом. В нем можно выделить следующие отдельные области:
3. Область прозрачности - 1850-2700 см–1. Полосы поглощения, лежащие в этой области, сразу же становятся заметными. Их происхождение легко установить. Они могут быть обусловлены хлористоводородными солями аминов, которые имеют сложное поглощение от 2000 до 2800 см–1; группами SH 2540-2590 см–1; РН 2275-2440 см–1; -СєN 2220-2260 см–1; SiН 2090-2260 см–1; -СєС- 2100-2260 см–1; -NєС 2110-2150 см–1 и С=С=С 1950 см–1.
Качественный анализ включает и последовательный анализ спектра по корреляционным таблицам, назначение которых – подсказать возможные соединения и структуры, которые можно использовать в дальнейших интерпретациях и исследованиях спектра. Корреляционные таблицы приведены в специальных работах. Пользуясь ими, надо иметь в виду следующие ограничения:
4. Контуры и относительные интенсивности полос и линий в спектрах ИК и КР могут иметь такое же или еще большее значение, чем их частоты. Например, полоса поглощения связи С=С около 1650 см–1 резкая, и ее невозможно спутать с полосой поглощения С=О в группе С(О)NН2 (полоса амид 1), которая попадает в это же место. 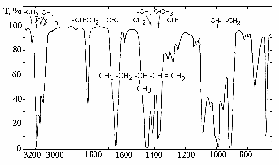 Рис. 2. - ИК-спектр 3-метилпентена-1 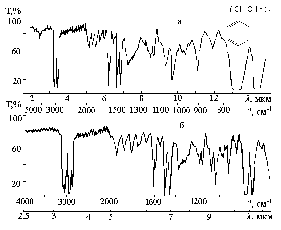 Рис. 3. - ИК спектр полистирола (пленка). Таблица 2 - Характеристические частоты поглощения некоторых групп атомов
|