Учебное пособие по клинической фармакологии. Учебное пособие для самостоятельной подготовки студентов медицинского факультета одесса 2011
 Скачать 2.42 Mb. Скачать 2.42 Mb.
|
|
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ УКРАИНЫ ОДЕССКИЙ НАЦИОНАЛЬНЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ОБЩЕЙ И КЛИНИЧЕСКОЙ ФАРМАКОЛОГИИ КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ УЧЕБНОЕ ПОСОБИЕ для самостоятельной подготовки студентов медицинского факультета ОДЕССА 2011 АВТОРЫ: В.И.Кресюн, С.Б.Стречень, А.Г.Видавская, Т.В.Трегуб, И.В.Погорелая, А.А.Полуденко ОТВЕТСТВЕННЫЙ РЕДАКТОР: член-корреспондент НАМН Украины, заслуженный деятель науки и техники Украины, доктор медицинских наук, профессор В.И.Кресюн РЕЦЕНЗЕНТ: заведующий кафедрой внутренней медицины № 2, кандидат медицинских наук, доцент В.А.Штанько Клиническая фармакология. Учебное пособие для самостоятельной подготовки студентов медицинского факультета / В.И.Кресюн, С.Б.Стречень, А.Г.Видавская, Т.В.Трегуб, И.В.Погорелая, А.А.Полуденко. – Одесса: Одесский национальный медицинский университет, 2011. - 273 с. Учебное пособие создано для самостоятельной подготовки студентов медицинского факультета к практическим занятиям по клинической фармакологии согласно плану обучения по кредитно-модульной системе и содержит теоретическую информацию по каждой из изучаемых тем. Исходя из принципов клинической фармакологии в пособии излагаются вопросы этиопатогенеза изучаемой клинической проблемы, а также основные фармакокинетические и фармакодинамические особенности изучаемых групп лекарственных средств и клинико-фармакологические подходы выбора препаратов для лечения больных. Одесский национальный медицинский университет, 2011 Предмет и задачи клинической фармакологии Клиническая фармакология как предмет рассматривает проведение максимально рациональной лекарственной терапии у конкретного больного, методологию выбора метода лечения с учетом индивидуальных особенностей организма, течения и формы заболевания, наличия сопутствующей патологии, определяет наиболее эффективные и безопасные лекарственные средства, а также их комбинации, на основе данных доказательной медицины. Основные задачи клинической фармакологии включают проведение клинических испытаний фармакологических средств и разработку методов эффективного и безопасного применения лекарств. Основными разделами клинической фармакологии являются фармакодинамика и фармакокинетика. Среди врачей хорошо известно, что действие лекарства может сильно различаться среди различных индивидуумов. Лекарства влияют на специфические таргетные молекулы, что приводит к основным и побочным фармакологическим эффектам. Процессы между введением препарата и развитием этих эффектов можно разделить на два важных компонента, каждый из которых отвечает за вариабельность действия лекарств. Совокупность эффектов фармакологического средства и механизм его действия относятся к фармакодинамическим процессам. Эти свойства лекарств определяют группу, к которой относится лекарственное средство и часто имеют важную роль в определении, является ли данная группа адекватной терапией конкретного симптома или заболевания. Фармакокинетические процессы определяют влияние организма на лекарственное средство и включают освобождение ЛР из лекарственной формы, всасывание, распределение, биотрансформацию и экскрецию. Кроме того, клиническая фармакология изучает побочные действия, особенности действия лекарств в зависимости от различных условий (возраст, заболевания, беременность), взаимодействие лекарств при их совместном применении, влияние пищи на фармакологический эффект и пр. Относительно новый раздел клинической фармакологии - фармакогенетика, предметом которой является определение генетических основ реакции организма на лекарственное средствол. 1.1. Основные принципы фармакокинетики Основные фармакокинетические параметры Концентрация лекарственного вещества (С) - это ее количество в определенном объеме крови в конкретный момент времени после введения в организм. Объем распределения препарата (Vd - volume of distribution) - характеризует степень захвата лекарственного вещества (ЛВ) тканями из плазмы крови и выражается формулой Vd = D / Co - это условный объем жидкости, который требуется для равномерного распределения введенной дозы ЛВ до концентрации, которая определяется в крови в момент исследования. Различают также понятие удельный объем распределения - это отношение объема распределения к массе тела, выражается в л/кг. Объем распределения ЛВ в известной мере определяет степень проникновения его из крови и внеклеточной жидкости в ткани, а также создание его депо в органах. Площадь под фармакокинетической кривой "концентрация - время" (AUC - area under the curve) - площадь фигуры, ограниченная фармакологической кривой и осями координат (АUC = Co / Kel). Площадь под кривой определяется объемом распределения и общим клиренсом лекарственного средства. Биодоступность (F) определяют относительным количеством ЛВ, поступающим в системный кровоток и взаимодействующим с тканевыми рецепторами. Биодоступность препарата при внесосудистом введении определяют как соотношение к его лекарственной форме для внутрисосудистого введения. Если исследуют лекарственные формы для внесосудистого и внутривенного введения в равных дозах, применяют формулу: Биоэквивалентность (сравнительная биодоступность) - это соотношение количества ЛВ, поступающего в кровь при введении его в различных лекарственных формах (или лекарственных препаратов разных фирм). Если лекарственные препараты демонстрируют схожую биодоступность, они расцениваются как биоэквивалентны. Общий клиренс препарата(Cl) - это условный объем крови или ее плазмы, который очищается от ЛВ за единицу времени. Он характеризует скорость элиминации лекарственного препарата из организма. Выражают клиренс в литрах в час или миллилитрах в 1 минуту и рассчитывают по формуле: где Сl – общий клиренс; D – доза введенного препарата; AUC – площадь под фармакокинетической кривой. Элиминация лекарств происходит в почках, печени и других органах (легкие, потовые железы, молочные железы и т.д.). Поэтому выделяют почечный, печеночный и другие виды клиренса, в сумме составляющий общий клиренс: Клиренс в различных органах зависит от скорости кровообращения в органе (Q) и коэффициента экстракции препарата органом (ER): Коэффициент экстракции зависит от количества препарата, поступающего в орган с артериальной кровью (СА) и количества препарата, который выводится из органа с венозной кровью (СV): Период полувыведения (Т1/2 или T0,5) - это фармакокинетический показатель времени, в течение которого количество ЛВ в камере или его концентрация в крови уменьшается на 50% . где Т1/2 – период полувыведения; 0,693 – коэффициент, который является логарифмом от 2; Vd - объем распределения; Сl - общий клиренс. Константа элиминации (Кel) - процент уменьшения концентрации ЛВ в крови за единицу времени. Чем больше Кel, тем быстрее ЛВ выводится из крови. Константа элиминации зависит от периода полувыведения: Период полуабсорбции (Т1/2а) - время, необходимое для всасывания половины дозы препарата из места введения в системный кровоток; пропорционален скорости абсорбции (Т1/2а = 0,693/Ка). Константа абсорбции (Ка) - характеризует скорость всасывания ЛВ в организме человека или животного. Константа абсорбции зависит от периода полувыведения: Кажущаяся начальная концентрация (С0) - концентрация, которая была бы в плазме крови при внутривенном пути введения и мгновенном распределении по органам и тканям. Равновесная концентрация (Сss) - концентрация, которая устанавливается в плазме крови при поступлении препарата в организм с постоянной скоростью. При прерывистом введении препарата через одинаковые промежутки времени в одинаковых дозах выделяют максимальную (Сmax) и минимальную (Сmin) равновесные концентрации. 1.2. Всасывание лекарственных веществ Всасывание (абсорбция) лекарственных веществ - проникновение лекарств через биологические мембраны в сосудистое русло. Скорость высвобождения из лекарственной формы из разных ЛВ неодинакова. Процесс высвобождения лимитирует скорость всасывания в тех случаях, когда лекарства даются в твердой форме. Например, высвобождение ЛВ из таблетки включает как процесс распада, так и процесс растворения. На скорость растворения влияют определенные характеристики состава лекарственной формы. При этом важны размер и форма частиц, форма кристаллов и такие добавки, как окрашивающие, разрыхляющие и суспендирующие вещества, а также производственные переменные: давление прессования, содержание влаги в таблетках и т.д. Естественно, что и степень всасывания лекарств неодинакова, поскольку на нее влияют такие факторы, как моторика желудочно-кишечного тракта (ЖКТ) и скорость прохождения. При энтеральном введении всасывание происходит главным образом в тонком кишечнике. При всасывании происходит как пассивный, так и активный энергозависимый транспорт. Для переноса веществ в ЖКТ особое значение имеют большая площадь поверхности кишечника и влияние постоянного кровотока в слизистой оболочке на градиенты концентрации между просветом кишечника и кровью. Путем диффузии и осмоса через слизистую оболочку кишечника переносятся, в частности, вода, С1 ¯, а также такие вещества, как аскорбиновая кислота, пиридоксин и рибофлавин. Поскольку клеточные мембраны содержат большое количество липидов, для диффузии через мембрану вещества должны быть в некоторой степени жирорастворимыми. Согласно теории неионной диффузии, указанным путем переносятся главным образом недиссоциированные соли слабых кислот или слабых оснований. Это необходимо учитывать при назначении лекарств, большая часть которых всасывается путем диффузии. Для переноса какого-либо вещества в соответствии с уравнением Гендерсона-Гассельбаха особое значение имеет рКа этого вещества и рН в просвете кишечника: [А¯], [ВН+] – молярные концентрации ионизированных, [НА], [В] – неионизированных форм кислоты НА и основы В; рН – кислотно-основной показатель среды; рКа – логарифм константы диссоциации соединения, количественно равный значению рН, при котором анализируемое соединение диссоциирует наполовину. Из уравнения видно, что с увеличением значения рН среды диссоциация кислот увеличивается, а оснований - уменьшается. Таким образом, факторы, влияющие на процессы всасывания ЛВ, разнообразны: растворимость вещества в липидах, степень ионизации молекулы (чем меньше ионизированная молекула, тем лучше она всасывается), перистальтика кишечника, характер и количество пищевой массы, особенности регионарного кровотока, состояние соединительной ткани, агрегантное состояние веществ, сочетание лекарственных средств. На всасывание могут влиять степень наполнения желудка, способность ЛВ в комплекс-, хелат-и ионообразоваание, а также объем, состав и вязкость секрета, степень взаимодействия с активным транспортом, проницаемость слизистой оболочки пищеварительного тракта, повреждающее действие препарата и пищевых продуктов на слизистую оболочку, воздействие на микрофлору, участвующую в метаболизме препарата. Процесс всасывания зависит также от перистальтики, местного кровообращения, наличия ферментов. Как правило, указанные факторы взаимосвязаны и обусловлены индивидуальными и возрастными особенностями больного, спецификой течения патологического процесса. Лекарства, всосавшиеся в полости рта или в прямой кишке, проходят через примыкающие капиллярные сети непосредственно в большой круг кровообращения, что позволяет устранить пресистемный метаболизм. При сублингвальном введении препарат проникает в системный кровоток через вены головы, впадающие в яремную вену. Следовательно, такие лекарства (например, нитроглицерин) не метаболизируются под действием ферментов печени или кишечника до их поступления в общий кровоток. Лекарственный препарат, введенный перорально, подвергается интенсивному метаболизму, а при всасывании в полости рта или в прямой кишке в полном объеме поступает в системный кровоток. Разные отделы ЖКТ отличаются друг от друга величиной рН секрета, свойствами поверхностного эпителия, ферментами и в результате - способностью абсорбировать различные ЛВ. Желудочный сок человека имеет в норме рН 1-3, содержимое двенадцатиперстной кишки достигает рН 6-8, а содержимое тонкой и толстой кишок рН около 8. Поэтому препараты-кислоты лучше всасываются в желудке, а лекарства-основания - в кишечнике. Небольшие нейтральные молекулы, например спирта и воды, хорошо всасываются в желудке. Кислая среда желудка, кроме влияния на степень ионизации ЛВ, может вызвать их химическое разрушение (например, бензилпенициллин). При внутримышечном введении водных растворов гидрофильных препаратов наблюдается их быстрое всасывание в кровь. Из масляных растворов липофильные препараты всасываются медленнее, образуя в мышцах депо. Быстрое всасывание наблюдается при введении препарата в мышцы бедра, чем при инъекции в мышцы ягодицы. Всасывание через кожу используется для создания не только местного, но и системного эффектов. При подкожной инъекции лекарства, растворяясь в тканевой жидкости, всасываются в капилляры и лимфатические сосуды дерми. Путем ингаляции могут вводиться ЛВ в виде аэрозолей, газов и порошков. В легких всасываются газообразные и летучие вещества, используемые для наркоза (эфир, хлороформ, азота закись, фторотан и др.). Основным показателем всасывания является биодоступность - относительное количество ЛВ, которая достигает системного кровотока. Кроме свойств самого вещества, на биологическую доступность могут влиять технология изготовления лекарственной формы, взаимодействие с пищей и другие условия. Биодоступность препарата после внутривенного введения всегда равна 100%. Поэтому на практике биодоступность при одинаковых дозах лекарственного препарата определяют по формуле: где AUC – площадь под кинетической кривой «концентрация–время» (area under the curve). Также выделяют сравнительную биодоступность (биоэквивалентность) - показатель сравнения биодоступности двух лекарственных форм одного лекарственного средства. Например, различные лекарственные формы: таблетки, капсулы, раствор одного и того же соединения могут отличаться по биодоступности. 1.3. Распределение лекарственных веществ Распределение лекарственных веществ - движение вещества от места всасывания до места действия и, далее, до места элиминации. Степень тканевой проницаемости для лекарственных средств зависит от ряда факторов: величины концентрации препарата в крови, степени их связывания с белками плазмы, межклеточных пространств и цитоплазмы клеток-мишеней, скорости проникновения через различные биомембраны, скорости кровотока в тканях, наличие тех или иных патологий, изменяющих эти показатели (уровень или структуры сывороточных и тканевых белков, с которыми связываются данные лекарства, мембранной проницаемости, кровотока в месте инфекции и т. д.). 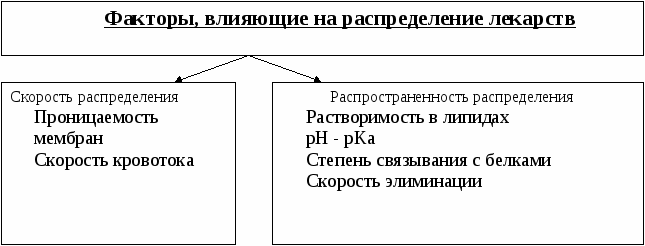 Физико-химические свойства препарата (молекулярная масса, уровень ионизации и полярности, растворимость в воде и липидах) влияют на его прохождение через мембраны, а следовательно, и на распределение. На величину распределения влияют и физиологические факторы - возраст, пол, общее количество жира в организме. Кроме того, распределение изменяется при некоторых патологических состояниях, особенно при заболеваниях печени, почек, сердечно-сосудистой системы и др. Основным показателем распределения является объем распределения (Vd - volume of distribution) - объем жидкости, в котором растворяется лекарственное средство с концентрацией, равной его концентрации в плазме крови. При сосудистом введении величина Vd не может быть меньше объема крови и при значениях Vd около 5% от объема организма уместно предположить, что распределение вещества ограничивается объемом кровяного русла. Величины Vd, в пределах 15-30%, свидетельствуют об объемном распределении препарата во внеклеточной жидкости, а Vd = 50-60% - во всей водной фазе организма. Если же величина Vd превышает реальный объем организма, то следует предположить, что происходит кумуляция вещества внесосудистым руслом. В клинической практике Vd используется для расчета нагрузочной дозы, необходимой для достижения необходимой концентрации препарата в крови: D = Vd • C где D - доза; Vd - объем распределения; C - необходимая концентрация. Распределение лекарств тесно связано с проникновением лекарств через биологические барьеры организма: гематоэнцефалический, плацентарный, гематоофтальмический, тестикулярный. ГЭБ образуют непрерывный эндотелий капилляров, клетки которого соединены обширными плотными контактами, которые, почти полностью перекрывают щели и очень плотная базальная мембрана, окружающая капилляры. Проницаемость мозговых оболочек повышена в раннем детском и старческом возрасте, при остром воспалительном процессе, снижена - при образовании капсулы фибрина вокруг абсцесса мозга. Отмечают высокие концентрации как в ткани мозга, так и в гнойном содержимом абсцессов високолипофильних препаратов, слабо связывающихся с сывороточными белками, а также лекарств с низкой молекулярной массой (левомицетин, метронидазол, клиндамицин, фузидиевая кислота) . В норме лекарства сравнительно плохо проникают в глубокие слои глаза. Даже при местном применении, когда концентрация в тканях глаза выше, чем при парентеральном введении, определить препарат, например, в стекловидном теле не всегда удается. В проникновении препаратов через плевру играют роль разные факторы: связывание с белками крови, молекулярная масса лекарств, их липофильность, связывание с рецепторами клеточных мембран. Как известно, в норме кровь матери и плода не смешивается, между ними существует плацентарный барьер. Механизмы трансплацентарного переноса аналогичны механизмам проникновения через другие барьеры - пассивный транспорт, облегченная диффузия, активный транспорт, эндоцитоз; некоторые низкомолекулярные вещества могут проходить через водные поры в плаценте. Гидрофильные и ионизированные молекулы лекарства очень слабо проникают через плаценту. Множество нейтральных веществ, слабые кислоты или основания в большей или меньшей мере проходят через плаценту, вызывая у плода эмбриотоксическое или специфическое фармакологическое действие. Белки плазмы крови имеют специфическую структуру и своими активными группами могут связываться с лекарствами. Скорость, степень и прочность связывания зависят от конформации и комплементарности этих центров и характера химических связей, возникающих при взаимодействии. Только несвязанные вещества могут диффундировать в ткани, поскольку комплекс белок-лекарства не способен пройти через мембрану клетки. Степень связывания белков с лекарствами зависит от следующих факторов: 1) количества различных типов, связывающие макромолекулы; 2) концентрации макромолекул каждого типа; 3) способности связывать или «родства» активного центра белка и лекарственного препарата; 4) наличие конкурирующих химических соединений экзогенного характера; 5) физико-химического состояния крови: рН, температуры, ионного состава, вязкости, осмотического давления. Ряд тканевых структур способны активно связывать определенные химические вещества. Например, ткань щитовидной железы накапливает соединения меди, костная ткань - тетрациклин и т. д. Уменьшение количества белков плазмы, связывающих лекарства на 10-15% наблюдается при старении. Это обеспечивает увеличение концентрации в плазме лекарственных препаратов при стандартной дозе и развитие побочных эффектов. Связывание лекарственных средств с белками крови нарушается при некоторых заболеваниях (ожоги, нефротический синдром, хронические заболевания печени, множественная миелома). |
