|
ВАРИАНТЫ КОНТРОЛЬНЫХ ЗАДАНИЙ
Вариант 1
Рассчитайте тепловой эффект реакции окисления оксида мышьяка озоном, протекающей по уравнению: 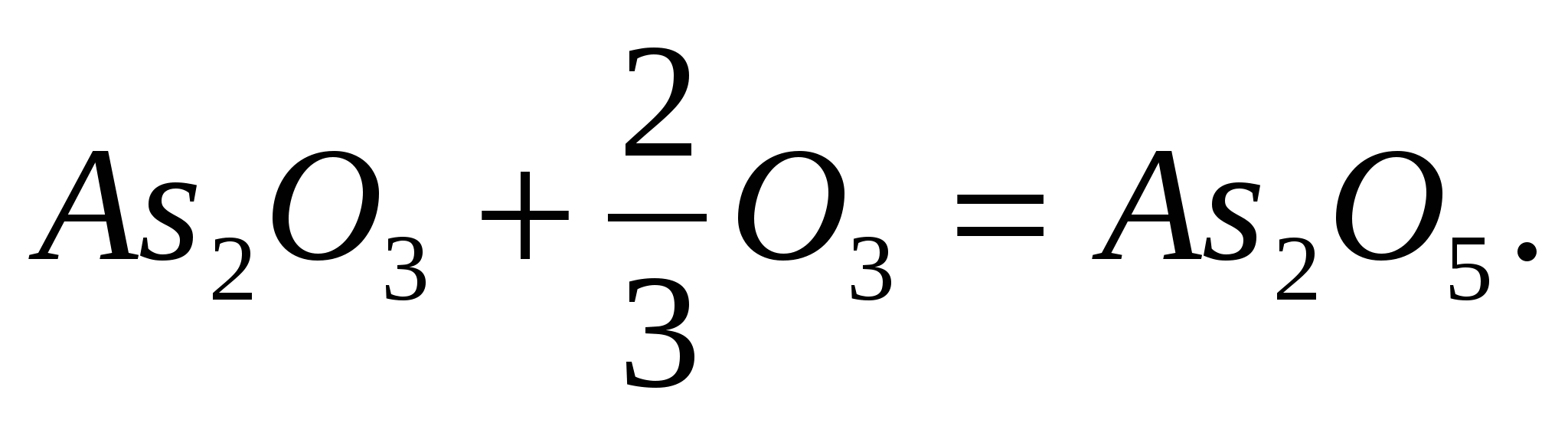
Дайте мотивированный ответ на вопрос, в каком состоянии при одной и той же температуре энтропия вещества больше: в газообразном или кристаллическом?
Напишите выражение для скорости химической реакции, протекающей в гомогенной системе по уравнению  и определите, во сколько раз увеличится скорость этой реакции, если: а) концентрация вещества А увеличится в 2 раза; б) концентрация вещества В увеличится в 2 раза; в) концентрация обоих веществ увеличится в 2 раза. и определите, во сколько раз увеличится скорость этой реакции, если: а) концентрация вещества А увеличится в 2 раза; б) концентрация вещества В увеличится в 2 раза; в) концентрация обоих веществ увеличится в 2 раза.
Напишите выражение для константы равновесия следующих обратимых процессов: а) 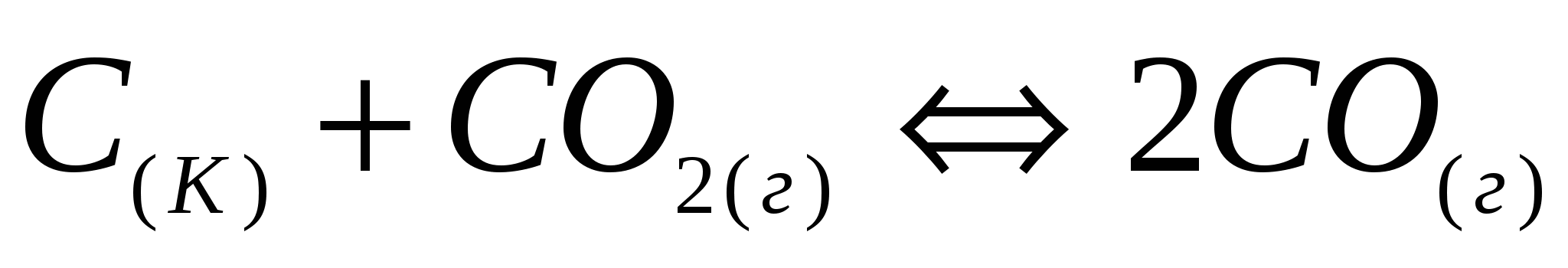 б) б) 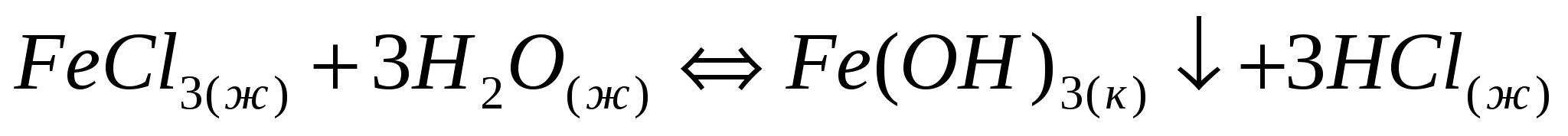 . .
Какой объем 8%-ного раствора соли плотностью 1,15 г/см3 надо прибавить к ее 3%-ному раствору плотностью 1,08 г/см3 объемом 1 л, чтобы получить 5%-ный раствор карбоната натрия?
Составьте молекулярные и ионные уравнения реакций, протекающих при смешивании растворов: а) и и 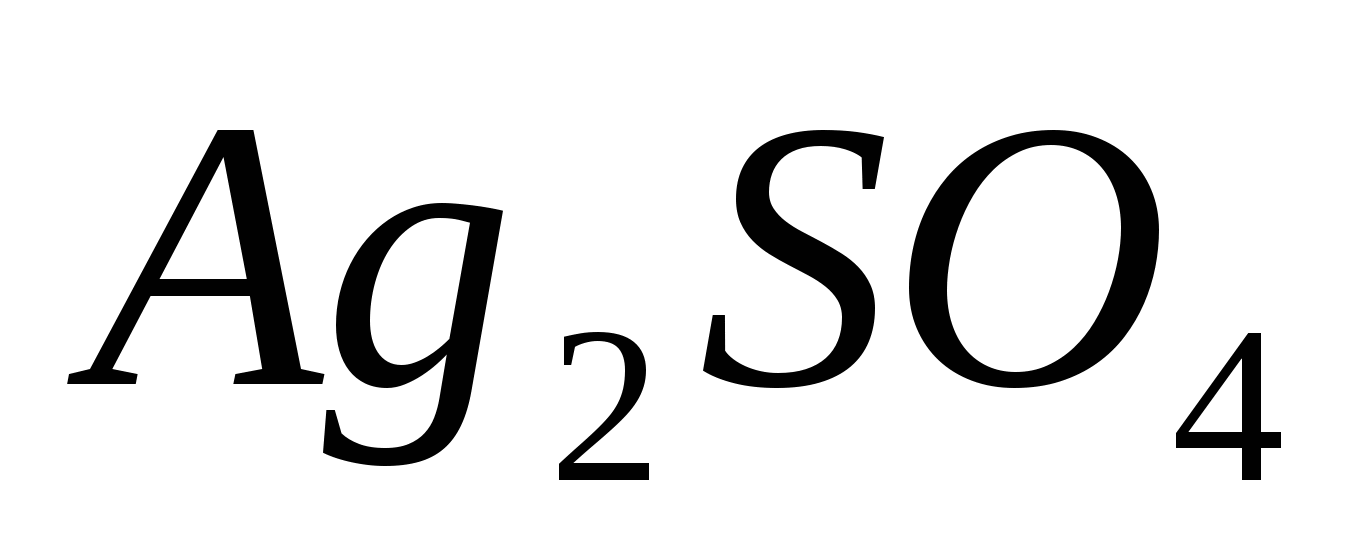 ; б) ; б) 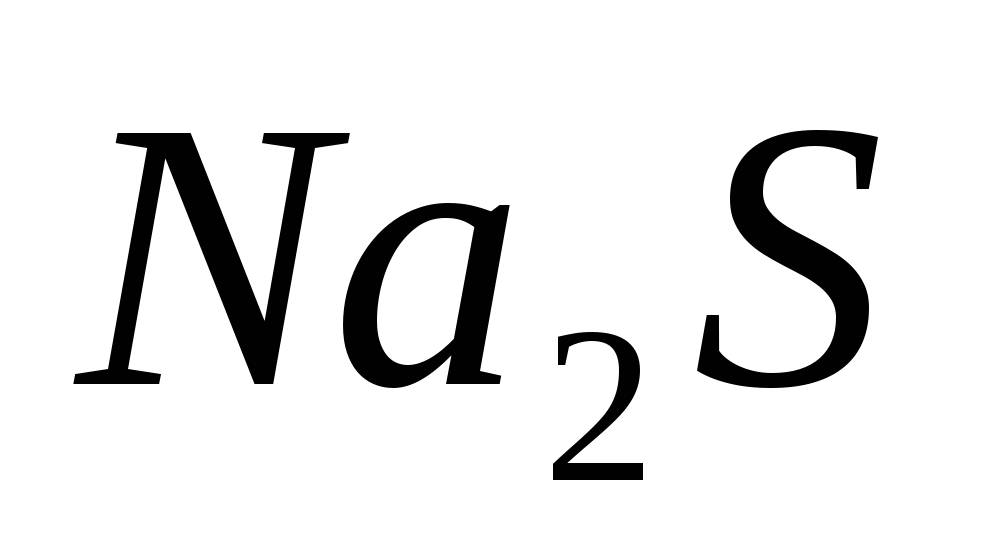 и и 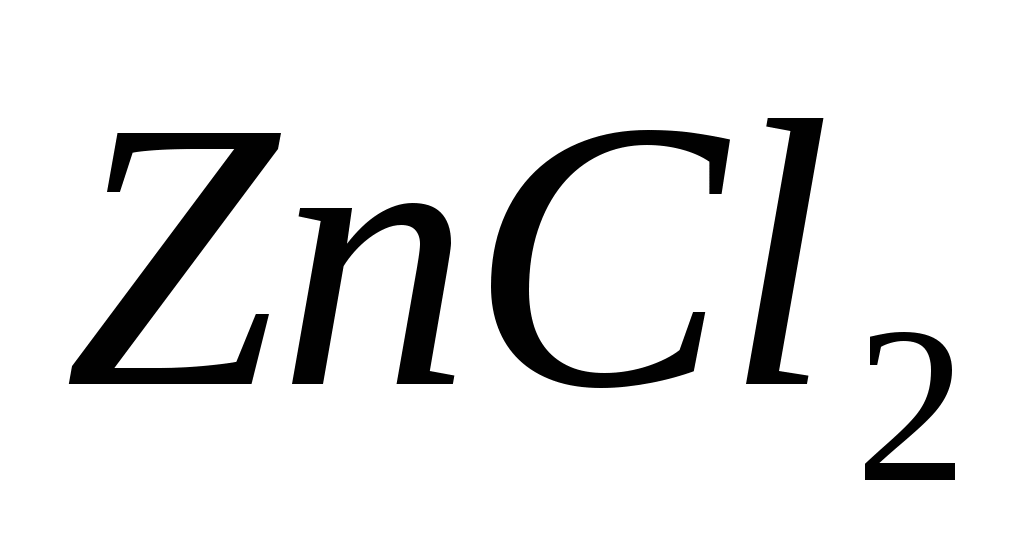 ; в) ; в)  и и 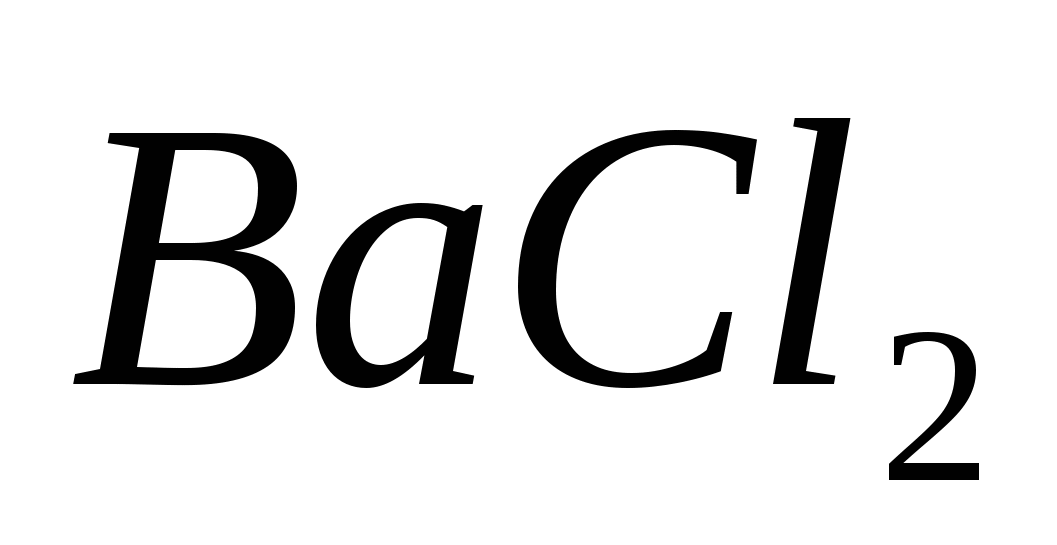 . .
Вычислите осмотическое давление раствора при 25ºС, в 1,5 л которого содержится 22,5 мг сахара  (М=342). (М=342).
Составьте уравнения электролитической диссоциации следующих электролитов: 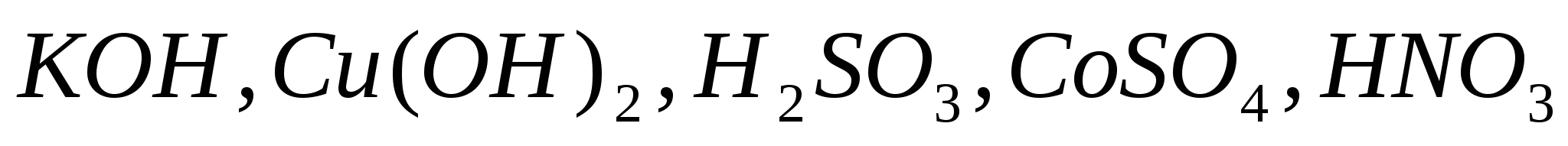 . Запишите выражения констант равновесия для слабых электролитов. . Запишите выражения констант равновесия для слабых электролитов.
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей:  и и  . Укажите рН среды. . Укажите рН среды.
Вариант 2
Вычислите тепловой эффект реакции взаимодействия металлического натрия с водой.
Вычислите 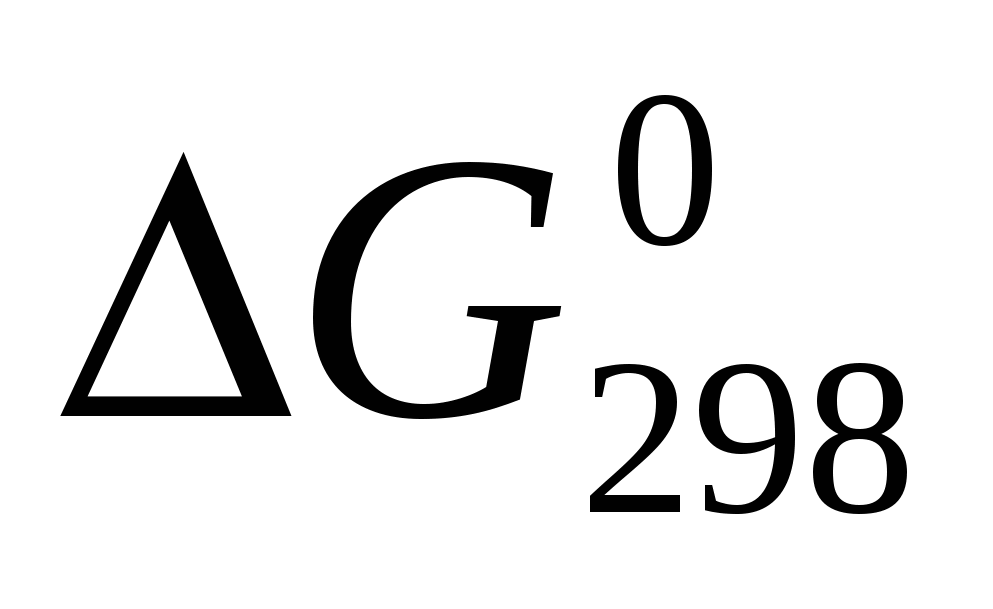 реакции, протекающей по уравнению, используя значения стандартных теплот образования и абсолютных стандартных энтропий веществ: реакции, протекающей по уравнению, используя значения стандартных теплот образования и абсолютных стандартных энтропий веществ: 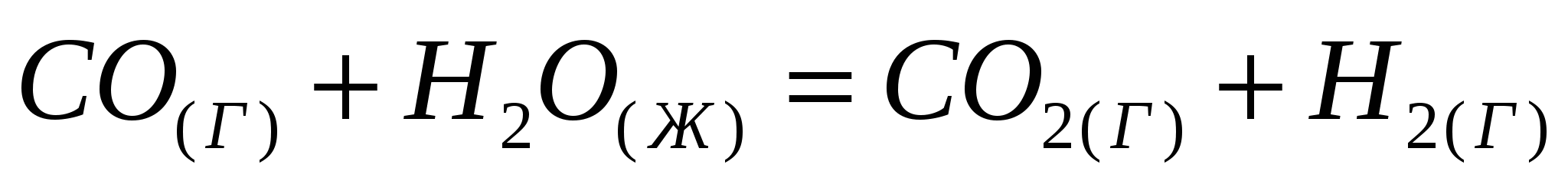 . .
Во сколько раз следует увеличить концентрацию оксида углерода (׀׀) в системе 2СО = СО2 + С, чтобы скорость реакции увеличилась в 4 раза?
При синтезе аммиака равновесие установилось при следующих равновесных концентрациях веществ: [N2]=2.5, [H2]=1.8, [NH3]=3.6 моль/л. Рассчитайте значение константы равновесия и исходные концентрации.
Какой объем 0,6 н. раствора нужно прибавить к 750 мл 0,2н. раствора, чтобы получить 0,3н. раствор?
Напишите ионно-молекулярные уравнения реакций:
 ; ; 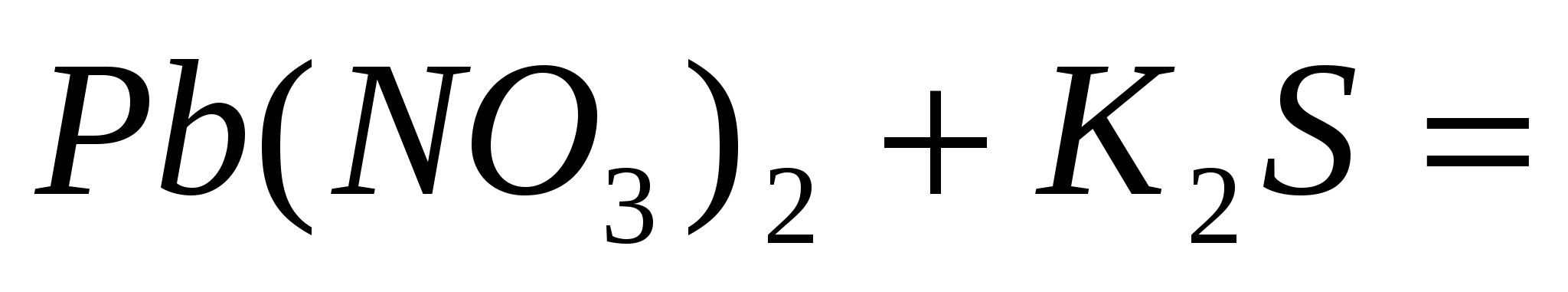 ; ; 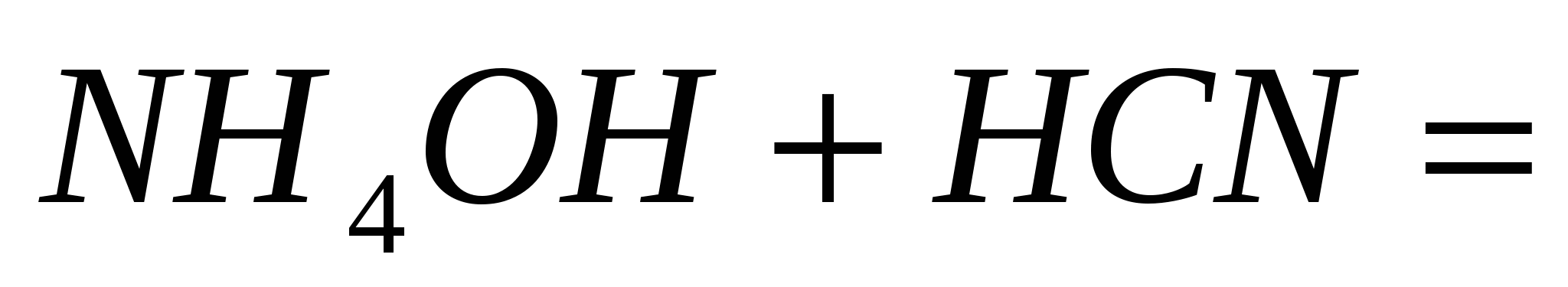 . .
Вычислите давление пара воды над 10%-ным раствором сахара  при 100ºС. при 100ºС.
Вычислите концентрацию анионов 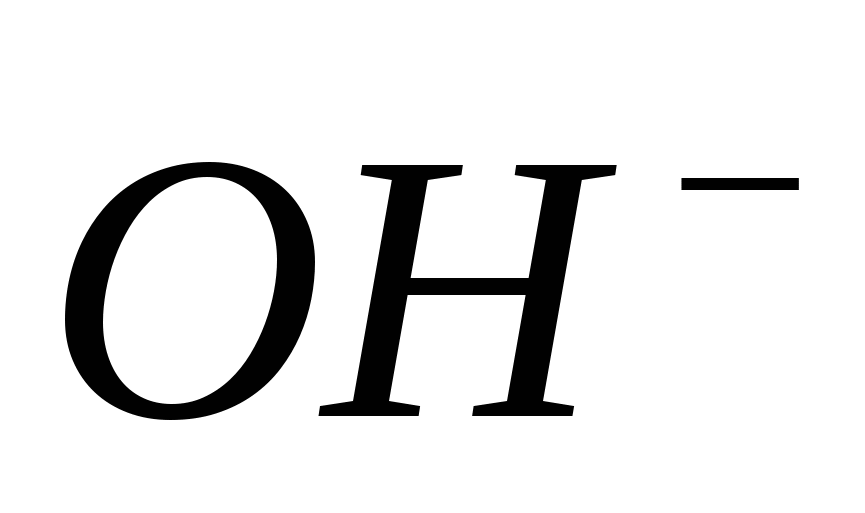 , если концентрация катионов водорода (моль/л) составляет: а) 2·10-9; б) 1·10-5; в) 0,5·10-6; г) 3,5·10-3. , если концентрация катионов водорода (моль/л) составляет: а) 2·10-9; б) 1·10-5; в) 0,5·10-6; г) 3,5·10-3.
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: 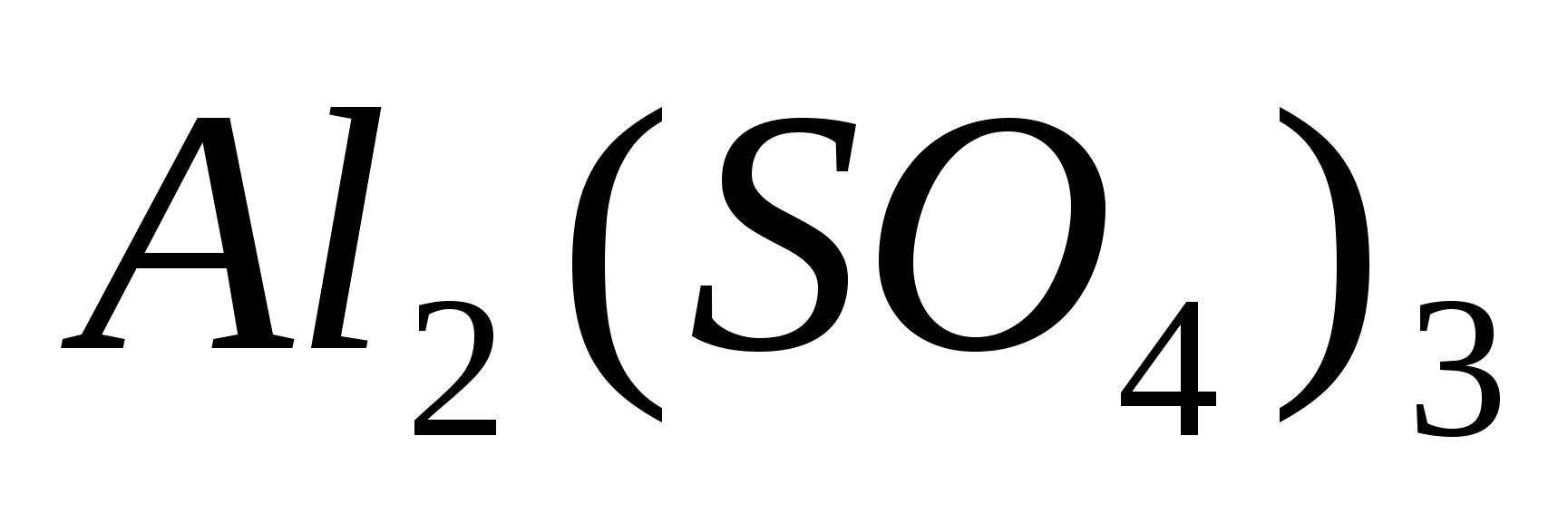 и и 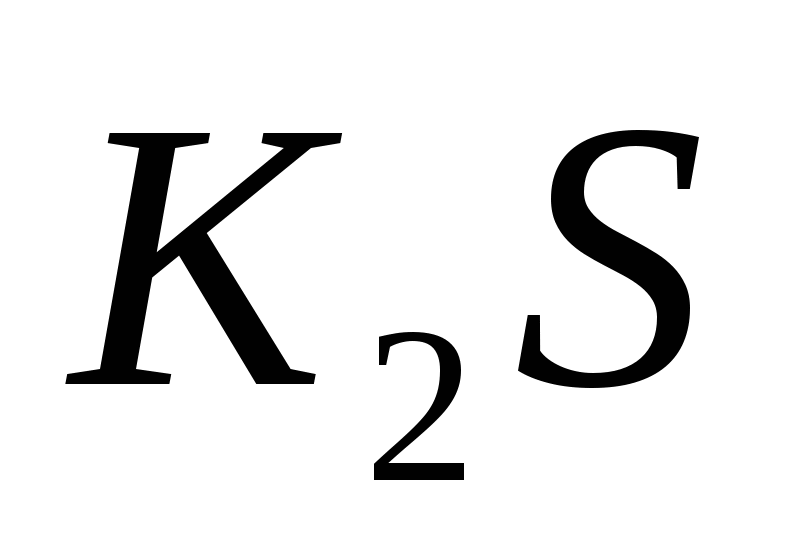 . Укажите рН среды. . Укажите рН среды.
Вариант 3.
Определите стандартное изменение энтальпии реакции горения этана
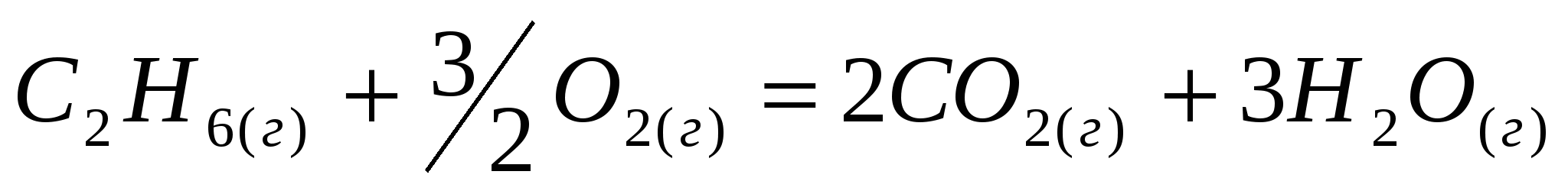 , ,
используя значения энтальпий образования исходных веществ и про- дуктов реакций.
Вычислите 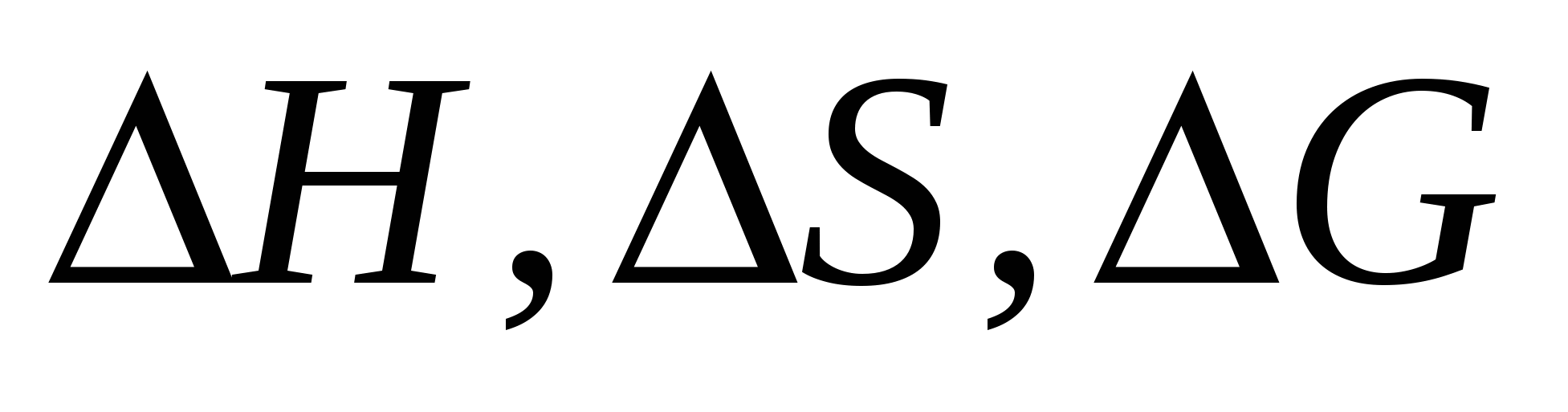 реакции восстановления реакции восстановления 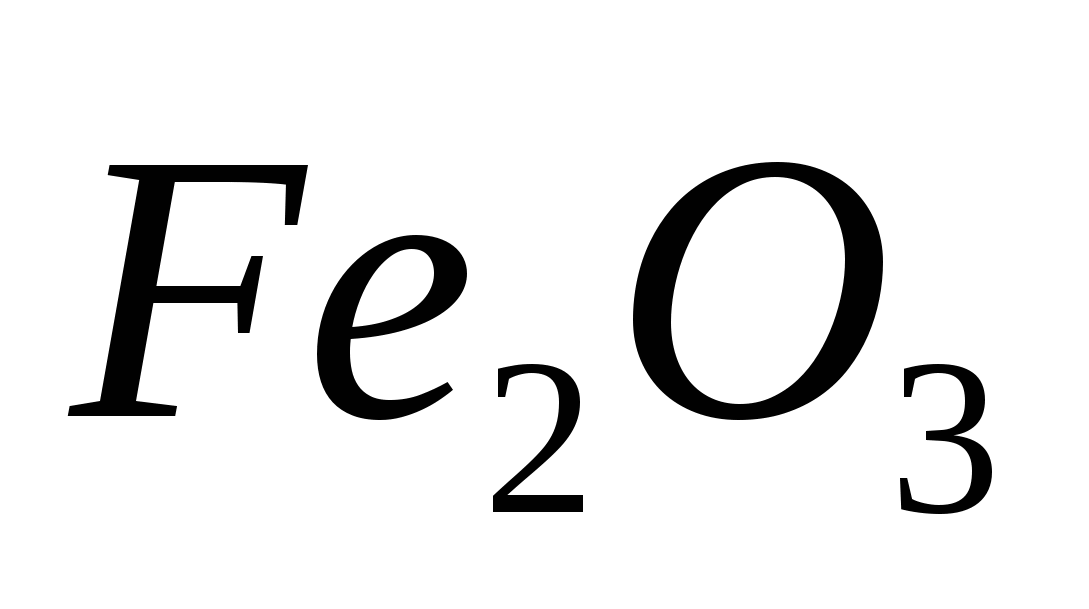 углеродом: углеродом: 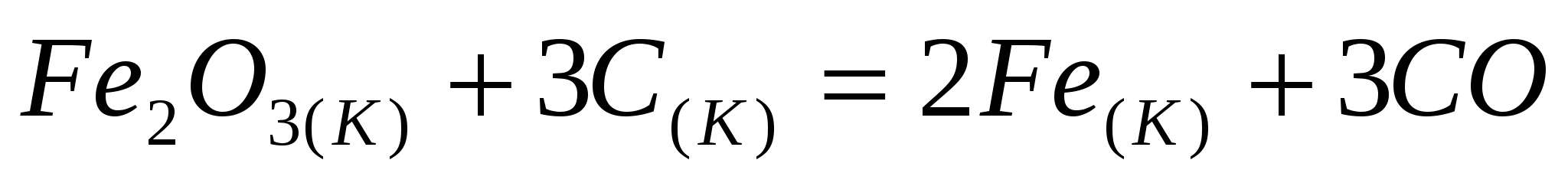 при стандартных условиях. Возможна ли эта реакция при 800 К? при стандартных условиях. Возможна ли эта реакция при 800 К?
Во сколько раз следует увеличить давление, чтобы скорость образования NO2 по реакции 2NO +O2 ↔ 2NO2, возросла в 1000 раз?
Как повлияет повышение давления и температуры на равновесие следующих обратимых реакций:
а) 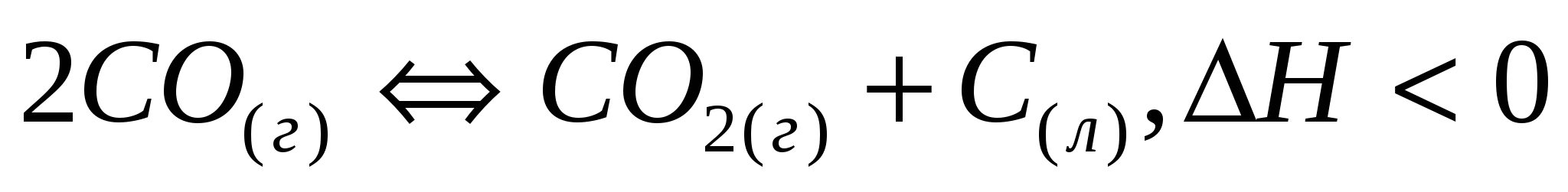 ; б) ; б) 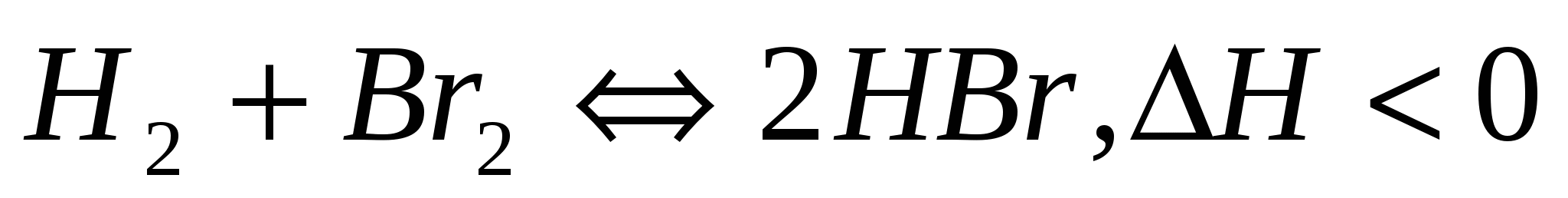
в) 
В какой массе воды следует растворить 50 мл хлорида калия для получения раствора, в котором массовая доля KCl равна 7,5 %?
Составьте молекулярные уравнения по ионно-молекулярным: 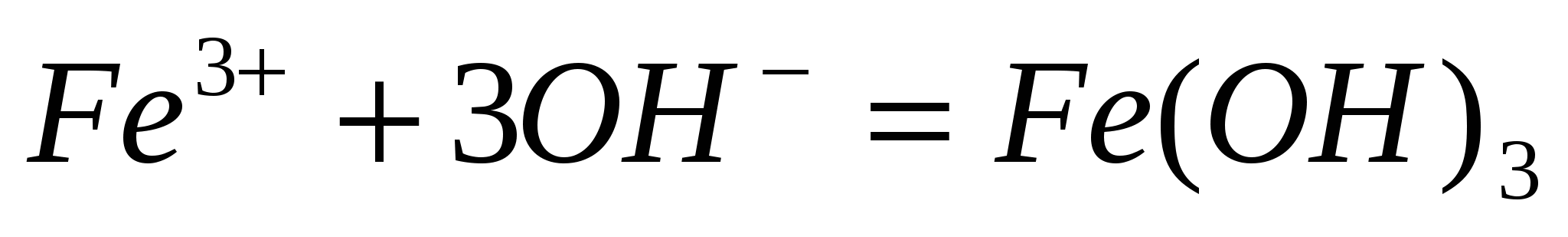 ; ; 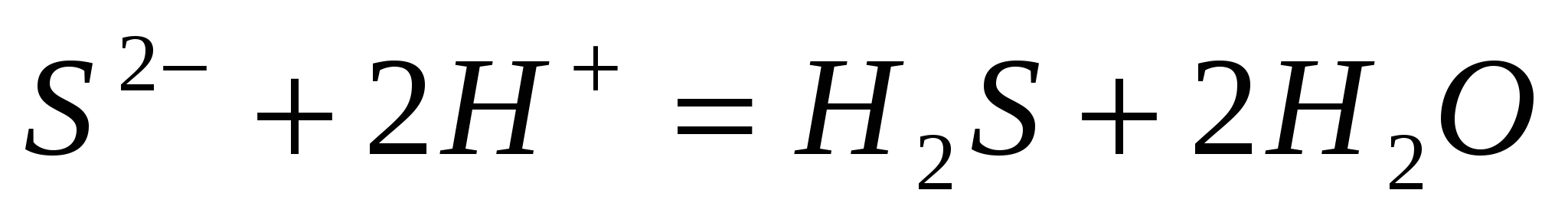
Вычислите температуру кипения 5%-ного раствора сахара  в воде. Эбуллиоскопическая константа воды равна 0,52 0. в воде. Эбуллиоскопическая константа воды равна 0,52 0.
Составьте уравнения электролитической диссоциации электролитов 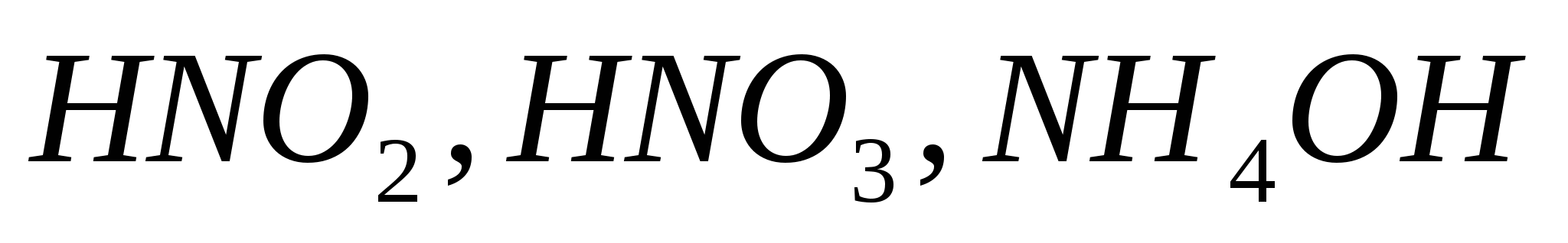 . Объясните, какой из них легче распадается на ионы и почему. Запишите выражение для константы равновесия слабых электролитов. . Объясните, какой из них легче распадается на ионы и почему. Запишите выражение для константы равновесия слабых электролитов.
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей:  и и 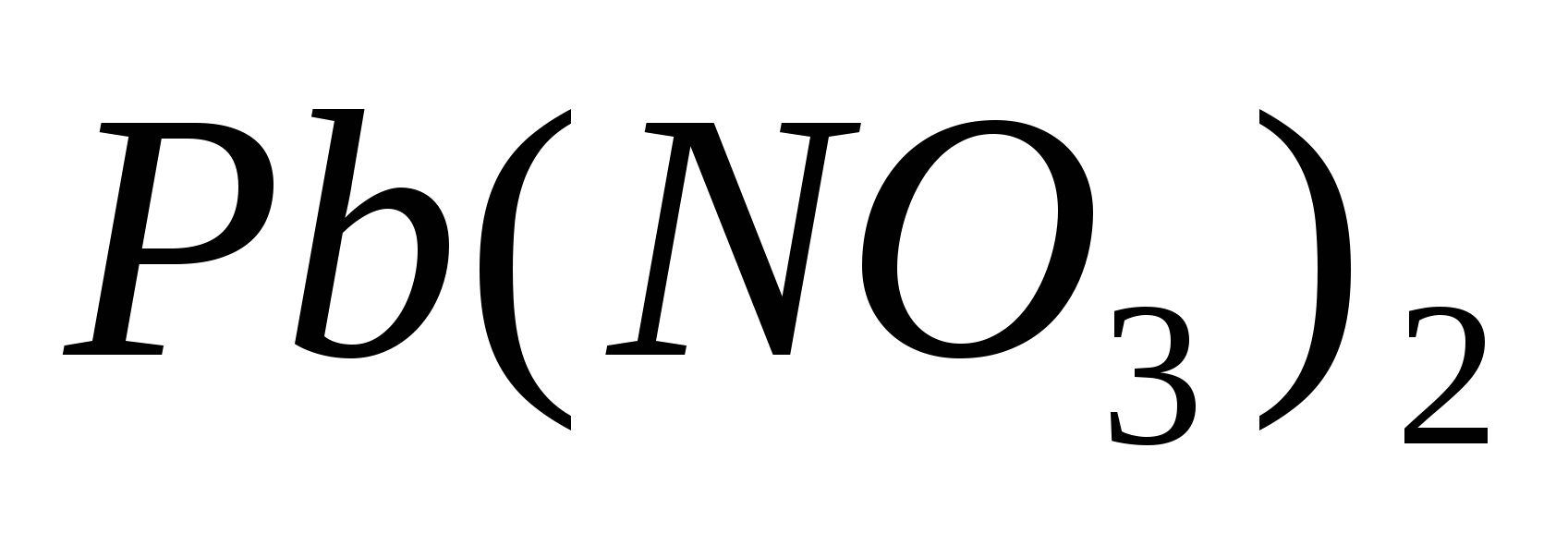 . Укажите рН среды. . Укажите рН среды.
Вариант 4.
Вычислите изменение энтальпии следующих процессов:
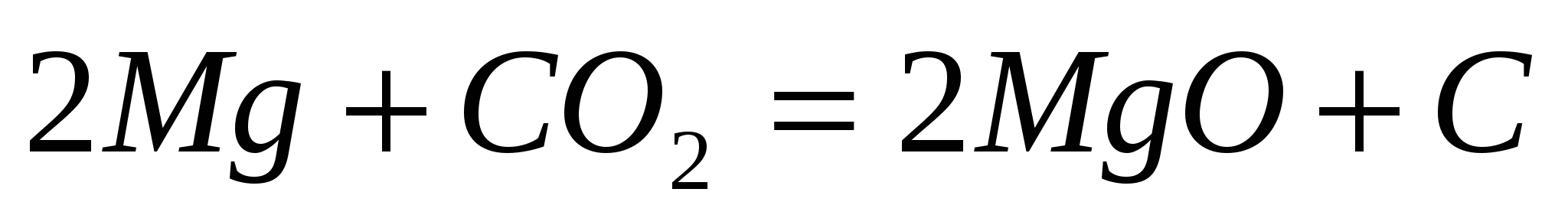 ; ;  . .
Реакция горения ацетилена идет по уравнению: 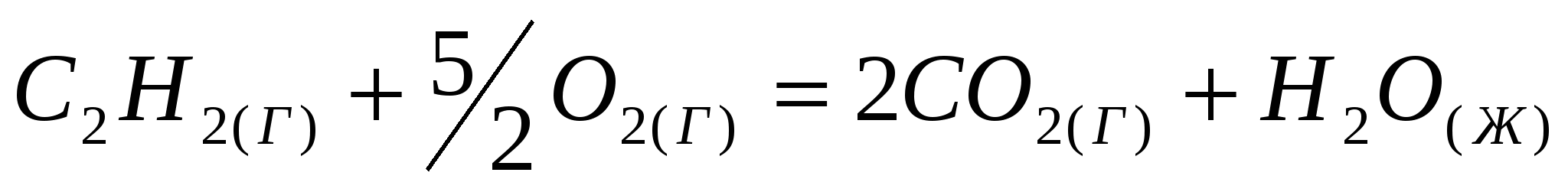 . Вычислите . Вычислите  , объясните уменьшение энтропии в результате этой реакции. , объясните уменьшение энтропии в результате этой реакции.
Напишите выражение для скорости реакции С + О2 =СО2 и определите, во сколько раз увеличится ее скорость при увеличении концентрации кислорода в 3 раза.
Используя справочные данные (табл. термодинамических данных), определите, в какую сторону произойдет смещение равновесия гомогенной реакции: 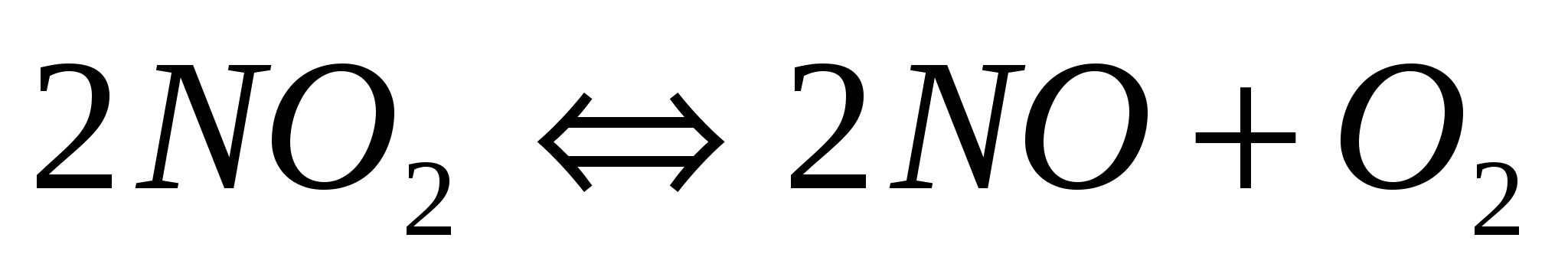
при следующих воздействиях: а) охлаждение системы;
б) увеличение давления.
Какая масса HCl содержится в 0,25 л раствора соляной кислоты с массовой долей 10,52% (плотность раствора равна 1,050 г/см3)?
Выразите ионными и молекулярными уравнениями следующие процессы: а) растворение гидроксида цинка в серной кислоте; б) действие щелочи на раствор сульфата меди.
В 250 мл раствора содержится 17 мг растворенного вещества. Осмотическое давление раствора при 27ºС равно 1,84 кПа. Вычислите молекулярную массу вещества.
Составьте уравнения электролитической диссоциации для слабых электролитов: угольной кислоты, ортофосфорной кислоты, сернистой кислоты, уксусной кислоты. Запишите выражения для констант равновесия первых ступеней диссоциации.
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: 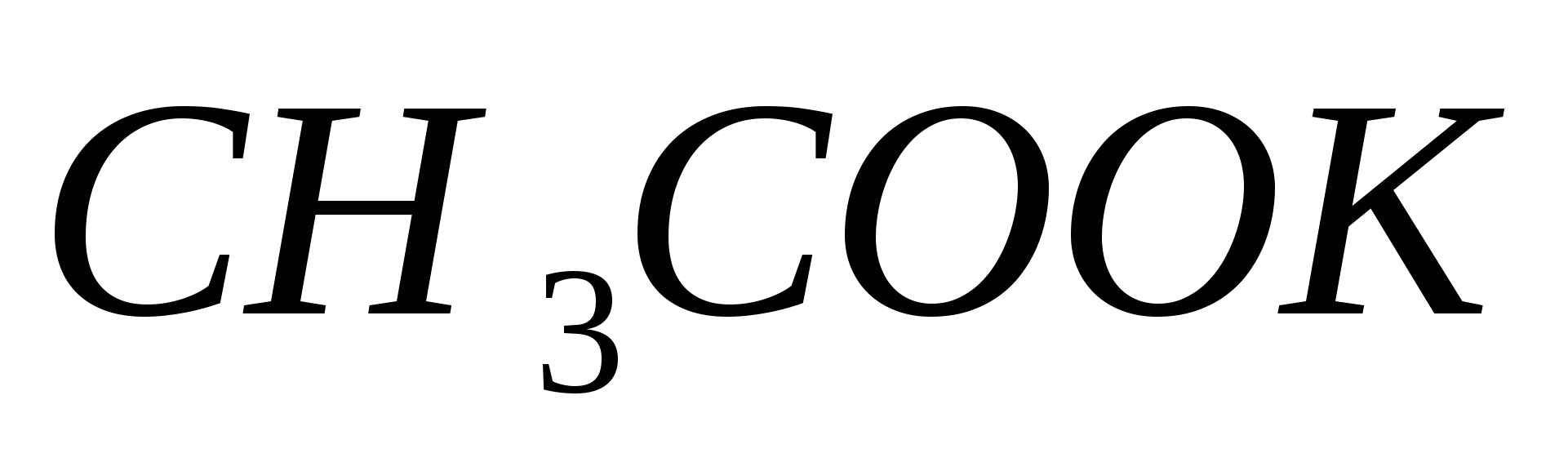 и и  . Укажите рН среды. . Укажите рН среды.
Вариант 5.
Исходя из теплоты образования воды и теплового эффекта реакции  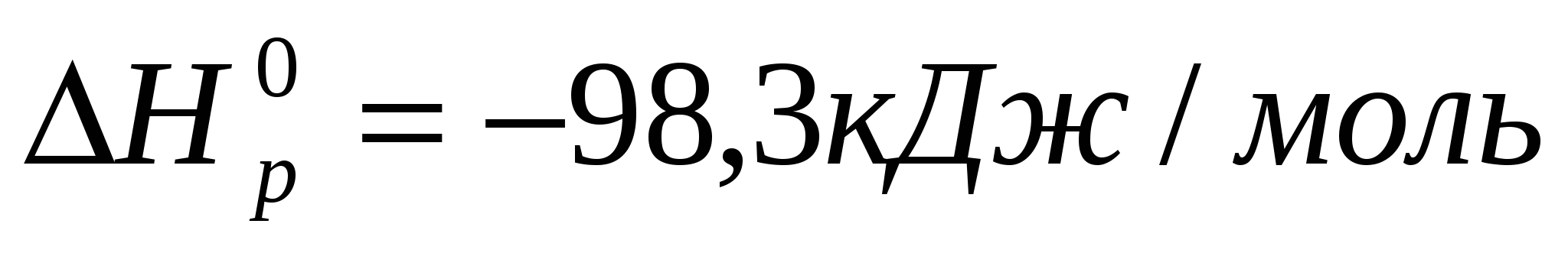
вычислите теплоту образования 
Вычислите 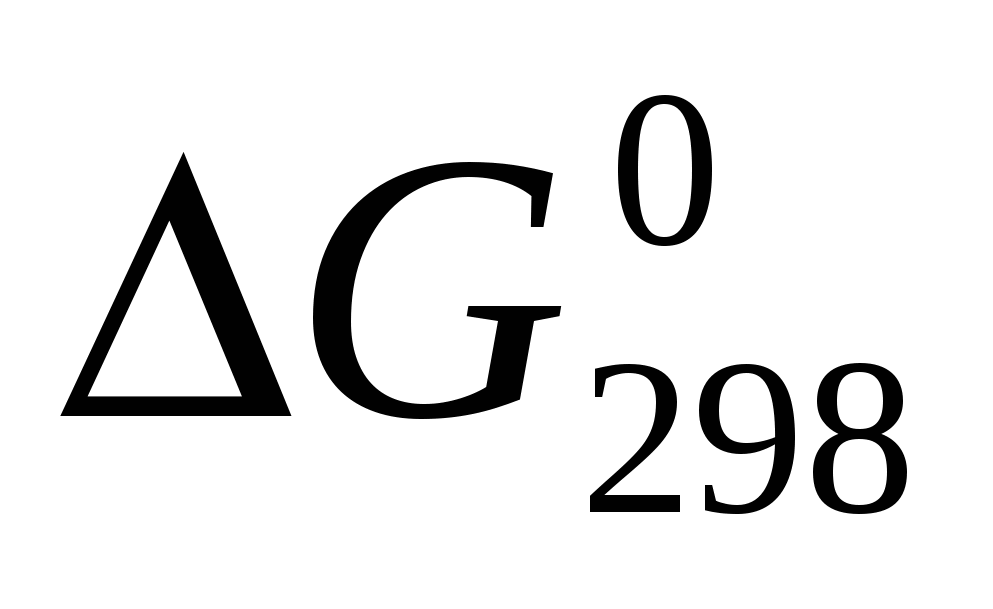 реакции, протекающей по уравнению, используя значения стандартных теплот образования и абсолютных стандартных энтропий веществ: реакции, протекающей по уравнению, используя значения стандартных теплот образования и абсолютных стандартных энтропий веществ:  . .
Реакция между оксидом азота (׀׀) и хлором протекает по уравнению 2NO + Cl2 ↔ 2NOCl. Как изменится скорость реакции при увеличении: а) концентрации оксида азота в 2 раза; б) концентрации хлора в 2 раза; в) концентрации обоих веществ в 2 раза?
Константа равновесия для реакции  равна 36, а начальные концентрации водорода и иода равны по 0,02 моль/л. Вычислить равновесные концентрации водорода, иода и иодоводорода. равна 36, а начальные концентрации водорода и иода равны по 0,02 моль/л. Вычислить равновесные концентрации водорода, иода и иодоводорода.
В растворе объемом 1,5 л содержится карбонат натрия массой 12,5 г. Чему равна молярная концентрация эквивалента этого раствора?
Составьте молекулярные уравнения реакций, представленных следующими ионными уравнениями: 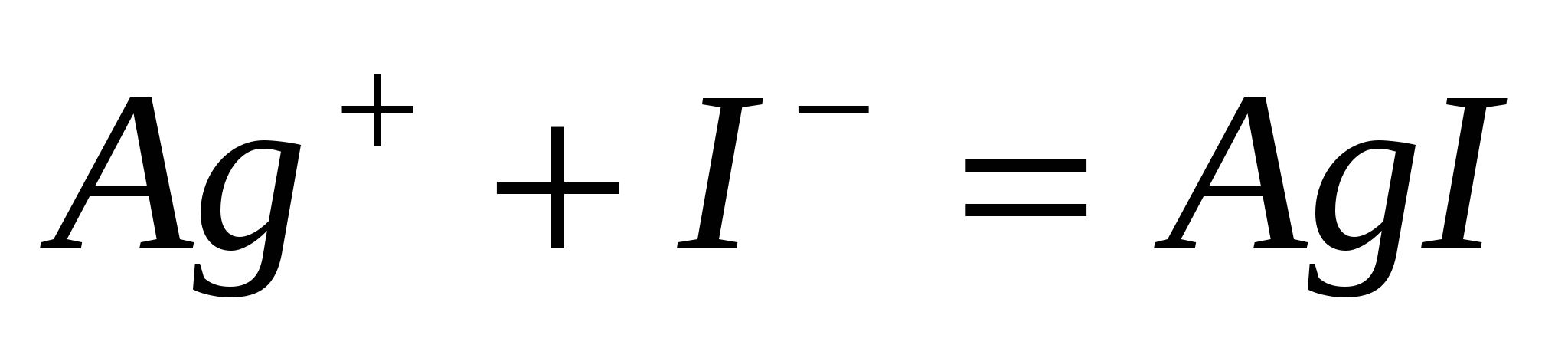 ; ; 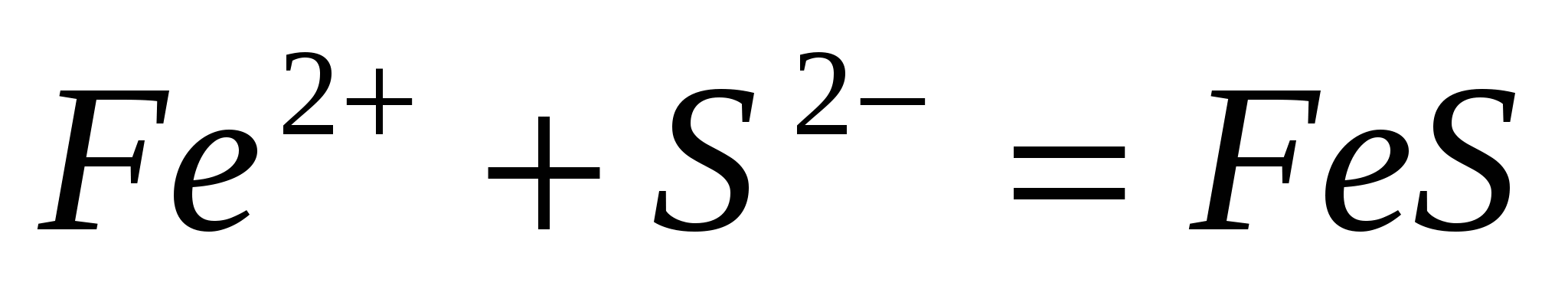
Вычислите температуру кипения раствора, содержащего 120 г сахара  в 650 г воды. Эбуллископическая константа воды равна 0,520. в 650 г воды. Эбуллископическая константа воды равна 0,520.
Вычислите константу диссоциации уксусной кислоты 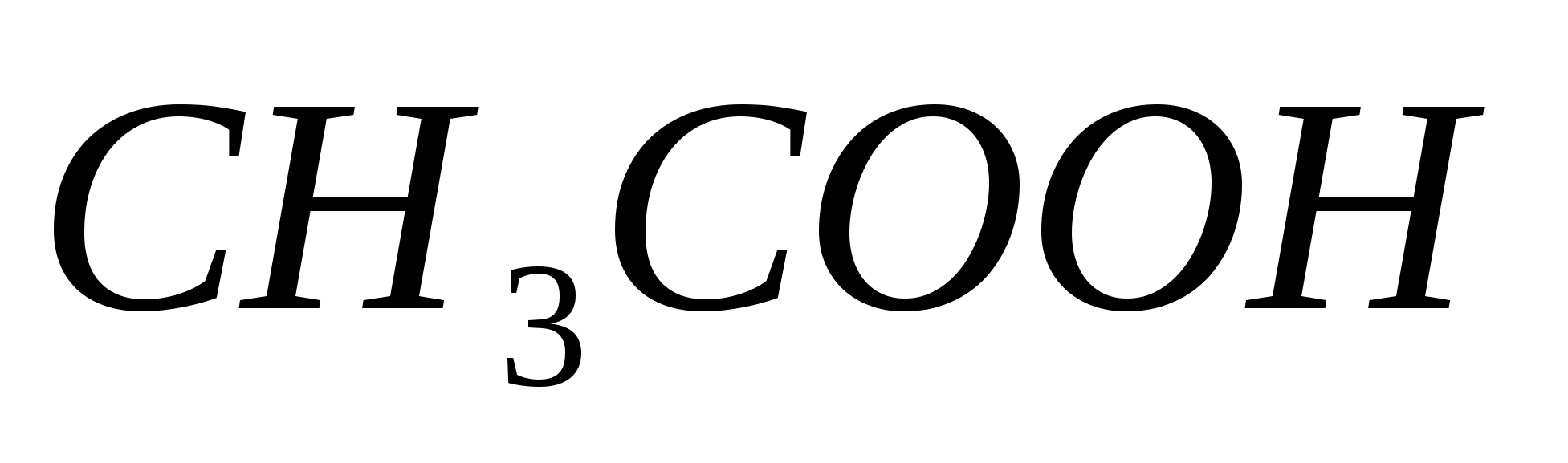 , если степень диссоциации ее в 0,25 М растворе равна 2,51 %. , если степень диссоциации ее в 0,25 М растворе равна 2,51 %.
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: 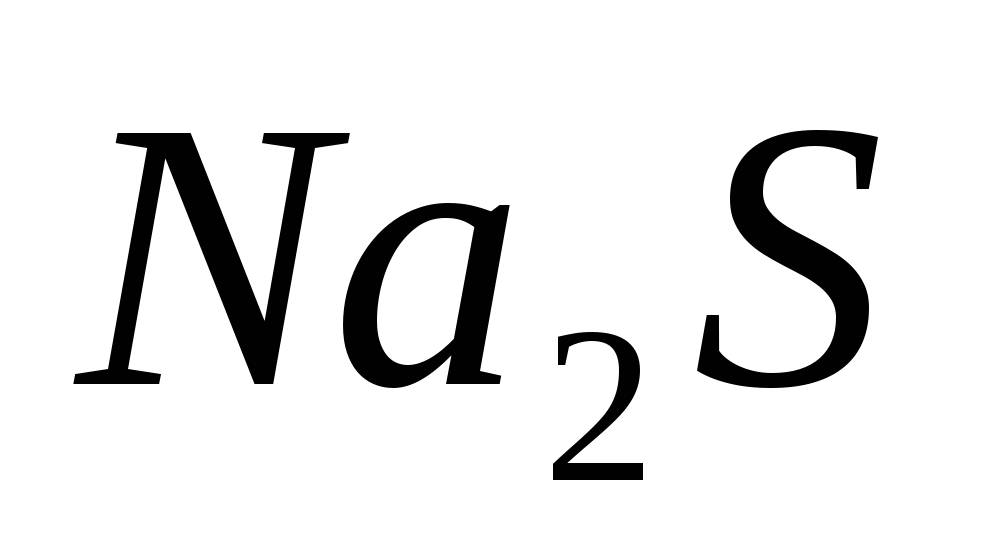 и и 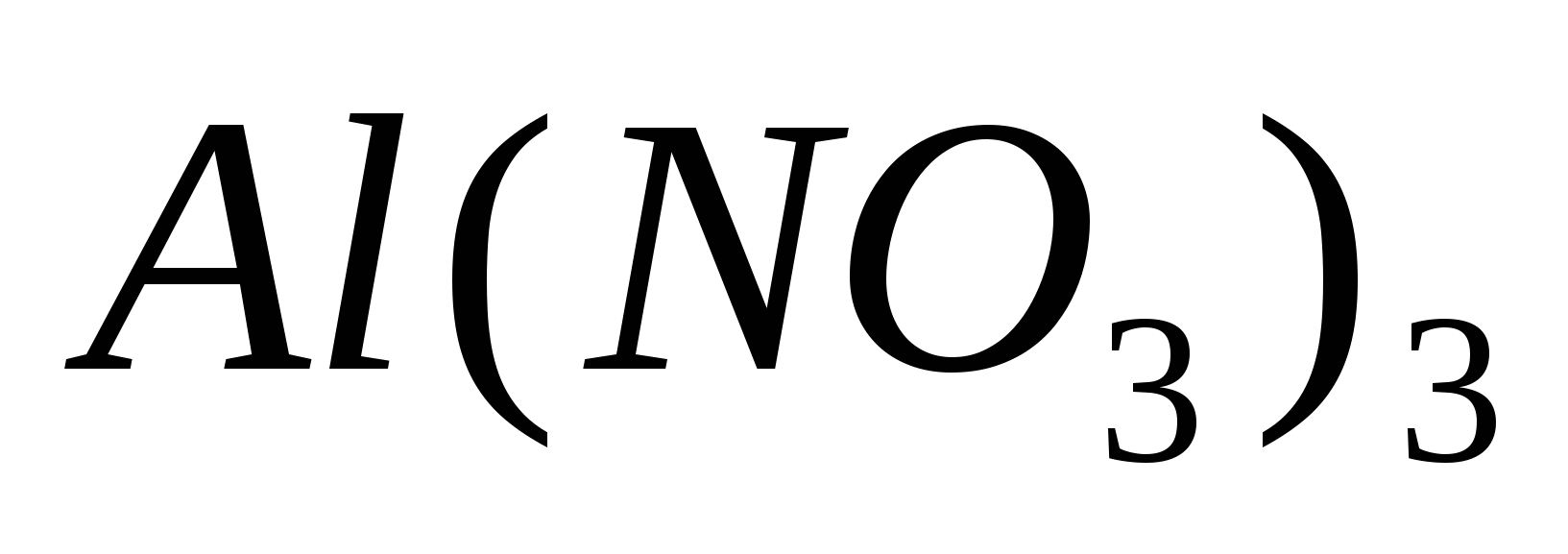 . Укажите рН среды. . Укажите рН среды.
Вариант 6.
Определите тепловой эффект процессов, протекающих по уравнениям: 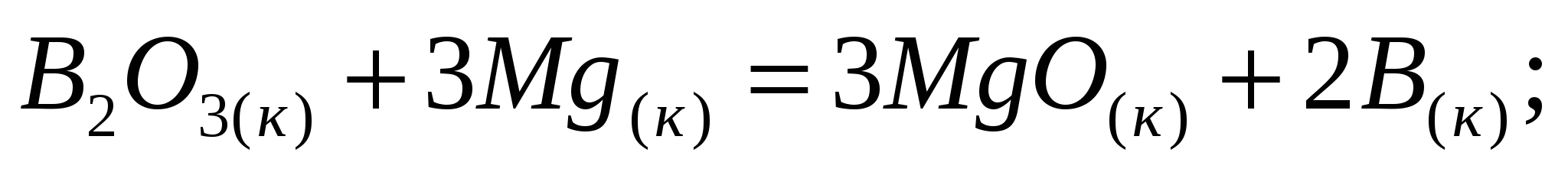 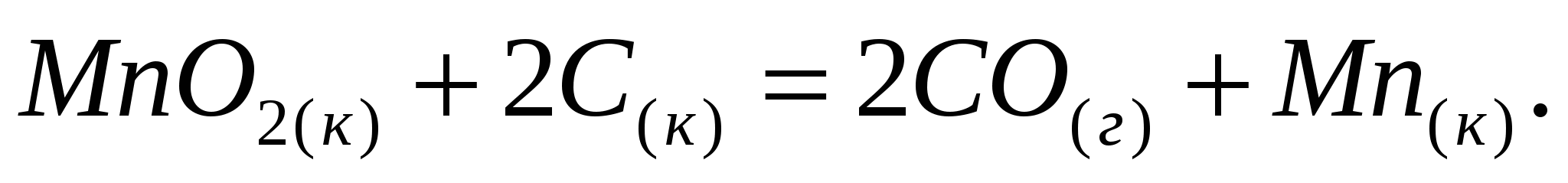
Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите  реакции, протекающей по уравнению реакции, протекающей по уравнению  . Возможен ли этот процесс при стандартных условиях? . Возможен ли этот процесс при стандартных условиях?
Во сколько раз увеличится константа скорости химической реакции при повышении температуры на 40°, если γ=3,2?
Исходные концентрации  и и 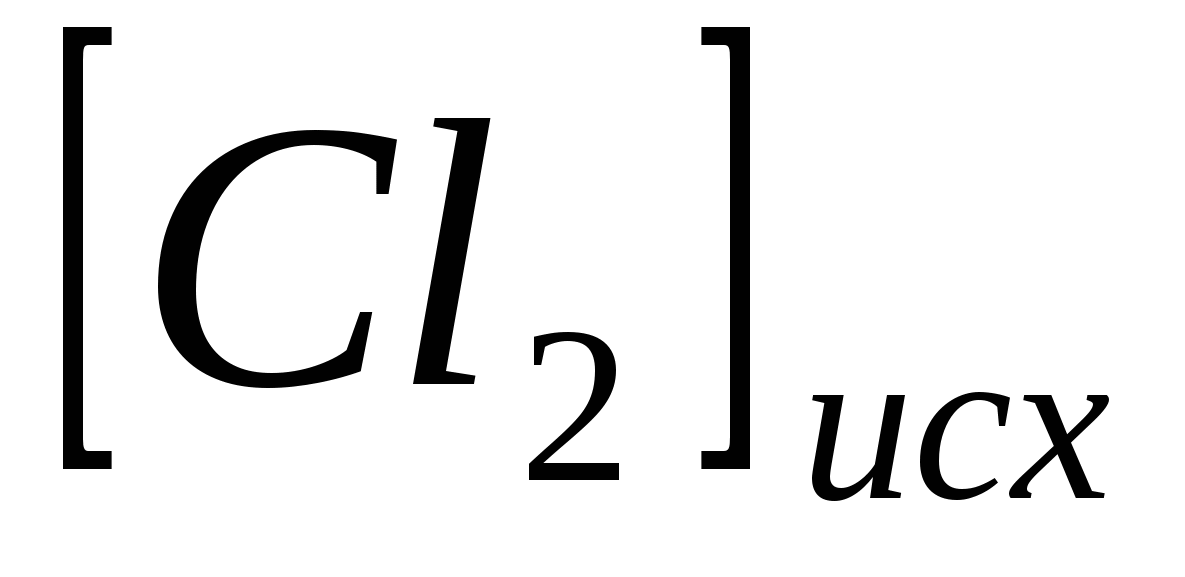 в гомогенной системе в гомогенной системе 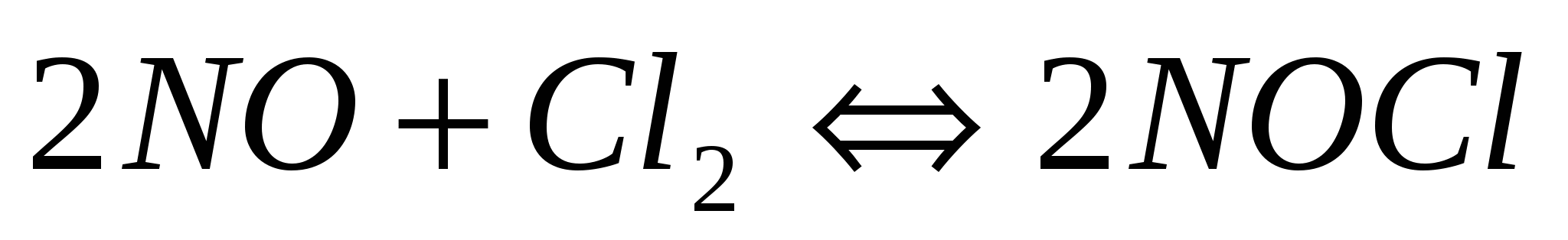 составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 15 % NO. составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 15 % NO.
Вычислите молярную концентрацию иодида калия, 1 л которого содержит 0,0025 г KI.
Составьте молекулярные и ионные уравнения реакций, протекающих при смешивании растворов: а)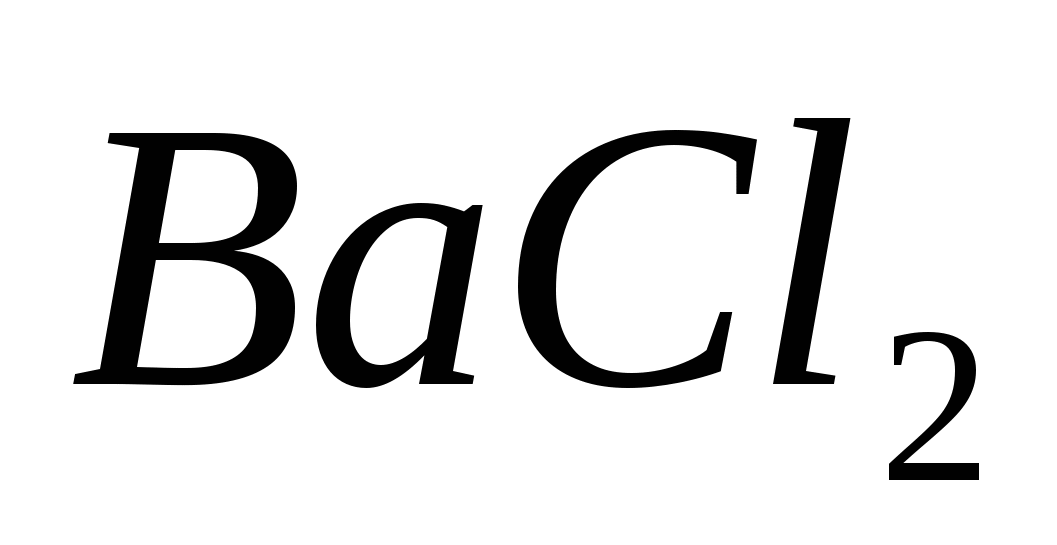 и и 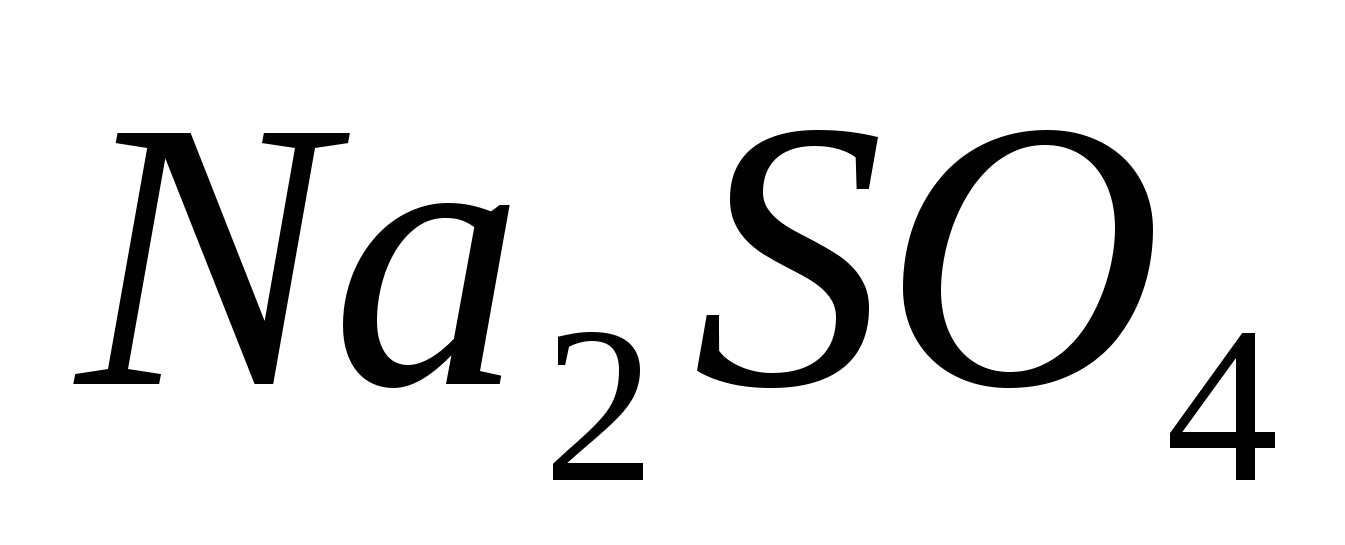 ; б) ; б) 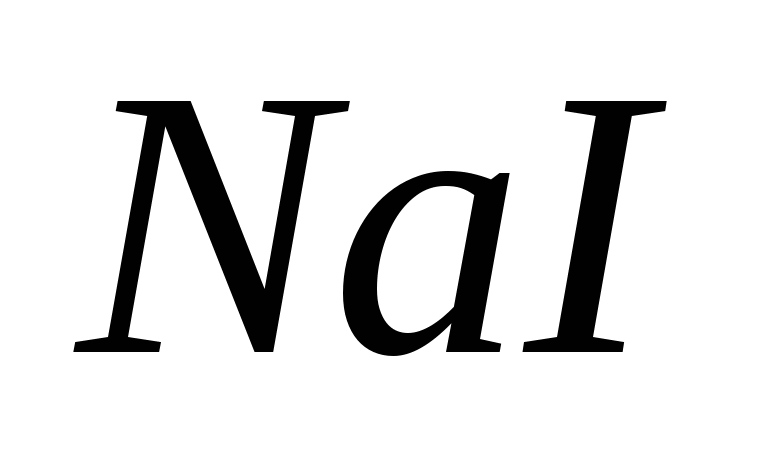 и и 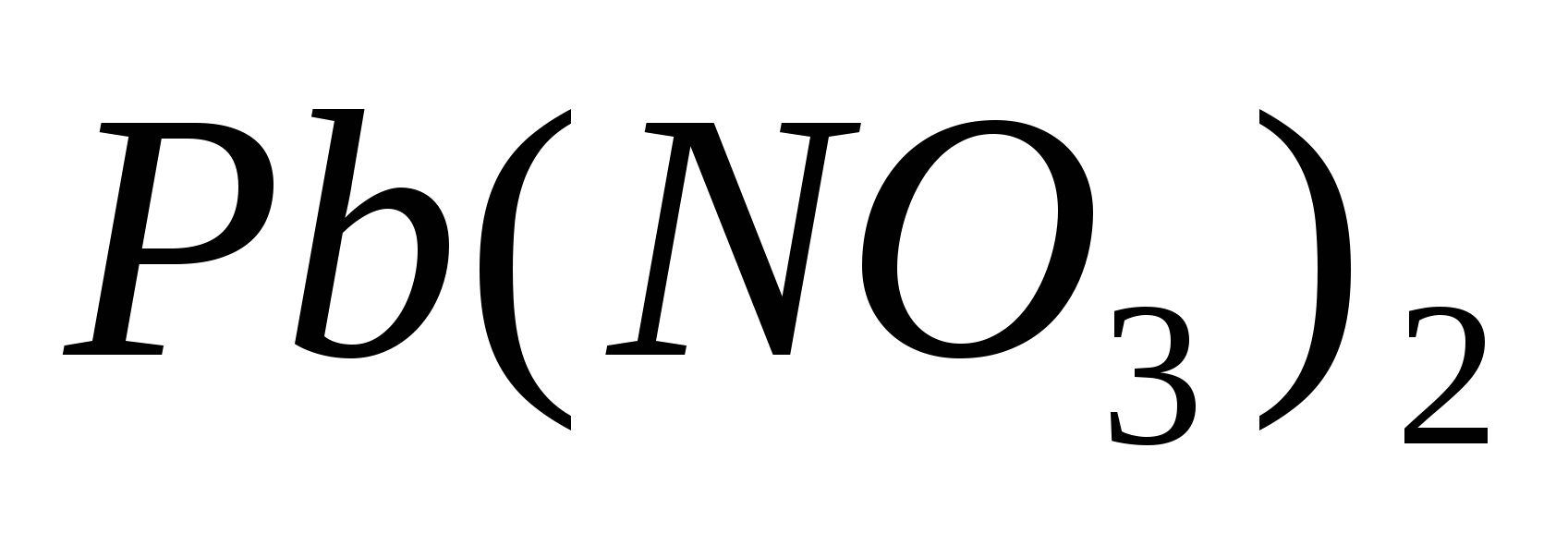 ; в) ; в)  и и  . .
Давление пара воды при 25ºС составляет 3167 Па. Вычислите для той же температуры давление пара раствора, в 375 г которого содержится 85 г глюкозы.
Составьте уравнения электролитической диссоциации следующих электролитов:  . Запишите выражения констант равновесия для слабых электролитов. . Запишите выражения констант равновесия для слабых электролитов.
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей:  и и  . Укажите рН среды. . Укажите рН среды.
Вариант 7.
Теплоты растворения  и и 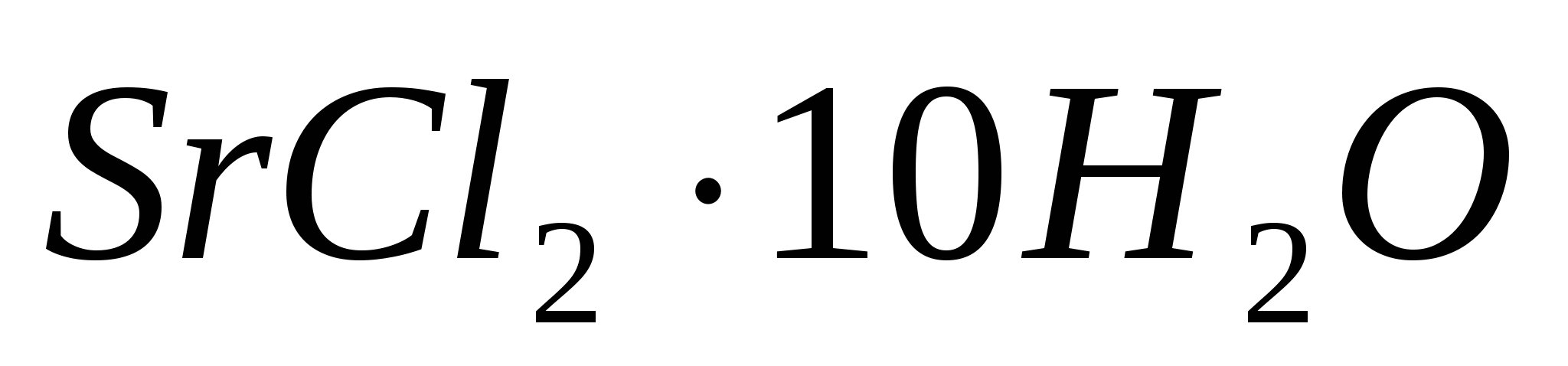 составляют соответственно – 47,7 и 31,0 кДж/моль. Вычислите изменение энтальпии реакции: составляют соответственно – 47,7 и 31,0 кДж/моль. Вычислите изменение энтальпии реакции: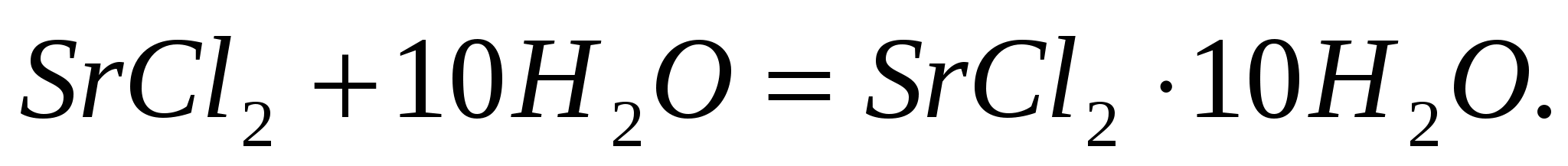
Не прибегая к расчетам, установите знак энтропии следующих реакций: 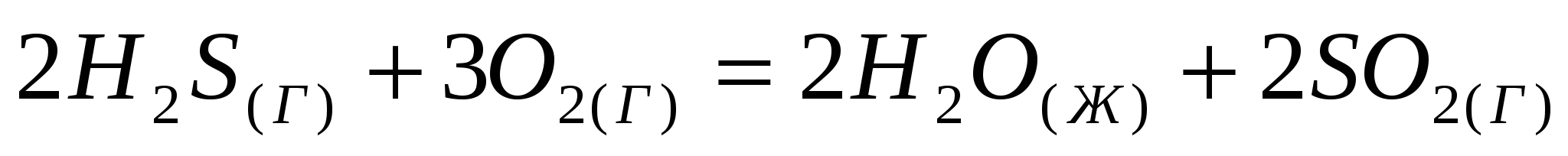 ; ;
 ; ;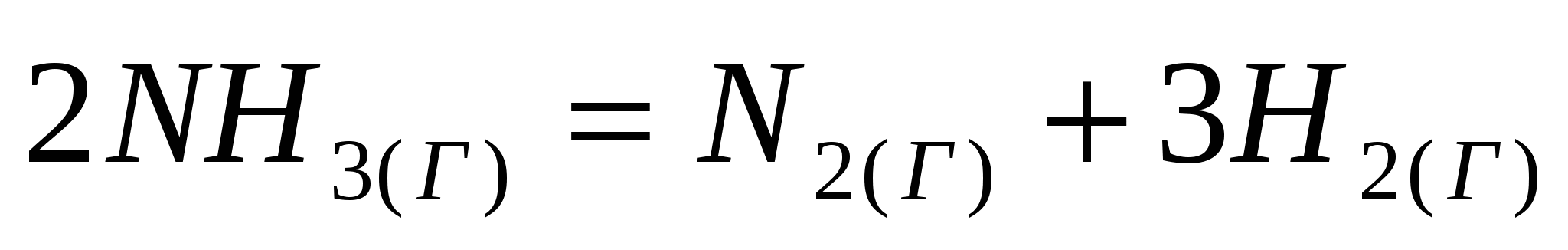 ; ;
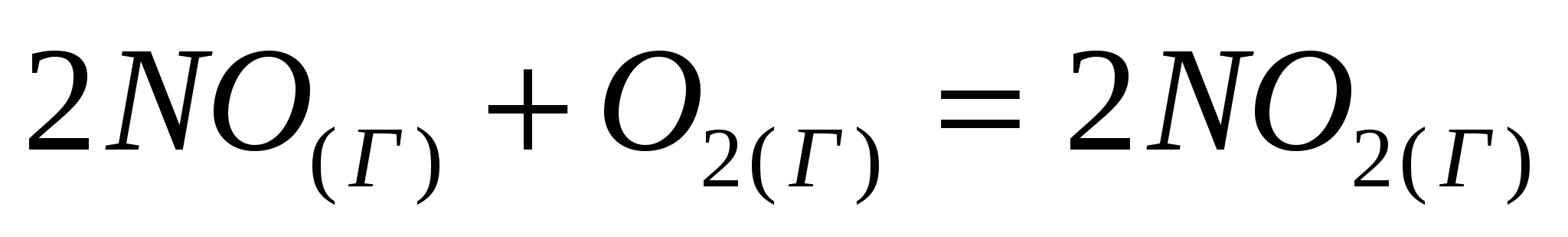
На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 30 раз (γ=2,5)?
Почему при изменении давления смещается равновесие системы 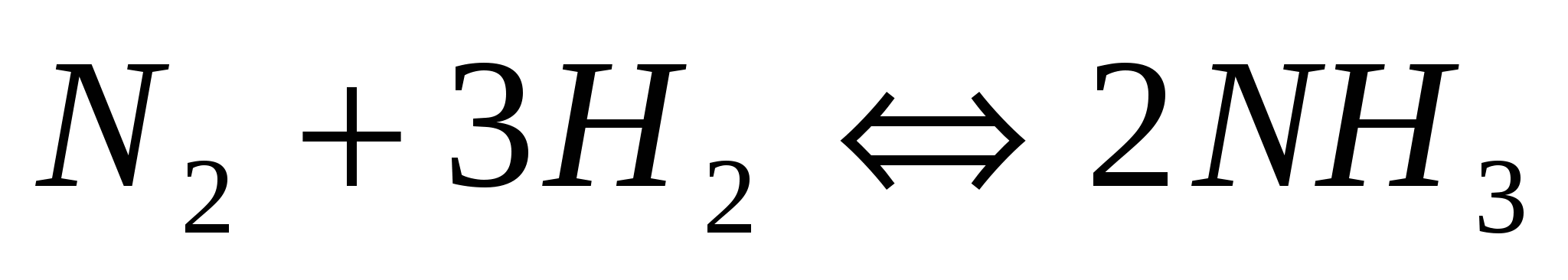 и не смещается равновесие системы и не смещается равновесие системы  ? Мотивируйте ответ, используя расчет скоростей прямой и обратной реакций до и после изменения давления. Составьте уравнения для констант равновесия обеих систем. ? Мотивируйте ответ, используя расчет скоростей прямой и обратной реакций до и после изменения давления. Составьте уравнения для констант равновесия обеих систем.
0.6 л раствора гидроксида калия содержит 16.8 г KOH . Чему равна молярная концентрация этого раствора?
Напишите ионно-молекулярные уравнения реакций:
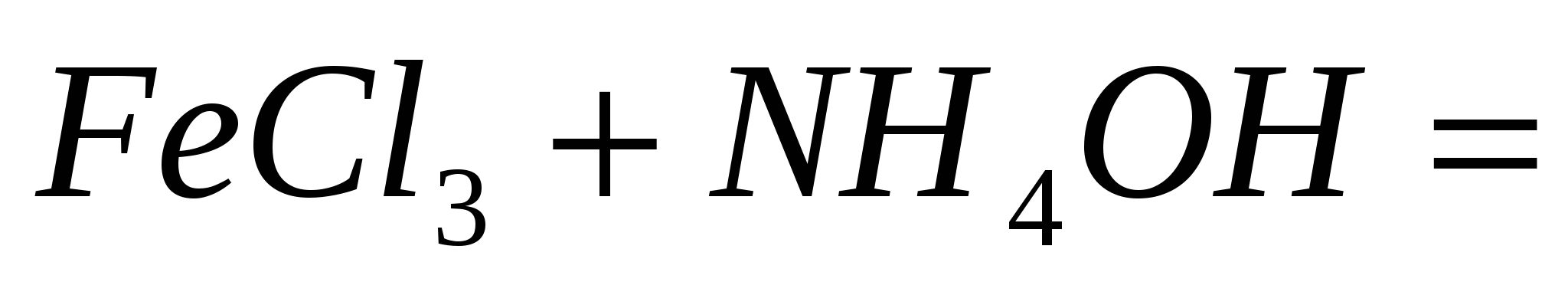 ; ;  ; ;  . .
Сколько граммов глюкозы 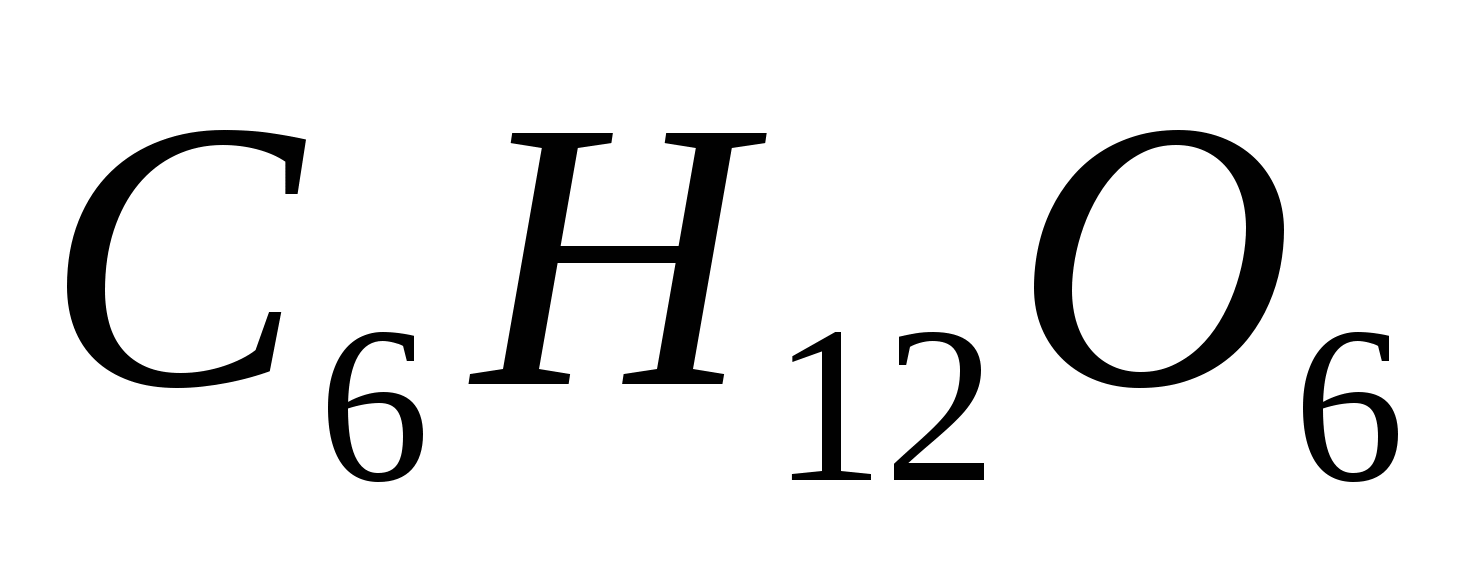 следует растворить в 300 г воды для получения раствора, температура кипения которого превышает температуру кипения чистого растворителя на 0,06ºС? Эбуллиоскопическая константа воды равна 0,52 0. следует растворить в 300 г воды для получения раствора, температура кипения которого превышает температуру кипения чистого растворителя на 0,06ºС? Эбуллиоскопическая константа воды равна 0,52 0.
Составьте уравнения электролитической диссоциации электролитов 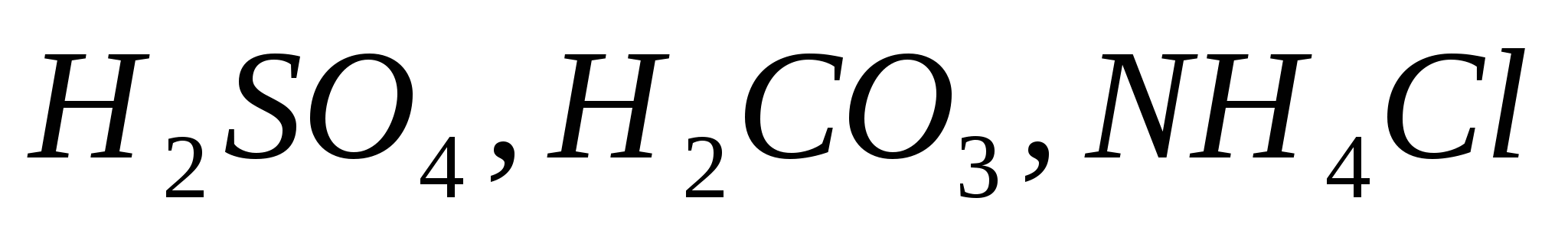 . Объясните, какой из них легче распадается на ионы и почему. Запишите выражение для константы равновесия слабых электролитов. . Объясните, какой из них легче распадается на ионы и почему. Запишите выражение для константы равновесия слабых электролитов.
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей:  и и  . Укажите рН среды. . Укажите рН среды.
Вариант 8.
Вычислите изменение энтальпии следующих процессов: 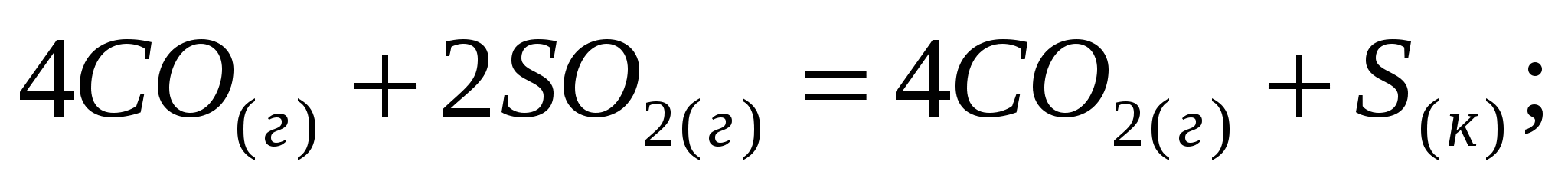 
Как изменяется энтропия при фазовых переходах: а) алмаза в графит; б) воды в пар; в) воды в лед? Почему? Вычислите энтропию каждого превращения.
При повышении температуры на 50° скорость реакции возросла в 1200 раз. Вычислите γ.
Равновесие в гомогенной системе  установилось при следующих концентрациях реагирующих веществ установилось при следующих концентрациях реагирующих веществ   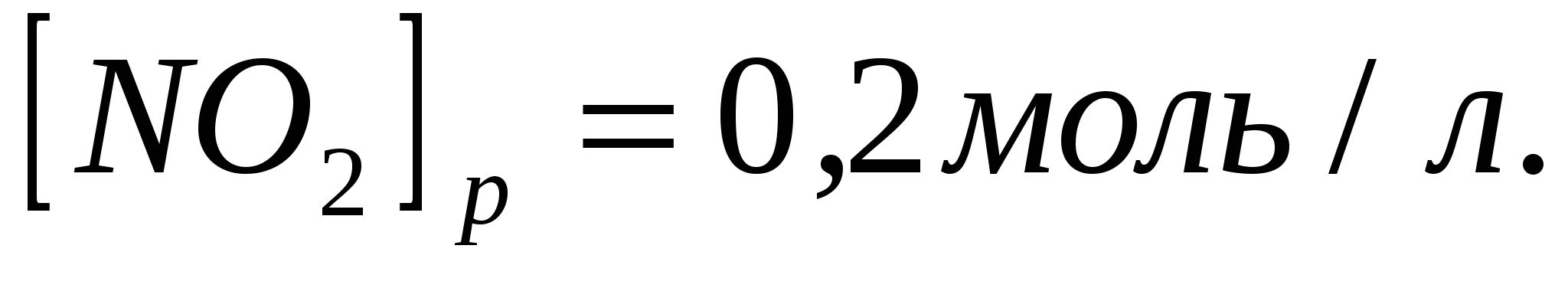 . Вычислите константу равновесия и исходную концентрацию оксида азота и кислорода. . Вычислите константу равновесия и исходную концентрацию оксида азота и кислорода.
Вычислите молярную концентрацию K2SO4, в 0.02 л которого содержится 2,74 г растворенного вещества.
Составьте молекулярные уравнения по ионно-молекулярным: 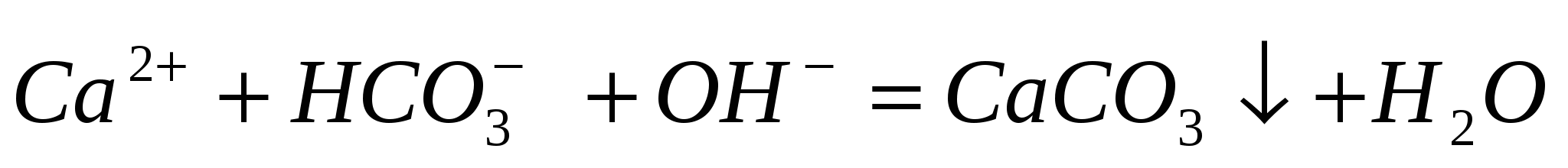 ; ; 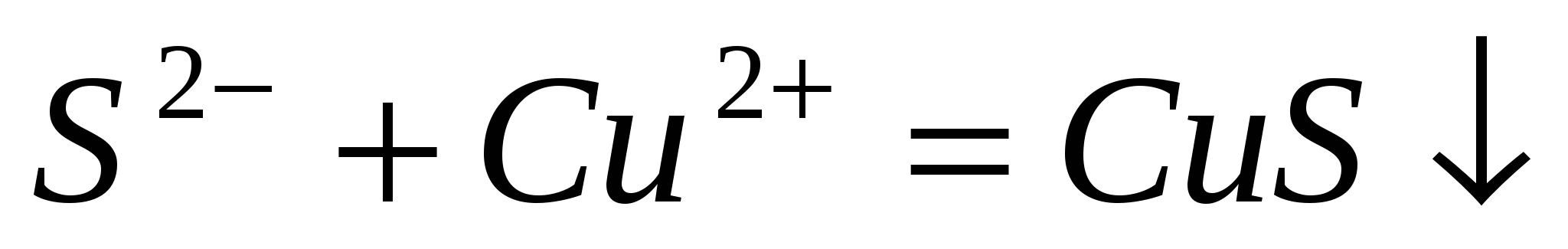
Вычислите осмотическое давление при 29ºС раствора сахара  , 1 л которого содержит 85 мг растворенного вещества. , 1 л которого содержит 85 мг растворенного вещества.
Составьте уравнения электролитической диссоциации следующих электролитов:  . .
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: 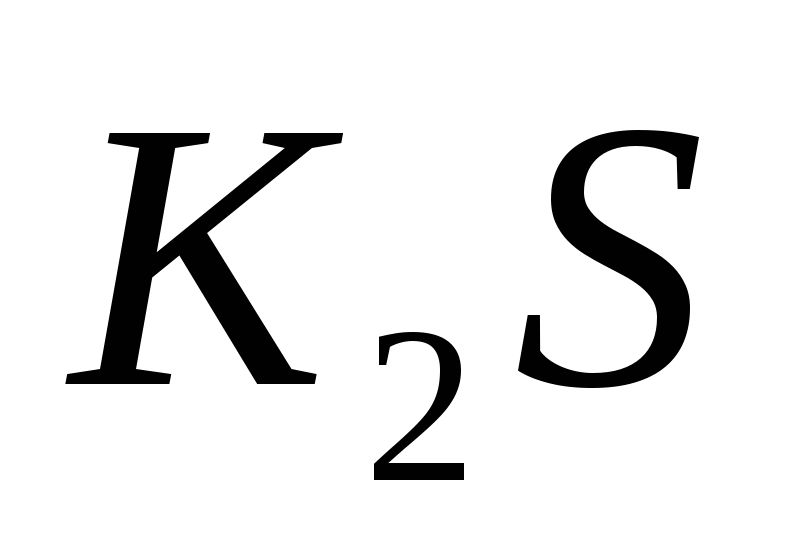 и и  . Укажите рН среды. . Укажите рН среды.
|
 Скачать 0.72 Mb.
Скачать 0.72 Mb.