задание 8 ОГЭ химия теория практика. 8 задание Химические свойства простых веществ металлов и немет. Задание 8 Химические свойства щелочных металлов (Na,K) Щелочные металлы
 Скачать 3.86 Mb. Скачать 3.86 Mb.
|
   Задание 8 Химические свойства щелочных металлов (Na,K) Щелочные металлы — это элементы главной подгруппы I группы Периодической системы. На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления +1. Все они типичные металлы, имеют серебристо-белый цвет, мягкие (режутся ножом), легкие и легкоплавкие. Активно взаимодействуют со всеми неметаллами: В  се щелочные металлы при взаимодействии с кислородом (исключение — Li) образуют пероксиды. В свободном виде щелочные металлы не встречаются из-за их высокой химической активности. се щелочные металлы при взаимодействии с кислородом (исключение — Li) образуют пероксиды. В свободном виде щелочные металлы не встречаются из-за их высокой химической активности.О Г  Соли щелочных металлов почти все растворимы в воде. Важнейшие из них: Na2CO3 — карбонат натрия; Na2CO3·10H2O — кристаллическая сода; NaHCO3 — гидрокарбонат натрия, пищевая сода; K2CO3 — карбонат калия, поташ; Na2SO4·10H2O — глауберова соль; NaCl — хлорид натрия, пищевая (повареная) соль. Соли щелочных металлов почти все растворимы в воде. Важнейшие из них: Na2CO3 — карбонат натрия; Na2CO3·10H2O — кристаллическая сода; NaHCO3 — гидрокарбонат натрия, пищевая сода; K2CO3 — карбонат калия, поташ; Na2SO4·10H2O — глауберова соль; NaCl — хлорид натрия, пищевая (повареная) соль.Получение – электролиз расплавов хлоридов, гидроксидов 4NaOH эл.ток → 4Na + O2 + 2H2O Химические свойства щелочноземельных металлов (Ca,Mg) Кальций (Ca) является представителем щелочноземельных металлов, как называют элементы главной подгруппы II группы, но не все, а только начиная с кальция и вниз по группе. Это те химические элементы, которые, взаимодействуя с водой, образуют щелочи. Кальций на внеш нем энергетическом уровне содержит два электрона, степень окисления +2. Физические и химические свойства кальция и его соединений представлены в таблице. Магний (Mg) имеет такое же строение атома, как и кальций, степень его окисления также +2. Мягкий металл, но его поверхность на воздухе покрывается защитной пленкой, что немного снижает его химическую активность. Его горение сопровождается ослепительной вспышкой. MgO и Mg(OH)2 проявляют основные свойства. Хотя Mg(OH)2 и малорастворим, но окрашивает раствор фенолфталеина в малиновый цвет. Оксиды MgO — твердые белые тугоплавкие вещества. В технике CaO называют негашеной известью, а MgO — жженой магнезией, их используют в производстве строительных материалов. Реакция оксида кальция с водой сопровождается выделением теплоты и называется гашением извести, а образующийся Ca(OH)2 — гашеной известью. Прозрачный раствор гидроксида кальция называется известковой водой, а белая взвесь Ca(OH)2 в воде — известковым молоком. Соли магния и кальция получают взаимодействием их с кислотами. CaCO3 — карбонат кальция, мел, мрамор, известняк. Применяется в строительстве. MgCO3 — карбонат магния — применяется в металлургии для освобождения от шлаков. CaSO4·2H2O — гипс. MgSO4 — сульфат магния — называют горькой, или английской, солью, содержится в морской воде. BaSO4 — сульфат бария — благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в диагностике («баритовая каша») желудочно-кишечного тракта. На долю кальция приходится 1,5% массы тела человека, 98% кальция содержится в костях. Кальций и его соединения.
Химические свойства алюминия Алюминий (Al) — элемент главной подгруппы III группы Периодической системы. У него на внешнем энергетическом уровне три электрона, которые алюминий легко отдает при химических взаимодействиях. У атомов алюминия восстановительные свойства выражены ярче, чем у бора, т.к. у алюминия имеется промежуточный слой с восемью электронами (2ē,8ē,3ē), который препятствует притяжению электронов к ядру. Алюминий имеет степень окисления +3. Алюминий — серебристо-белый металл, t°пл=660°С. Это самый распространенный металл земной коры, обладает высокой коррозионной стойкостью. Малая плотность алюминия (2,7 г/см3) в сочетании с высокой прочностью и пластичностью его сплавов делают алюминий незаменимым в самолетостроении. Высокая электропроводность алюминия (в 1.6 раза меньше, чем у меди) позволяет заменять медные провода более легкими — алюминиевыми. Высокая химическая активность алюминия используется в алюминотермии, с помощью которой получают хром, ванадий, титан и другие металлы. Прочность химической связи в оксиде Al2O3 обуславливает его механическую прочность, твердость. Al2O3 — корунд, абразивный материал. Искусственный рубин — Al2O3 с добавлением оксида хрома. Химические свойства алюминия и его соединений обобщены в таблице. Алюминий и его соединения.
Химические свойства цинка Цинк (Zn) — элемент побочной подгруппы II группы. Его электронная формула следующая: (...3d104s2). Так как в атомах цинка предпоследний d−подуровень полностью завершен, то цинк в соединениях проявляет степень окисления +2. Цинк — металл серебристо-белого цвета, практически не изменяющийся на воздухе. Обладает коррозионной стойкостью, что объясняется наличием на его поверхности оксидной пленки. Цинк — один из активнейших металлов, при повышенной температуре реагирует с простыми веществами: Zn+Cl2t°→ ZnCl2, 2Zn+O2t°→2ZnO, Zn+St°→ ZnS, 3Zn+2Рt°→ Zn3Р2 С водородом, азотом, углеродом, кремнием, бором цинк не реагирует. Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода: Zn + H2O = ZnO + H2. Взаимодействие с кислотами В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот:Zn + 2HCl = ZnCl2 + H2;Zn + H2SO4 = ZnSO4 + H2. В  заимодействует с азотной кислотой заимодействует с азотной кислотойРеагирует с концентрированной серной кислотойZn + 2H2SO4 = ZnSO4 + SO2 + 2H2O; Реагирует с растворами щелочей с образованием гидроксокомплексов: Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 при сплавлении образует цинкаты: Zn + 2KOHt°= K2ZnO2 + H2. С газообразным аммиаком при 550–600°С образует нитрид цинка:3Zn + 2NH3 = Zn3N2 + 3H2; растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка: Zn + 4NH3 + 2H2O = [Zn(NH3)4](OH)2 + H2. Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов: Zn + CuSO4 = Cu + ZnSO4; Zn + CuO = Cu + ZnO. Гидроксид цинка амфотерен, т. е. проявляет свойства и кислоты, и основания. При постепенномприливании раствора щелочи к раствору соли цинка выпавший вначале осадок растворяется (то же происходит и с алюминием): ZnSO4+2NaOH=Zn(OH)2↓+Na2SO4, Zn(OH)2+2NaOH= Na2[Zn(OH)4] белый осадок тетрагидроксоцинкат натрия  Железо и его соединения.
  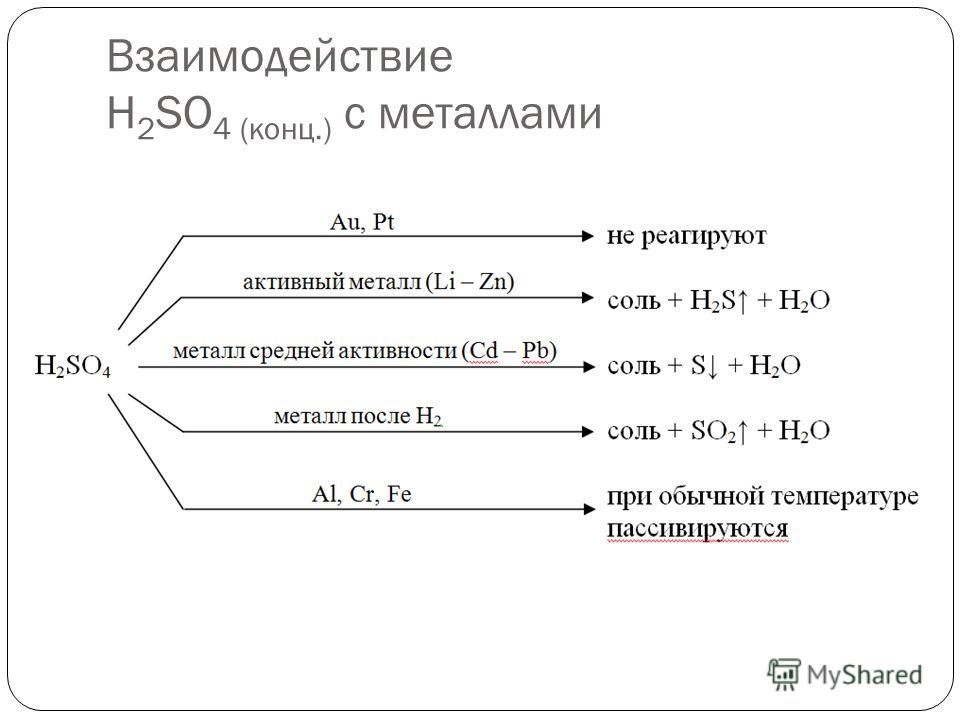  | ||||||||||||||||||||

 1. Серебристо-белый металл.
1. Серебристо-белый металл. 1. Серебристо-белый легкий металл.
1. Серебристо-белый легкий металл.