Поверхностные явления. ), поверхность эритроцитов (25003800 м
 Скачать 16.79 Mb. Скачать 16.79 Mb.
|
|
Факторы, влияющие на молекулярную адсорбцию
3. Природа адсорбата. По правилу уравнивания полярности Ребиндера (1898-1972), вещество С может адсорбироваться на поверхности раздела фаз А и В в том случае, если его присутствие приводит к уравниванию полярностей этих фаз. Полярность фазы можно характеризовать величиной ε – диэлектрической проницаемостью. Чем больше ε, тем больше полярность фазы. Исходя из правила Ребиндера, можно записать εВ >εС > εА или εВ < εС< εА. Пользуясь правилом уравнивания полярностей, можно сделать ряд выводов, касающихся адсорбции ПАВ из растворов. Так, для адсорбции ПАВ из водных растворов следует использовать неполярные (гидрофобные) твердые тела. В этом случае выполняется условие ε (адсорбента) < ε (ПАВ) < ε (Н2О). Адсорбция будет тем больше, чем значительнее разница ε (адсорбента) – ε (Н2О). При адсорбции молекулы ПАВ строго ориентированы: полярная часть направлена в воду, неполярная – к адсорбенту (Рис. 12 а). 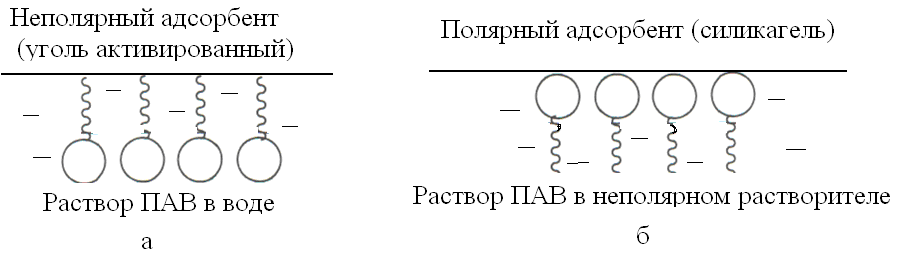 Рис.12 Ориентация молекул ПАВ на границе твердое тело-раствор Этим правилом объясняется тот факт, что в водных растворах стирального порошка (ПАВ) гораздо легче и быстрее стираются синтетические ткани, чем хлопчатобумажные или льняные, т.к. последние являются более полярными, а значит, ε (Н2О) – ε (синтетика) > ε (Н2О) – ε (х/б), и адсорбция стирального порошка на синтетической ткани больше, чем на хлопчатобумажной или льняной. Для адсорбции ПАВ из неполярных растворителей (бензола, толуола и др.) следует использовать полярные (гидрофильные) адсорбенты (силикагель, глину и др). Ориентация молекул ПАВ такова: неполярный углеводородный радикал направлен в неполярный растворитель, а полярная часть молекулы взаимодействует с полярным адсорбентом (Рис. 12 б). В этом случае выполняется неравенство ε (бензол) < ε (ПАВ) < ε (адсорбент). Можно отметить и частные правила
Замечание: частные правила не выполняются для адсорбции на мелкопористых адсорбентах. 4. Температура. С ростом температуры величина адсорбции уменьшается, что указывает на физический характер процесса. Молекулярная адсорбция из растворов на твердом адсорбенте широко используется в медицинской практике. Так, при отравлениях применяется активированный уголь, способный адсорбировать газы, алкалоиды, барбитураты, токсины из ЖКТ. С 60-ых годов ХХ в. адсорбционные методы используются для прижизненного удаления токсических веществ из биологических жидкостей. С этой целью через слой сорбента пропускаю кровь, плазму и лимфу. Соответственно эти процессы называют гемо-, плазмо- и лимфосорбцией. Гемосорбция была первым методом, использованным для лечения отравлений. Техника этой процедуры довольно проста: цельную кровь, взятую из артериальной системы организма, пропускают через колонку с адсорбентом, после чего вновь возвращают в организм. Недостатком гемосорбции является контакт адсорбента с клеточными частицами крови (эритроцитами, тромбоцитами, лейкоцитами), в результате чего некоторые виды адсорбентов (активные угли) могут вызывать травму клеток. Для устранения этого недостатка было предложено заключать частицы угля в полупроницаемые мембраны. Такой вариант представляет собой комбинацию мембранного и адсорбционного методов очистки. Чисто адсорбционный характер очистки сохраняется, если через сорбент пропускать не цельную кровь, а бесклеточную среду – плазму. Плазмосорбция применяется в клинической практике с середины 70-ых годов ХХ в. Явления химических превращений при усвоении питательных веществ обычно начинаются с накопления реагирующих веществ на поверхности природных катализаторов – ферментов. Проникновение веществ в организм через полупроницаемые перегородки также связано с адсорбцией, происходящей на поверхности раздела. В санитарно - гигиенической практике молекулярная адсорбция используется для очистки питьевой воды и сточных вод промышленных предприятий. Фильтрующие сорбенты на основе природных глин находят применение в пищевой промышленности для очистки пищевых растворов, сиропов, соков и растительных масел. Ионная адсорбция из растворов Сильные электролиты в отличие от недиссоциирующих и слабо диссоциирующих соединений адсорбируются в виде ионов. Адсорбция в большинстве случаев происходит под действием химических сил, а не сил Ван – дер - Ваальса, поэтому с ростом температуры величина адсорбции увеличивается. Ионную адсорбцию называют полярной, так как способные поляризоваться ионы адсорбируются на тех поверхностях, которые состоят из полярных молекул или ионов. Адсорбционная способность ионов зависит от их природы, радиуса и величины заряда. Чем больше радиус иона, тем меньше он гидратируется, тем легче поляризуется, тем выше адсорбционная способность. По возрастающей способности адсорбироваться одно- и двухзарядные катионы можно расположить в лиотропные ряды: 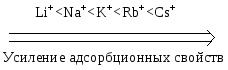 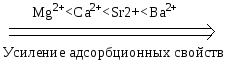 Однозарядные анионы по их возрастающей адсорбционной способности располагаются в таком порядке 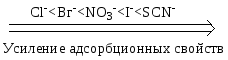 С возрастанием заряда иона увеличивается его поляризуемость и склонность к адсорбции, поэтому 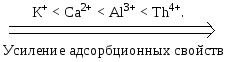 Ионная адсорбция может протекать по двум основным механизмам:
И в том, и в другом случае адсорбция ионов связана с образованием двойного электрического слоя (ДЭС) на границе раздела твердой и жидкой фаз. Избирательная адсорбция ионов Избирательная адсорбция - это процесс фиксации на твердой поверхности ионов одного знака заряда при сохранении подвижности ионов противоположного знака. Процесс подчиняется правилам Панета и Фаянса
Например, известно, что поверхность каолина в воде отрицательно заряжена. Если внести каолин в раствор основного красителя - метиленового синего (ROH↔R+ + OH-), то раствор обесцветится за счет адсорбции красящего радикала R+ на отрицательной поверхности. Раствор кислого красителя - эозина ( HR ↔ H+ + R- ) в присутствии каолина цвет не меняет. Ионообменная адсорбция Ионообменная адсорбция – это процесс, при котором твердый адсорбент обменивает свои ионы на ионы того же знака из раствора в эквивалентных количествах. Первые сообщения об ионообменной адсорбции были сделаны в 1850 году независимо друг от друга английскими учеными Томпсоном и Уэем. Изучая способность почв к поглощению удобрений и их вымыванию дождем, они обнаружили обмен ионами между почвой и водными растворами солей. К особенностям ионного обмена относятся: а) высокая специфичность, т.е. к обмену способны только определенные ионы; б) меньшая скорость, чем у молекулярной адсорбции; в) возможность изменения рН среды; г) процесс не всегда обратим. Адсорбенты, на которых протекает ионообменная адсорбция, называются ионитами или ионообменниками. Они бывают как природного происхождения (почвы, цеолиты), так и синтетически полученные. Иониты могут иметь кислотный, основной или амфотерный характер. Вещества кислотного характера обмениваются с раствором катионами и называются катионитами. Основные сорбенты - аниониты - отдают в раствор анионы, замещая их анионами раствора. Амфотерные иониты содержат и катионные, и анионные обмениваемые группы, т.е. они могут одновременно сорбировать и катионы, и анионы. К природным неорганическим катионитам относятся кристаллические силикаты (шабазит, глауконит и др.), анионитам – некоторые минералы, например, апатит. Природными ионитами органического происхождения являются, например, содержащиеся в почве гуминовые кислоты – высокомолекулярные соединения, обладающие амфотерными свойствами. Природные иониты не нашли широкого практического применения, т.к. имеют ряд недостатков, в частности, они химически нестойки и не обладают достаточной механической прочностью. В 1935 году Б. Адамс и Е. Холмс получили ионообменные материалы на основе искусственных полимерных соединений. В настоящее время широко используются иониты на основе органических смол – синтетические ионообменные смолы. Неорганические иониты имеют кристаллическую структуру, способные к обмену ионы содержатся в их решетках. Органические полимерные ионообменники имеют пространственную структуру, на которой расположены ионогенные группы, определяющие свойства ионитов (Рис. 13). В катионитах такими группами могут быть - СООН, - SО3Н, - ОН, - SiOН, обменивающие ион Н+ на катионы раствора. R-SO3-H+ + Na+Cl- где R -органическая полимерная матрица. В анионитах содержатся активные группы: -NH2, ROH- + Na+Cl- Основными достоинствами синтетических ионообменников являются химическая стойкость, механическая прочность, разнообразие кислотно-основных свойств, большая обменная емкость. Обменную емкость выражают в молях или миллимолях извлекаемых из раствора ионов в расчете на единицу массы сухого ионита. После проведения сорбции иониты можно регенерировать, обрабатывая катиониты кислотой, аниониты - щелочью.  Рис. 13 Значение ионного обмена чрезвычайно велико. Так, пропуская засоленную воду через катионит, а затем через анионит, можно провести её деминерализацию (обессоливание). Аналогично протекает процесс умягчения воды. С помощью ионитов производят очистку сахарных концентратов, извлечение ценных металлов из отходов производств (Au, Ag, Cu, Cr и др.), выделение и очистку витаминов, антибиотиков, разделение смесей аминокислот, радиоактивных веществ, редкоземельных элементов. Перспективным является применение ионитов для целей анализа и при изготовлении чистых реактивов. В стадии изучения находится вопрос о медицинском использовании ионитов путем введения их высокодисперсных форм непосредственно в ЖКТ для связывания ядовитых веществ, токсинов, а также для нормализации ионного баланса в организме. ЗАКЛЮЧЕНИЕ Адсорбция из растворов – процесс более сложный по сравнению с адсорбцией на границе «жидкость-газ», поскольку в борьбу за активные центры адсорбента вступают молекулы растворителя и молекулы или ионы растворенного вещества. Молекулярная адсорбция (адсорбция неэлектролитов) существенно зависит от свойств растворенного вещества, растворителя и адсорбента. Так, а) вещество адсорбируется тем лучше, чем оно менее растворимо в данном растворителе; б) на твердых поверхностях адсорбируются только те вещества, которые обладают полярностью, промежуточной между полярностями фаз; в) неполярные твердые тела лучше адсорбируют неполярные адсорбаты и наоборот. С ростом температуры величина молекулярной адсорбции уменьшается, что указывает на её физический характер. Из растворов сильных электролитов на поверхности твердых веществ адсорбируются ионы. Величина адсорбции увеличивается с ростом температуры, увеличением кристаллического радиуса иона и его заряда, противоположного заряду поверхности. На поверхности кристаллов избирательно адсорбируются ионы, способные достраивать кристаллическую решетку. На границе твердое тело-раствор может наблюдаться ионный обмен, к которому склонные некоторые твердые вещества – иониты. Они обменивают свои ионы на ионы того же знака в растворе в эквивалентных количествах. ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ
АДСОРБЦИЯ НА ГРАНИЦЕ ЖИДКОСТЬ—ЖИДКОСТЬ Этот вид адсорбции удобно рассматривать на примере эмульсий. Эмульсии-это дисперсные системы, состоящие из двух взаимонерастворяющихся жидкостей. Более полярная жидкость условно называется «вода», менее полярная - «масло». Поэтому различают эмульсии I рода, прямые, масло в воде (м/в) и II рода, обратные, вода в масле (в/м). Тип эмульсии определяют следующими методами:
Такое поведение эмульсии обусловлено тем, что её свойства определяются свойствами дисерсионной среды. В зависимости от концентрации дисперсной фазы эмульсии классифицируют на три группы:
Будучи дисперсными системами, эмульсии имеют большую поверхность раздела фаз S и, следовательно, избыточную свободную энергию G = S · σ. По этой причине эмульсии - термодинамически неустойчивые системы. Стремление уменьшить поверхностную энергию приводит к слиянию капель дисперсной фазы и, в конечном счете, к расслоению эмульсии на две фазы. Процесс слияния частиц дисперсной фазы называется коалесценцией. Для предотвращения коалесценции и придания эмульсиям устойчивости в них вводят третий компонент - стабилизатор (эмульгатор). Адсорбируясь на частицах дисперсной фазы, эмульгатор сообщает тот или иной фактор устойчивости, в результате чего эмульсия сохраняет степень дисперсности частиц. По механизму действия эмульгаторы делятся на 4 класса:
|
