Химия Билет. 1 Билет Химия ылымыны пайда болуы, дамуы жне маызы
 Скачать 1.16 Mb. Скачать 1.16 Mb.
|
  №1 Билет №1 Билет1. Химия ғылымының пайда болуы, дамуы және маңызы Химия ғылымының негізгі даму кезеңдері Химия дамуының барлық тарихы оның негізгі алдыға қойған мәселесін шешу жолында әдістеме-тәсілдердің ауысып отыруымен сипатталады. Химия ғылымының даму деңгейіне байланысты материя құрылымы, табиғаттағы заттардың құрамы, олардың бөлшектері - молекулалардың құрылымы туралы ұғымдар да өзгеріп отырды. XVIII ғасырға дейінгі химияның даму кезеңінде қажетті қасиеттері бар заттарды алу мәселелері көп жағдайда оңды нәтиже бере қойған жоқ. Табиғаттағы денелердің қасиеттерінің пайда болуы туралы екі ұдай пікір айтылған болатын. Антикалық уақыттың ұлы ғұламалары Демокрит (б.э.д. 470-380 ж.), Эпикур (б.э.д. 341-270 ж.) атомистік теорияны ұсынды. Олардың көзқарасы бойынша, барлық денелер көлемдері мен формалары әр түрлі атомдардан тұрады, ал бұл атомдар олардың сапалық өзгешеліктерін түсіндіреді деген данышпандық көзқарасты ұстады. Ал Аристотель (б.э.д. 384-322 ж.) мен Эмподокл (б.э.д. 490-430 ж.) табиғатта кездесетін денелердің әр түрлілігі олардың қасиеттерінің: жылу мен суықтың, құрғақтық пен ылғалдың, жарық пен қараңғының тағы басқа тіркесіп келуі арқылы түсіндіріледі деп айтты. Кейінірек осы көзқарасты ортағасырлық алхимиктер де дамытты. Бұл кезеңде табиғат туралы білім жүйесін құраған — натурфилософия мен кәсіптік химия жеке-жеке дамыды. Ал заттардың қасиеттерінің мәселесін шешу тәсілдері XVII ғасырдың екінші жартысында Р.Бойлдің еңбектерінде көрініс тапты. Оның зерттеулері денелердің қасиеттері абсолютті емес, олар оны құраушы материалдық элементтердің сипаттарына байланысты екендігін көрсетті. XVII ғасырдың ортасынан XIX ғасырдың басына дейін заттардың құрамы туралы ілім барлық сол кездегі химияны қамтыды. Ол қазір де химияның бір бөлігі ретінде қарастырылады. Химия ғылымдары дамуының екінші кезеңі немесе құрылымдық химия XIX ғасырды қамтиды. Химия дамуының бұл кезеңі өндірістің мануфактуралық сипатының техникаға, кеңейтілген материалдық-шикізат базасына негізделген фабрикалық сипатпен алмасуы арқылы сипатталады. Сол кездегі химия өнеркәсібінде өсімдік пен жануарлардан алынатын заттарды өңдеу орын алды, олардың әрқайсысының ерекше сапалық ерекшеліктері болды, дегенмен, құрамы бірдей: яғни көбінесе сутегі, оттегі, көміртегі, күкірт, азот, фосфордан тұрды. Сонымен, заттардың жеке қасиеттері олардың химиялық құрамымен анықталмайтындығы белгілі болды. Ал енді, осыдан кейін заттың құрылымы деген ұғым ғылымға енді. Химиктер заттардың қасиеттері мен сапалық жағынан әр түрлілігі олардың құрамымен емес, молекулаларының құрылымымен анықталатындығына көз жеткізді. Ал, зат құрылымымен таныс болғаннан кейін оны құрайтын молекулалардың атомдары қайсысы химиялық байланысқа жақсы қатысады, қайсысының қабілеті төмен деген сурақ туды. Себебі, зат құрамына кіретін барлық атомдар химиялық айналымға бірдей дәрежеде қатыспайды екен. Осыдан келіп, «реакцияға қабілеттілік» деген тағы бір ұғым химия ғылымына енді. Өзінің екінші даму деңгейінде химия аналитикалық ғылымнан синтетикалық ғылымға айналды. Бұл кезең органикалық синтез химиясының дамуымен байланысты. Осы кезде тоқыма өнеркәсібіне арналған бояулар шығару, дәрі-дәрмек, жасанды жібек алу мүмкіндігі туды. Бұл кезең — құрылымдық химия кезеңі деген шартты атауға ие болды, оның басты жетістігі — молекула құрылымы мен заттардың функционалдық белсенділігінің арасындағы байланысты анықтау болды. Химия дамуының үшінші кезеңі — XX ғасырдың бірінші жартысын қамтиды. XX ғасырдың алғашқы жартысындағы автомобиль өндірісінің, авиацияның, энергетикалық, құрал-жабдық шығарудың дамуы материалдар шығаруға жаңа талаптар қойды. Жоғары октанды мотор отынын, арнаулы синтетикалық каучук пен пластмасса, беріктігі аса жоғары изоляторлар, органикалық және бейор-ганикалық полимерлер, жартылай өткізгіштер шығару қажеттілігі туды. Бұндай материалдарды алу үшін бұрыннғы заттың құрамы мен құрылымы туралы химиялық білім жеткіліксіз болды. Құрылымдық химия зат қасиеттерінің температураның, қысымның, еріткіштердің тағы басқа факторлардың әсерінен өзгеретіндігін есепке алмаған болатын. Осыған байланысты, осы кезеңде химия ғылымы процестер мен заттардың езгеру механизмі туралы ғылымға айналды. Осының нәтижесінде қурылыс жумыстарына қажетті ағаш пен металдың орнына синтетикалық материалдар, тамақ шикізаттарын, олиф, лак, жуғыш заттар тағы басқа өндіруді қамтамасыз етті. Ал каучук, этил спирті, жасанды талшық өндіру мұнай шикізатына, азот тыңайтқыштарын алу — ауа азотына негізделді.. Енді үздіксіз жүйемен жұмыс істейтін мұнай-химия өнеркәсібі дамыды. Егер 1935 жылы тері, резина, талшық, жуғыш заттар, лактар, олиф, сірке қышқылы, этил спирті толығымен тек жануарлар мен өсімдіктер шикізатынан алынатын болса, ал XX ғасырдың 60-шы жылдарында техникалық спирттің 100%-ы, жуғыш заттардың 80%-ы, олиф пен лактың 90%-ы, талшықтың 40%-ы, каучуктың 70% және тері материалдарының 25%-ға жуығы газ және мұнай шикізаттарынан алынды. Сонымен бірге химия жылына мыңдаған тонна малға азық-түлік ретінде қолданылатын мочевина мен белок және миллиондаған тонна тыңайтқыш берді. Сонымен, химия өзінің дамуының үшінші кезеңінде заттар туралы ғылым емес, заттардың өзгеруі мен өзгеру механизмдері туралы ғылым болды. Химия ғылымы дамуының төртінші кезеңі — XX ғасырдың екінші жартысы. Бұл кезеңді эволюциялық химия кезеңі деп атайды. 2. Иондық байланыс Мысалдар 169 бет Химиялық байланыс — атомдардың химиялық қосылыс түзіп әрекеттесуі. 19 ғасырдың басында К.Бертолле Химиялық байланыс түзілуінің гравитациялық, 1810 жылы Й.Я Берцелиус электрхимиялық, 1861 жылы орыс ғалымы А.Н Бутлеров заттардың химиялық құрылыс теориясын, 1915 жылы неміс физигі Кассель, 1916 жылы ағылшын ғалымы Г.Льюис электрондық теорияларын ұсынды. Кванттық механика көзқарасы тұрғысынан Химялық байланыс валенттілік сұлба және молекулалық орбиталдар әдісімен түсіндіріледі. Химиялық байланыс түзілуіне қарай төртке бөлінеді:
Иондық байланыс - иондардың арасында электрстатикалық тартылыс күшінің әсерінен түзілетін байланыс. Оң зарядты иондар - катиондар, ал теріс зарядты иондар - аниондар. Нағыз металдар (I, ІІА) мен нағыз бейметалдардың (VI-VIIА) арасында иондық байланыстар түзіледі. Иондық байланыс тұздарда, негіздерде және қышқылдарда да байқалады. Иондардың зарядтары араб цифрларынан кейін көрсетіліп, элемент таңбасының оң жағын ала жазылады. Иондық байланыс металдық және бейметалдық қасиеттері айқын,электртерістілік шамасының айырымы көп ажыратылатын элементтер атомдары арасында түзіледі Иондардың,катиондар мен аниондардың электростатикалық тартылуы есебінен түзілетін байланыс иондық байланыс деп аталады. Иондық байланыстың сипаттамалары: Иондық байланыста иондар әр түрлі бағытта тартылатындықтан бағыты болмайды.Оның күш өрісі компенсацияланбаған, сондықтан иондық байланыс қанықпаған. Иондық байланыс пен ковалентті байланыстың пайда болуы механизмінде ерекшеліктер жоқ. Олар молекулалық электрондық бұлттың полюстену дәрежесімен ерекшшеленеді. Таза иондық байланыспен байланысқан зат жоқ.Әдетте иондық байланыстың дәрежесімен анықтайды.Мысалы:натрий хлоридінде -0,84. 3. Алюминий гидроксиді (Al(OH)3) құрамындағы элементтердің массалық үлесін есепте Шешуі: 1. Al(OH)3 алюминий гидроксидінің Менделеев таблицасы бойынша молярлық массасын табамыз, ол Al(OH)3 М=27+48+3 =78 грамм/моль 2. Оның құрамына кіретін үш элементтің атомдық массаларын молярлық массаға бөлеміз және коэффициенттерін ескереміз, сонда массалық үлестерін табамыз: алюминий: 27/78 = 0,3461 = 34,61% оттек: (3*16)/78 = 0,6153 = 61,53% сутек: (3*1)/78 = 0,0384 = 3,84% №2 Билет 1 Заттардың және олардың физикалық қасиеттері Химия осыған дейін өздерің оқып үйренген география,биология, физика сияқты жаратылыстану ғылымдарының бірі. Мұнан баска химия ғылымы геология, экология, т. б. ғылымдармен терең астасып жатады. Ғылым салаларының бұлай байланысып жатуы дүниенің біртұтастығынан, оны оқып білуге әр жағынан келуге болатындығын көрсетеді. Химия ғылымының энергетикалық, экономиялық, экологиялық, ауыл шаруашылык, медициналық және тағам өндірісіндегі мәселелерді шешудегі маңызы да орасан зор. Химия - заттар және олардың өзгерістері туралы ғылым. Заттар дегеніміз денелердің құраушылары, мысалы, күнделікті өмірде шыныдан, пластмассадан және металдан жасалған құйғыштар пайдаланылады (су, сүт, бензинқұйғанда). Бір дене әр түрлі заттан жасалған. Физикалық денелер - бізді коршаған бұйымдар. Денелердің массасы мен көлемдері болады. Ағаштан орындық үстел, төсек, т.б. үй жиһаздары жасалады. Бұл мысалда бір заттан әр түрлі денелер дайындалатынын көреміз. Заттардың өзара ұқсастығы мен айырмашылықтарын көрсететін белгілері олардың қасиеттері деп аталады. Оларға заттың агрегаттық күйі, түрі, түсі, тығыздығы, балқу және қайнау температуралары, жылу және электрөткізгіштктері, ерігіштіктері жатады. Мысалы, шыныдан, пластмассадан жасалған шөлмектер алып, оларды ұрып көрсек, шыны шөлмек оңай сынатынын, ал қыздырғанда пластмасса шөлмек оңай балқып, олардың пішіндерінің өзгеретінін байқаймыз. Мұндай өзгерістер физикалық құбылыстар деп аталады. Ал енді осы шөлмектерді жағып көрсек, ең оңай өзгеретіні - пластмасса шөлмек, ол алдымен балқып, сосын қара күйеленіп жанады, ал шыны мен металдан жасалғандары Мұндай өзгеріске түсу үшін оларды өте жоғары температураға дейін қыздыру керек. Бір заттың екінші бір затқа айналуы химиялық құбылысқа жатады, мысалы, сүт тасып кеткенде ол күйіп, көмірленеді. Пластмасса жанғанда басқа заттар тұзіледі. Физикалық құбылыс кезінде заттардың табиғаты өзгермейді, тек олардың агрегаттык күйі мен пішіні өзгереді, жаңа зат пайда болмайды. Химиялық құбылыс кезінде бір зат басқа жаңа бір затқа айналады. Заттардың химиялық қасиеттерін химия ғылымы зерттейді. Осы кезде сан алуан заттар белгілі, олардың саны күн өткен сайын артып отыр, себебі тұрмыстық және өндірістік кажеттіліктерді қанағаттандыру үшін қасиеттері әр түрлі заттар жасанды жолмен алынуда. Заттардың қасиеттерін жете білу оларды саналы түрде колдана алуға мүмкіндік береді. «Білмеген у ішеді» деген мақалда халықтың көп жылғы бақылауынан түйген даналық ой айтылған. Шынында да қасиетін білмей тұрып кез келген затты иіскеп, колға алып уқалап немесе дәмін татып көруге болмайды: себебі күйіп, тіпті уланып қалу қаупі бар. Химияның атқаратын көптеген маңызды міндеттері бар. 1. Заттардың құрамы мен қасиеттерін зерттеу. 2. Қоғамның кажеттілігіне карай жаңа сапалы заттар алу. 3. Қоршаған ортаның байлығын тиімді пайдаланып, оларды корғау. Біздің киген киіміміз, ішкен асымыз, тұтынып отырған заттарымыз — бәрі де химиялық қосылыстар. Тіпті біздің өмір сүруіміздің өзі ағзаларда жүретін химиялық құбылыстарға негізделген. 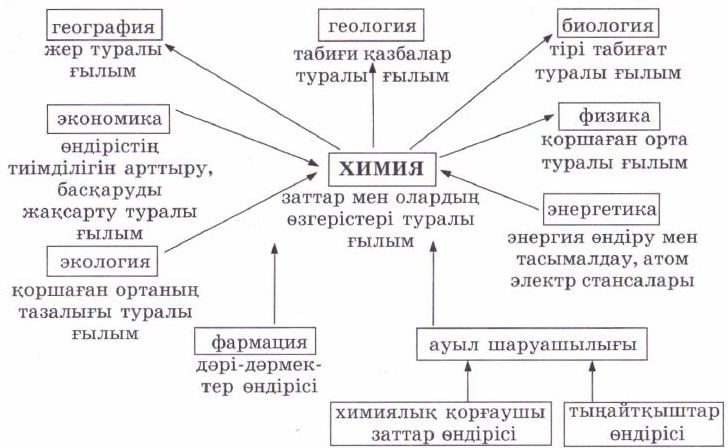 2 Ковалентті байланыс дегеніміз не? Мысалдар. Коваленттік байланыстың пайда болуы қарапайым молекула – сутек молекуласының түзілуі мысалында жақсы түсіндіріледі: 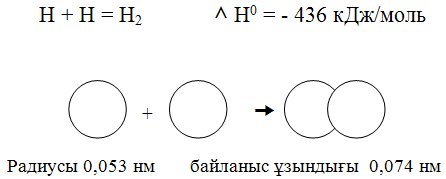 Атомдар жақындасқанда олардың электрондық бұлттары бүркесіп, ядроларының арасындағы кеңістікте максимал электрон тығыздығы бар молекулалық бұлт түзіледі. Ортақ ядролардың тығыз теріс зонаға тартылуы оларды жақындастырады, байланыс ұзындығы 0,074 нм және тұрақты сутек молекуласын түзіліп, энергия ұтымына әкеледі. Қарама-қарсы спиндері бар жұптаспаған екі s- электрондарының қосылуын кванттық ұяшықтарда сызбанұсқамен былай белгілейді: Демек, ортақ электрондық жұп есебінен жүзеге асырылатын химиялық байланыты коваленттік байланыс деп атайды. Коваленттік байланыстың екі түрі бар: полюссіз және полюсті. Коваленттік полюссіз байланыста электрондардың жалпы жұбынан түзілген электрон бұлт – байланыс бұлты (тығыз электрондық аймақ деп аталады) екі атомның ядроларына қатысты кеңістікте симметриялы таралады. Мысалы, бір элементтің атомдарынан тұратын молекулалар: Н2, Cl2, N2, O2, F2 және т.б. Коваленттік полюсті байланыстарда бүркесу зонасы электртерістігі үлкен атомға ығысқан. Мысал ретінде газтектес хлорсутектің түзілуін қарастырайық: ® ® ® ® Н ® + ® Cl : g Н (:) Cl : немесе Н - Сl ® ® ® ® Байланыс s- және p- электрондардың ортақ жұптарының түзілу есебінен пайда болады. Коваленттік байланыс электрондық орбитальдардың бүркесу тәсілі бойынша да ерекшеленеді. Коваленттік байланыстың екі маңызды сипаттамасы бар: байланыс ұзындығы және байланыс энергиясы. Байланыс ұзындығы ядроаралық қашықтықтың шамасына сәйкес келеді. Байланыс ұзындығы неғұрылым аз болса, химиялық байланыс соғұрылым берік болады. Байланыс энергиясы молекуладағы бар байланысты үзуге қажет энергияға тең. Коваленттік байланыс түзілуінің донорлы-акцепторлы механизмдері бар. Донор - бұл бос электрондық бұлты бар атом, ал акцептор- бұл электрон жұбын қабылдауға қабілетті бос орбиталы бар бөлшек. 3 Темір (III) оксидінің Fe2O3 40 грамында қанша грам темір бар екендігін табыңдар Шешуі: Темір мен темір (ІІІ) оксидінің молярлық массаларын және массаларын табамыз. 1) Аr(Ғе) =56, М(Ғе)= 56 г/моль, Ғе2О3 құрамында 2 моль Ғе бар (индекс) бойынша; m(Ғе) =2 моль* 56 г/моль =112 г 2) Mr (Ғе2О3)=2*Ar(Ғе)+ 3 Ar(O)=2*56+3*16=160 Mr(Ғе2О3)= 160г/моль m(Ғе2О3)= 1моль*160г/моль=160г 3) 40г темір (ІІІ) оксидінің құрамындағы темірдің массасын табамыз. Ол үшін пропорция құрамыз. Формула бойынша: 160 г Ғе2О3 құрамында 112г Ғе бар. Есептің шарты бойынша: 40 г Ғе2О3 ------------ х г Ғе болады. 160/40=112/х пропорцияны шешсек: х=40*112/160=28г Жауабы: Темір (ІІІ) оксидінің 40 грамында 28 г темір болады. №3 Билет 1 Атом молекулалық ілімнің қағидаларын мысалдар келтіре отырып осы ілімнің қалыптасуына қай елдің ғалымдарының үлесі болды? Атом - молекулалық ілім. Дальтонның атом-молекулалық ілім туралы негізгі қағидалары қандай? XVIII ғасырдың 40-жылдары химия жеке ғылым ретінде қарастырыла бастады. Сол кезде, орыстың ұлы ғалымы М.В.Ломоносов “Математикалық химияның элементтері” атты жұмысында атом-молекулалық көзқарасты алғаш рет ұсынды. Онда былай тұжырымдалған: 1.Барлық заттар корпускулалардан тұрады. 2.Корпускулалар элементтерден тұрады 3.Бөлшектер – молекулалар мен атомдар үнемі қозғалыста болады. 4.Жай заттардың молекулалары бірдей атомдардан, кұрделі заттың молекулалары әр түрлі атомдардан тұрады. Молекула дегеніміз осы заттың химиялық қасиеттерін сақтап тұратын ең кіші бөлшегі. Молекуланың өзі атомдардан тұрады. Атом дегеніміз оң зарятталған атом ядросынан және теріс харятталған электрондардан тұратын электронейтрал бөлшек. Атомдардың массасы, қасиеттері бірімен-бірі әрекеттесуі арқылы күрделі заттар түзілуі, атомдардың арасындағы байланыс XIX ғасырдағы химиктер мен физиктердің зерттейтін жұмысына айналды. Джон Дальтон Химиялық “философияның жаңа жүйесі” атты жұмысында атом-молекулалық көзқарасты талқылайды. Ол сонымен қоса алғаш рет атомдық салмақ деген ұғымды кіргізді. Дальтон өз пікірін былай тұжырымдайды: 1.Барлық зат өте кішкене бөлшектерден – атомдардан тұрады. 2.Жай заттар одан әрі бөлінбейтін бір біріне ұқсас жай атомдардан, ал күрделі заттар күрделі атомдардан тұрады. Күрделі атомдар реакция кезінде жай заттардың атомдарына ажырайды. 3.Күрделі заттың күрделі атомдары әр түрлі жай атомдардың аз ғана санынан құралады. Мысалы: NO, NO2, N2O5 т.с.с. 4.Күрделі атомның массасы оны қоршаушы жай атомның массаларының қосындысына тең. Бұл теорияның Ломоносов теориясынан өзгешелігі жай заттың молекулалары болмайды деген қате тұжырымды шығарған. Алайда Дальтонның сандық сипаттағы масссаны енгізуі үлкен табыс болды. 2 Атомның құрамы және құрылысы 143, 145 бет 1911 жылы ағылшын физигі Резерфордтың атом ортасында оң зарядты ядро, ал оның айналасында электрон бұлтын түзе қозғалатын электрон бар деген теориямен толықтыру.Американ физигі Милликен электрон теріс заряд көрсете- тінін тәжірибе жүзінде дәлелдеп,оны бірге тең деп қабылдады. Атом жалпы электр- бейтарап болғандықтан, электрондар зарядының жалпы саны ядро зарядына тең. Ал 1913 жылы Резерфордтың шәкірті Г.Мозли атом ядросындағы зарядтардың шамасы элементтің периодтық жүйедегі рет нөміріне тең болатындығын анықтады. Мозлидің ашқан жаңалығынан кейін Менделеевтің жасаған периодтық жүйесіндегі Ar–K,Co–Ni,Te–I элементтердің орындарының алмасуы заңды екені анықталды. Осыған байланысты, элементтердің реттік нөмірі атом ядросындағы оң зарядтың санын,сол сияқты ядро айналасында қозғалатын электрондар санын көрсетеді. Реттік нөмірдің физикалық мәні осында. Элементтердің реттік нөмірі – оның атом ядросының заряды. Атомның ядро заряды химиялық элементтердің қасиеттерін сипаттайтын маңызды шама. Атом құрылысын одан әрі зерттеу кезінде құрамына протондар мен нейтрондар деп аталатын бөлшектер кіретіні анықталды. Атомның элементар бөлшектері:
1. Элемент атомының массасы протон мен нейтрон массасының қосындысына тең. 2. Ядродағы протон саны элементтің реттік нөміріне тең. А = Z + N; A – атомдық масса; Z – протон; N – нейтрон; Табиғатта атомдық массасында айырмашылығы болатын бірдей элементтер атомы болады. Мысалы, хлор элементінің массасы 35 және 37 болатын екі түрі кездеседі. Бұл атомдардың ядросында протондар саны бірдей,ал нейтрондар саны әр түрлі. Олар изо- топтар. Изотоптар – ядро зарядтары бірдей,атомдық массалары әртүрлі атомдардың түр өзгерістері. Изотоп – бірдей орында деген мағнаны білдіреді. Изотоптарда протон мен электрон саны бірдей, нейтрон сандары әртүрлі. Әрбір изотоп екі түрлі шамамен өлшенеді: массасы және элементтің рет нөмірі. Мысалы: сутегінің изотоптары, аттары: протий, дейтрий, тритий . Элементтердің атомдық массалары бөлшек сандармен өрнектеледі. Мысалы, хлор элементінің с.а.м. 35,5. Бұл ұғымдардың айырмашылығын түсіндіру үшін мынадай мысалдар келтіріледі. Табиғаттаизотобы 75%, ализотобы 25% таралған. Осыдан хлор элементінің орташа с.а.массасы шығады: Аr(CI) = 35∙0,75+37∙0,25 = 35,5 3 Алюминий оксидінің Al2O3 қандай массасында 15.5 г алюминий болады Шешуі: Mr (Al2O3) = 27*2+3*16= 54+48=102 102/15,5 = 54/ х х =15,5*54/102= 8,2 г №4 Билет 1. Атомдар, молекулалар дегеніміз не? 44 бет ХХ ғасырдың басында атомның да күрделі бөлшек екені, оның өзінен де кіші бірнеше бөлшектерге бөлінетіні белгілі болды. Бірнеше атомдардың өзара байланысуынан молекула түзіледі. Атом дегеніміз - химиялық жолмен бөлінбейтін затттың ең ұсақ бөлшегі; Молекула дегеніміз - заттың қасиеттерін бойына жинаған оның ең кіші бөлшегі; Айырмашылы: атом ең кішісі, молекула атомнан үлкені; Атомда белгілі бір қасиеттер болмайды, ал молекулада заттың химиялық, физикалық қасиеттері жиналады; Атомдар мен молекулалардың кристалдағы орналасу ретін, олардың жалпы сұлбасын қазіргі электрондық микроскоптар мен иондық проекторларда көруге болады. Жекелеген атомдар-химиялық элементтердің, ал молекулалар заттардың ең кіші бөлшектері. Әр түрлі заттардан денелер құралады. 2. Тотығу тотықсыздану реакциялары мысалдар 144 бет Тотығу-тотықсыздану - электрондардың бір атомнан екінші атомға жаппай немесе жартылай ауысуына негізделген химиялық әрекеттесу үлгілерінің үлкен тобы. Тотығу дегеніміз— атомның немесе атомдар тобының өз электрондарын беруі нәтижесінде өз валенттілігін өсіруімен сипатталатын химиялық әрекет; тотықсыздану — атомдардың немесе иондардың электрондарды өзіне қосып алуы, сөйтіп өз валенттілігін төмендету. Органикалық заттар химиясында тотығу әрекет өрекетінің мысалы ретінде заттың оттегін өзіне қосып алуы ал, тотықсыздану әрекетінің мысалы ретінде заттың сутекпен әрекеттесуі алынады. Валенттілік электрондары электртерістілігі кіші атомдардан электр терістілігі үлкен атомдарға ауысатын немесе ығысатын процестер тотығу-тотықсыздану реакциялары деп аталады. 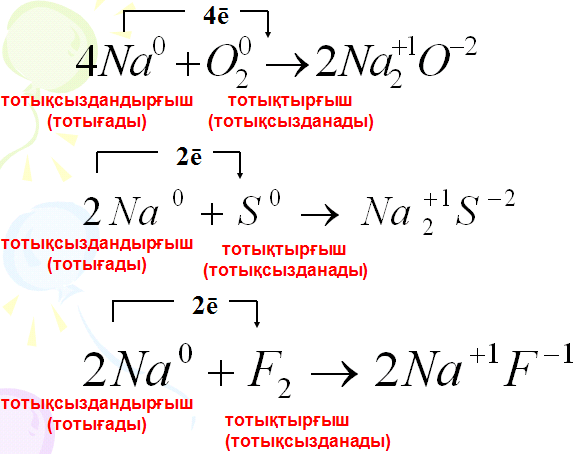 3. Құрамында 32г мыс болса, Сu2O массасы қандай? Шешуі: Мыстың молярлық массасы 64г/моль, демек 1 моль Сu2O (купритте) 128 грамм мыс бар. 32 г мыс болу үшін 0,25 моль куприт алу қажет. M(Cu2О) =64*2+16=128+16=144 г/моль куприт массасы = 144*0,25=36 грамм жауабы - 36 грамм Немесе есепті шешудің 2-ші жолы: В М (Сu2О) содержится 2А (Си) В Х (г) (Сu2О) содержится 32 (г) Си Х=144*32:64:2=36 грамм №5 Билет 1. Химиялық элементтер, олардың таңбалары және атауы. Оны кім шығарды? Химияның негізгі түсініктерінің бірі — элемент. Элемент дегеніміз атомдардың жеке түрі. Бұл түсінікті химия ғылымына ағылшын ғалымы Р. Бойль енгізген. Қазіргі кезде химиялық элементтердің 108 түрі белгілі, олардың ішінде 89-ы табиғатта кездессе, қалған 19-ы жасанды жолмен алынған.  Химиялык әдебиетте элементтерді өздеріне тән таңбалармен белгілеу қабылданған, Бұл дәстүрді швед ғалымы Й.Я. Берцелиус ұсынған. Элементтердің таңбалары олардың латынша атауларының бірінші және келесі әріптердің бірімен белгіленеді. Мысалы, сутек - Hydrogenium (Н), оттек - Oxygenium (0), темір - Ferrum (Fе), мыс - Cuprum (Cu), сынап - Hydrargyrum (Hg), күкірт - Culfurum (S) т.б. Элемент таңбасының алдында тұрған сан коэффициент деп аталады, ол атомдар санын көрсетеді (5Fе, ЗН). Жай заттардың молекулалары бірдей атомдардан тұрады, мысалы, Fе,Cu; ал газ тектес жай заттардың молекулалары бірнеше атомнан тұрады, олардың сандары индекспен көрсетіледі, мысалы, 09, Н2. Индекс элемент таңбасының оң жағына астына жазылады.Кейбір жай заттардың атаулары оларды құрайтын элементтің атауымен сәйкес келеді, мысалы, күкірт - S, азот - N2, оттегі - 02, темір - Fе, мыс -Cu, т.б. Судың құрамында оттек элемент күйінде болса, ауаның құрамында жай зат күйінде болады, сондықтан ауадағы оттегімен тыныс алуға болады және ол жануды колдайды, ал судағы оттек Бұл мақсаттарға пайдаланылмайды. Сутегі (Н2) жанады, ол жай зат; ал судың Н20 құрамындағы сутек (Н) жанбайды, ол элемент. Атомдар мен молекулалар өте кішкентай бөлшектер, сондықтан оларды көзбен көріп, қолға алуға болмайды. Металдарға ортақ кейбір қасиеттері: металдык жылтыры, электр және жылу өткізгіштігі, оңай соғылып тапталатындығы, т.б. Ал бейметалдардың ортақ қасиеттері болмайды. 2. Экзотермиялық және эндотермиялық реакциялар дегеніміз не? Кез келген химиялық реакцияларда бір зат басқа затқа айналғанда жылу бөлінеді немесе сіңіріледі. Сондықтан барлық реакцияларды экзотермиялық және эндотермиялық деп бөледі. Яғни, экзотермиялық реакция дегеніміз - жылу бөле жүретін реакция, ал эндотермиялық реакция дегеніміз - жылу сіңіре жүретін реакциялар. Бұл реакциялар термохимиялық теңдеулермен өрнектеледі. Термохимиялық теңдеулердің басты ерекшелігі, оларда жылу эффектісінің шамасы көрсетіледі. Реакция жылу эффектісіне қарай: 1. Экзотермиялық - жылу бөле жүретін реакциялар. мысалы, C+O2=CO2+Q 2. Эндотермиялық - жылу сіңіре жүретін реакциялар. Мысалы, CaCO3=CaO+CO2-Q 3. 1.5 моль натрий сульфаты Na2SO4 берілген. Осы тұздың массасын тап. Шешуі: Зат мөлшерінің массамен байланысты формуласы арқылы V=m/M зат массасын табамыз:m=v*M сан мәндерін орнына қойсақ: M (Na2SO4)= 142 г/моль. m= (Na2SO4)=1.5 моль *142 г/моль=213 г. Жауабы: 1.5 моль натрий сульфатының массасы 213г Немесе есепті шешудің 2-ші жолы: M(Na2SO4)=142 m=n*M=1,5*142=213 №6 Билет 1. Жай және күделі заттар. Салыстырмалы атомдық масса. Салыстырмалы молекулалық масса анықтама және мысал келтір Элементтердің таңбалары әліпбидін, әріптері тәрізді. Әріптерден сөз құрауға болатыны секілді элементтердің таңбаларын қолданып кез келген молекуланың құрамын өрнектеуге болады. Химиялық формулалар заттың сапалық және сандық құрамын көрсетеді, сандық құрамы индекстер аркылы белгіленеді (бір саны жазылмайды). Жай заттар үшін элементтің таңбасы - формуласы да болады: Ғе, Cu, Ag, Ar. Мысалы, Н20 (аш екі о) судың формуласы, су молекуласы сутек пен оттек элементтерінен (сапалык құрамы) және сутектің екі атомы мен оттектің бір атомынан (сандық құрамы) тұратынын көрсетеді. Формуланың алдындағы коэффициенттер молекулалар санын көрсетеді. Мысалы, 5S02(бес эс о екі), Р20. (рэ екі о бес), т.б. 1. Формулалар бойынша зат күрделі немесе жай зат екенін анықтай аламыз:02 - жай зат; Н20 - күрделі зат. 2. Молекула құрамына кіретін элемент атомдарының сандарының ара қатынасын анықтауға болады. NaOH - Бұл қосылыста атомдар сандарының қатынасы 1:1:1 болады, ал CuS04 молекуласында бұл қатынас - 1:1:4 3. Заттың формуласы бойынша оның молекулалык массасын аныктауға болады. 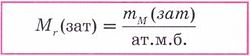 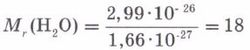 Салыстырмалы молекулалық масса деп зат молекуласы массасының атомдық масса бірлігінен неше есе ауыр екенін көрсететін шаманы айтады, ол МR деп белгіленеді. Бұл шама молекуланың абсолюттік массасы деп аталады. Зат молекуласы атомдардан тұратындықтан, оның салыстырмалы молекулалық массасын табу үшін зат құрамына кіретін элементтердің салыстырмалы атомдық массаларын (АR) индекстеріне көбейтіп қосамыз. Мысалы, CuS04 молекуласының салыстырмалы молекулалық массасы: Mr(CuS04)=Ar(Cu)+Ar(S)+4Ar(0) Mr(CuS04)=64+32+4 • 16=160 Енді осы заттың бір молекуласының массасын табу үшін формуланы пайдаланамыз. mM(CuS04) = 160 • 1,66 • 10−27 = 2,66 • 10-25 кг. 2. Негіздер: құрамы, жіктелуі, химиялық қасиеттері, алынуы. 119 бет Негіздер– ерітінділерінде бір немесе бірнеше гидроксид иондарын түзіп, диссоциацияланатын күрделі заттар. Егер элемент бірнеше гидроксид түзетін болса, оның тотығу дәрежесі рим цифрымен көрсетіледі. Мысалы, Cu(OH)2 – мыс (ІІ) гидроксиді, CuOH – мыс (І) гидроксиді. Негіздердің көпшілігі суда ерімейді немесе аз ериді. Суда жақсы еритін Негіздерді сілтілер деп атайды. Оларға LіOH, NaOH, KOH, RbOH, CsOH, Sr(OH)2, Ca(OH)2, Ba(OH)2, NH4OH (NH3*H2O аммиак суы) жатады. Сілтілердің судағы ерітінділері теріні, матаны, т.б. күйдіреді. Осыған байланысты кейде оларды күйдіргіш калий, күйдіргіш натр, т.б. деп те атайды. Құрамында екі не үш гидроксид тобы бар Негіздер ерітіндіде сатыланып диссоциацияланады. Мысалы, Ca(OH)2*Ca(OH)++OH (бірінші саты), Ca(OH)+Ca2++OH– (екінші саты). Сонымен қатар бір мезгілде қышқылдық және негіздік типпен диссоциациялана алатын Негіздер (гидроксидтер) де болады. Негіздердің маңызды химиялық қасиеттері олардың қышқылдармен, қышқылдық және амфотерлік оксидтермен немесе гидроксидтермен тұз түзе әрекеттесуі. Сілтілік металдар гидроксидтері қыздыруға төзімді. Суда жақсы еритін Негіздерді негіздік оксидтерін сумен тікелей әрекеттестіру арқылы алады. Мысалы, CaO+H2O*Ca(OH)2. Суда аз еритін немесе ерімейтін Негіздерді сәйкес элементтің тұзына ерімтал гидроксидтермен әсер ету арқылы жанама жолмен алады. Мысалы, FeCl3+ +3NaOH Fe(OH)3+ 3NaCl. 3. Массасы 10г неон газында қанша атом болатынын табыңдар Берілгені: m (Nе) = 10 г Шешуі: n(зат саны) = 10/20=0,5 моль n (Nе) = 0,5 * 6,02 * 1023 = 3,01 * 1023 №7 Билет 1. Химиялық формула. Химиялық элементтердің валенттілігі дегеніміз не және валенттілік термині нені білдіреді? 35 бет. Химиялық формула — химиялық жеке заттар молекуласының құрамын химиялық таңба және сан арқылы белгілеу. Химиялық формула молекуланың сапалық және салмақ құрамын көрсетеді. Мысалы, жай зат күйіндегі оттек молекуласының химиялық формуласы — О2, күрделі зат аммиактың химиялық формуласы — NH3. Бұл химиялық формулада оттек молекуласында екі атом оттек, яғни оның 32 салмақ бөлігі бар екендігін, ал екіншісінің бір молекуласының құрамында бір атом азот және үш атом сутек, яғни олардың өзара қатынасы 14:3, жалпы салмағы 17 салмақ бөлігі екендігін көрсетеді. Химиялық формула бойынша химиялық қосылыстар құрамындағы элементтердің пайыздық мөлшерін есептеуге болады, керісінше, химиялық қосылыстар құрамындағы элементтердің пайыздық мөлшері белгілі болса, олардың формулаларын табуға болады. Cr2O3-тегі (хром тотығы) элементтердің пайыздық мөлшерін есептегенде, оның м16:152=31,6%. Хром тотығының пайыздық құрамы бойынша оның химиялық формуласы табылады. Ол үшін қосылыс құрамындағы элементтердің берілген салмақ қатынасын грамм-атом қатынасына айналдырады. 68,4 г хром 68,4:52=1,32 г-атом, 31,6 г оттек 31,6:16=1,98 г-атом болады. Кез келген молекуладағы52:152=68,4%. Оттектің %-дық мөлш.: 316=152. Хромның %-дық мөлшері 252+3олекулалық салмағы 2 атомдар қатынасы бүтін сан болуы керек. Мысалы, 1,32:1,98 қатынасын ең кіші бүтін сан қатынасына келтірсек 2:3 болады, бұған сай хром тотығының формуласы Cr2O3. Молекула құрамындағы атомдар қатынасы ең кіші бүтін санмен берілген формуланы қарапайым немесе эмпирикалық формула деп атайды. Молекула құрамында әрбір элементтен неше атом бар екенін дәл көрсететін формуланы нақты немесе молекулалық формула деп атайды. Химиялық қосылыстың нақты формуласын табу үшін, оның салмақ құрамын білумен қатар тәжірибе арқылы анықталған молекулалық салмағын да білу қажет. Сондай-ақ химиялық формуланываленттілік бойынша да құрастыруға болады. Валенттілік, іліктілік (лат. valentіa — күш) — атомның басқа атомдарды немесе атомдар тобын қосып алып химиялық байланыс құру қасиеті. Валенттіліктің мәні берілген элементтің атомы ала алатын немесе орнын баса алатын сутек атомдарының санымен өлшенеді. Химияға валенттілік ұғымын 1853 ж. ағылшын химигі Э.Франкленд (1825 — 1899) енгізген. А.М. Бутлеровтың қосылыстардың химиялық құрылысы теориясына (1861) Валенттілік негіз болды, Д.И. Менделеевтің химиялық элементтердің периодтық жүйесін ашуына (1869) байланысты бұл ұғым одан әрі дамыды. Менделеев элементтің валенттілікінің оның периодтық жүйедегі орнымен байланыстылығын тапты, айнымалы валенттілік туралы ұғымды енгізді, элементтің сутекпен және оттекпен қосылыстарындағы валенттіліктерінің өзара байланысын көрсетті. Валенттілік рим цифрларымен белгіленеді, формулаларда элемент таңбасының үстіне жазылады, мәні I-VIII-гe дейін өзгереді. Валенттілік бойынша формула құру үшін элементтердің валенттіліктерінің ең кіші ортак еселігін тауып, әр элементтін валенттілігіне бөліп, индекс етіп жазамыз. Егер элемент қосылыстарында айнымалы валенттілік көрсетсе, онын, атауында элементтің валенттілігі рим цифрымен жақшаның ішінде көрсетіледі. 2. Қышқылдар: құрамы, жіктелуі, химиялық қасиеттері, алынуы.Мысал келтір 87, 90, 122 бет Қышқыл — химиялық қосынды, көк лакмус қағазына қызғылт рең беретін ерітінді, дәмі қышқыл. Қышқылдарқұрамына қарай оттекті, оттексіз болып, олардағы сутек атомдарының сандарына қарай бір және көп негізді деп бөлінеді. Азот, тұз, күкірт қышқылдары сұйық заттар, ал фосфор және бор қышқылы (Н3BО3) - қатты заттар болса, кремний қышқылы суда ерімейтін іркілдек зат. Көмір және күкіртті қышқылдары тұрақсыз, оңай айырылатын заттар. H2CO3→CO2↑+H2O; H2SO3→H2O|+SO2↑ Қышқылдардың құрылысының формуласын жазғанда әуелі сутектің таңбасын шетіне жазамыз, өйткені ол бір валентті элемент. Кейбір қышқылдардың тарихи қалыптасқан атаулары бар: HCl - тұз қышқылы, HF -балқытқыш қышқыл; Н2РO4 - сутектің ортофосфаты, ал Н2СO3 - сутектің карбонаты деп аталады. Ал халықаралық номенклатура бойынша Н2РO4 тетраоксотригидрофосфат деп молекула құрамындағы атомдардыңсандары грек сандарымен көрсетіліп аталады. Қышқылдарға сәйкес келетін оксидтерді қышқылдардың ангидридтері (сусыз қышқыл) деп атайды. Оттексіз қышқылдарды жай заттардың тікелей әрекеттесуі (синтез әдісі) бойынша алады: H2+Cl2=2HCl H2+S=H2S Түзілген газдарды суда еріткенде қышқылдар алынады. Кейбір оттекті қышқылдарды сәйкес оксидтерін сумен әрекеттестіріп алады: SО2+H2О=H2SО3 SО3+H2О=H2SО4 Егер фосфорды жағып алып, түзілген ақ буға су қосып шайқасақ, ерітінді лакмусты қызғылт түске бояйды, себебі мына реакциялар жүреді: 4P+5O2=2P2O5 P2O5+3H2O=2H3PO4 қышқылдық оксид + су = қышқыл Кейбір ұшқыш, тұрақсыз және ерімейтін қышқылдарды олардың тұздарына концентрлі қышқылмен әсер етіп алуға болады. Ас тұзының кристалдарына концентрлі күкірт қышқылын қосқанда хлорлы сутектің ақ тұманы газ күйінде бөлінеді, оны суда ерітіп тұз қышқылын аламыз. NaCl+H2SO4=2HCl↑+Na2SO4 Осы реакцияны кеңсе желіміне концентрлі тұз қышқылымен әсер етіп көрсетеміз. Na2SiО3+ 2HCl = H2SiO3↓ + 2NaCl |
