Химия Билет. 1 Билет Химия ылымыны пайда болуы, дамуы жне маызы
 Скачать 1.16 Mb. Скачать 1.16 Mb.
|
Химиялық қасиеттеріХимиялық белсенді, өте күшті тотықтырғыш:сутегімен реакцияласады,металдармен және бейметалдармен де реакцияласады: 3Cl2 + 2Fe = 2FeCl2 2Cl + Si = SiCl4 Суда және сілтілердің судағы ерітінділерінде дисмутацияланады: Cl2 + 2NaOH(суық) = NaClO + NaCl + H2O 3Cl2 + 6NaOH(ыстық) = NaClO3 + 5NaCl + 3H2O Cl2-нің алынуы және қолданылуыХлорды алу: a) өнеркәсіпте 2KCl(балқыма) → 2K + Cl2↑ 2NaCl + 2H2O→ H2↑+Cl2↑ + 2NaOH ә) зертханада 1) 4HCl(конц.) + MnO2 = Cl2↑ + MnCl2 + 2H2O 2) 16HCl(конц.) + 2KMnO4 = 5Cl2↑ + 2MnCl2 + 8H2O + 2KCl 3) 4HCl(конц.) + Ca(ClO)2 = 2Cl2↑ + 32H2O + CaCl2 4) 6HCl(конц.) + KClO3 = 3Cl2↑ + 3H2O + KCl Конмутация (3) және (4) реакцияларында әрі тотықсыздандырғыш HCl, әрі тотықтырғыштар Ca(ClO)2 және KClO3 хлор берушілер болып келеді.Хлор - негізгі химиялық өндіріс өнімдерінің бірі, бром мен йодты, хлоридтерді, құрамында оттегі бар туындыларды алу үшін қолданылады. Қағазды ағартады, ауыз суды дезинфекциялауға пайдаланады. 3. 72г суды айырғанда шығатын сутек пен оттектің массасын табыңдар Шешуі: 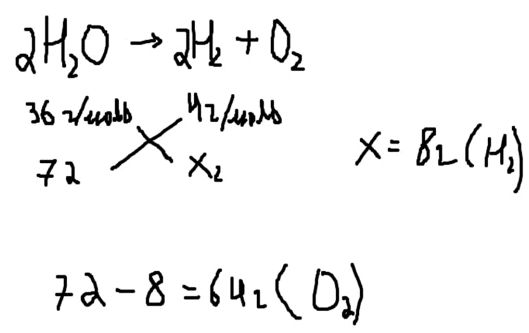 №14 Билет 1. Атомның құрамы және құрылысы дегеніміз не? Ол қандай бөлшектерден тұрады? том құрылысы - 1897 жылы көптеген электр құбылыстарын түсiндiруге мүмкiндiк беретiн жаңалық ашылды. Ағылшын ғалымы Дж. Дж. Томсонэлементар заряд тасымалдаушысы болып табылатын бөлшектi тапты. Бұл бөлшекті электрон деп атады.[1][2] Мазмұны
ЭлектронЭлектрон массасы m=9,1*10-31 кг-ға тең және табиғаттағы ең жеңiл сутегi атомы массасынан 3700 еседей аз болып шықты. Электр зарядын арттыруға және азайтуға болады. Яғни олар әр түрлі мәнге ие болуы мүмкін. Ендеше электр заряды физикалық шама. Екі электрометр алып олардың біреуін зарядтайық. Сосын оқшаулағыш тұтқасы бар жіңішке сыммен екі электрометрді жалғайық. Сонда біз зарядтың теңдей екіге бөлінгенін көре аламыз. Атом құрылысы 1911жылы ағылшын ғалымы Э. Резерфорд басқарған тәжiрибелер нәтижесiнде ашылған. Электрон заряды терiс: qэл = – е = – 1,6 • 10–19(дәрежесі) Кл. Бұл заряд электронның ерекше сипаттамасы болып табылады. Жәй денелердi зарядтауға немесе разрядтауға болады, ал электронды зарядынан “айыру” мүмкiн емес. Сондай-ақ электрон зарядын азайтуға немесе көбейтуге болмайды. Электрон заряды барлық уақытта тек бiр мәнге ие. Химия курсынан сiздер электронның атом құрамына кiретiнiн бiлесiздер. Электрондар атом ішінде орналасқан оң зарядталған атомдық ядроны айнала қозғалады. Резерфорд тәжiрибелерiн жоғары сыныптарда егжей-тегжейлi қарастырылады. Мұнда бiз оның тәжiрибе нәтижесiнде жасаған қорытындыларымен шектелемiз.[3] Атом құрылысы[өңдеу]Резерфорд атомының құрылысын Күн жүйесiне ұқсатты. Күн жүйесiндегiпланеталар оған тартылып айналғаны сияқты, электрондар да ядроғатартылып оны айнала қозғалады. Осындай ұқсастығы үшiн Резерфорд ұсынған модельдi планетарлық модель деп атаған. Ядро мен электронның ара қашықтығы олардың өлшемдерiне қарағанда өте үлкен. Егер атомды ойша үлкейткенде ядроның диаметрi он теңгелiктей болса, онда ядро мен электрон ара қашықтығы шамамен бiр километрдей болар едi. Егер барлық электрондар атомдық ядроларға тығыз орналасса, онда ересек адамның денесiнiң көлемi бiр куб миллиметрдiң миллионнан бiр бөлiгiндей болатындығы есептелген. Бұдан адам денесiнiң 99%-ын (кез-келген дененiң) бостық жайлайтындығын көремiз. Бiр тектi атомдар жиынтығы химиялық элемент деп аталады. Әр түрлi химиялық элементтердiң атомдары бiр-бiрiнен ядроларының зарядымен және сол ядроны айнала қозғалатын электрондар санымен ерекшеленедi. Мысалы, сутегi атомында жалғыз электрон бар, оттегi атомында – сегiз электрон, ал уран атомында – тоқсан екi. Атомдағы электрондар саны элементтiң Д.И. Менделеев кестесіндегі реттiк нөмiрiмен сәйкес келедi. Осы нөмiр атом ядросының зарядын да анықтайды. Белгiлеу енгiзейiк: Z – элементтiң реттiк нөмiрi, е = атомдағы электрондар саны. Онда атом ядросының және атомдағы барлық электрондардың жалпы заряды үшiн былай жазуға болады: qядро= + Ze, qэл-н= – Ze. Атомдағы электрондардың жалпы зарядын, атом ядросының зарядына қоссақ нөл шығады. Бұл атомның толықтай бейтарап екендiгiн көрсетедi. Бейтарап атомдардан тұратын заттардың молекулалары да бейтарап болады. Кейбiр жағдайларда (мысалы, соқтығысқанда) атомдар бiрнеше электронын жоғалтуы мүмкiн. Атомдар электрондармен бiрге өздерiнiң терiс зарядының бiр бөлiгiн жоғалтып, бейтарап емес жүйеге айналады. Осының салдарынан пайда болған оң зарядталған атомды оң ион деп атайды. Керi жағдайлар да болуы мүмкiн: бейтарап атом өзiне артық электрон қосып алып, терiс зарядталады. Мұндай атомды терiс ион деп атайды. 2. Тұздар: құрамы, жіктелуі, қасиеттері, алынуы 92 бет. Тұздар– химиялық қосылыстар класы; қышқыл молекулаларындағы сутек атомдарының орны толықтай немесе жартылай металл атомдары не ОН топтарына ауысқан қосылыстар; қалыпты жағдайда иондық құрылымдағыкристалл заттар.[1] 'Тұздар- Тұздар - қатты кристал заттар, біразы суда жақсы еріп, мөлдір ерітінді түзеді. Суда ерімейтін тұздарға BaCO3,BaSO4,AgCl, және тағы басқлары жатад. Азот қышқылының тұздары түгелдей суда ерімтал. Натрий мен калий тұздарының барлығы дерлік суда жақсы ериді. Тұздар ерте заманнан белгілі. 1812 жылы Я.Берцелиус тұздардың электрхимиялық теориясын құрды. Электролиттік диссоциациялану теориясы шыққаннан кейін, тұздардың суда ерігенде металл атомдары катиондарын және қышқыл қалдығы аниондарын түзетін күрделі заттар екені анықталды. Мысалы, NaNO3Na+1+NO31. 3. 20%-тік 500г ерітінді даярлау үшін қанша грамм тұз қанша грамм су қажет? Шешуі: Массалық үлесті табу формуласы бойынша тұздың (заттың) массасын табамыз 500г*0.2=100г Судың массасы 500г-100г=400г Жауабы: 100 грамм тұз және 400 грамм тұз қажет. №15 Билет 1. Химиялық элементтердің жіктелуі мысалдар келтіріп заттардың формуласын жазыңдар. Ғылымның кез келген саласында деректердің жиналып молаюына байланысты, оларды жіктеп, жүйелеу мен өзарабайланыстарын айқындау жұмысы жүреді. Химиялық элементтерді жіктеудің қажеттігі туды, себебі олардың саны XIX ғасырдың басынан біртіндеп арта бастады. Сондықтан оларды қасиеттеріне қарай топтастыру жұмысы басталды. Жіктеу элементтерді металдар менбейметалдарға бөлуден басталды; оны шведтің ұлы ғалымы Й.Я. Берцелиус жүзеге асырды. Олардың генетикалыққатарлары мынадай: металдар → негіздік оксидтер → негіз бейметалдар → қышқылдық оксидтер → қышқыл Енді нағыз металл мен бір бейметалды алып, олардың өздерінің және қосылыстарының қасиеттерін салыстырасипаттайық: мысалы, натрий мен күкіртті алсақ: 1) Натрий - металл, металдық жылтыры бар, электр тоғы мен жылуды жақсы өткізеді. Ал күкірт - сары түсті ұнтақ зат, бейметалл - жылу мен электр тоғын өткізбейді. Ал қосылыстарының қасиеттерін салыстырып көрсек: 2) Натрий оксиді Na2О - негіздік оксид, оған суда еритін негіз (сілті) сәйкес келеді (NaOH). Күкірт оксидтері SО2, SО3 қышқылдық оксидтер, оларға қышқылдар H2SО3, H2SО4 сәйкес келеді. 3) Оксидтерінің химиялық қасиеттерін еске түсірсек: Na2О + Н2О = 2NaOH Na2О + SО3= Na2SО4 Na2О + H2SО4= Na2SО4+H2О SО3+H2О=H2SО4 SО3+CaO = CaSО4 SО3+2NaOH = Na2SО4+H2О 4) Қышқылдарды анықтайтын индикаторлар: көк лакмус → қызарады метилоранж → қызарады Негіздерді анықтайтын индикаторлар: метилоранж → сарғаяды фенолфталеин → таңкурай түске боялады Осы екі үлкен қатардан басқа олардың аралығында орналаса алатын қосылыстарының қасиеттері екіжақтыэлементтер де көптeн табыла бастады (Zn, Al, Be). Бериллий оксиді тұз қышқылымен әрекеттескенде негіздік оксидтің қасиетін көрсетеді: ВеО + 2HCl = ВеСl2+ Н2O ВеО + 2NaOH= Na2BeO2+ Н2O Екінші реакцияда ВеО қышқылдық оксидтің қасиетін көрсетіп, екідайлылық танытады. Екідайлы оксид пен гидроксид түзетін металдардың өздері де екі түрлі қасиет көрсетеді; мысалы, беткі қабатыжаңадан тазартылған алюминий кесегі қышқылмен де, сілтімен де сутегін бөле әрекеттеседі. 2Al+6NaOH=2Na3AlO3+3H2↑ 2Аl+6НСl=2АlСl3+ЗН2↑ Аl2O3+6НСl=2АlСl3+ЗН2O Al2O3+6NaOH=2Na3AlO3+3H2O Оксидіне сәйкес гидроксиді де екідайлы қасиет көрсетеді. Аl(OН)3+ЗНСl=АlСl3+ЗН2O Al(OH)3+3NaOH=Na3AlO3+3H2O Осы мысалдардан элементтерді металдар мен бейметалдар деп нақты бөлуге болмайтынын көреміз. Табиғатта қасиеттері ұқсас элементтер кездеседі, оларды элементтердің табиғи топтары деп атайды. Мысалы,галогендер — фтор, хлор, бром, йод. Олардың молекулалары екі атомды, нағыз бейметалдар (Ғ2, Cl2, Br2, I2). Олардың барлығы ұшқыш сутекті қосылыстар береді, ерітінділері қышқылдар. Салыстырмалы атомдық массаларының мәндері артқап сайын әлементтердің белсенділіктері кемиді. Галогендер сияқты элементтердің тағы бір табиғи тобы - халькогендер. Олардың салыстырмалы сипаттамаларынқарастырамыз. Халькогендердің химиялық реакциялардағы белсенділіктері галогендерге карағанда төмендеу. Салыстырмалыатомдық массалары артқан сайын сутекті қосылыстарының тұрақтылығы кемиді, ал оксидтері - қышқылдык оксидтер, оларға сәйкес қышқылдарының қышқылдылығы әлсірейді. Қасиеттері карама-қарсы топсілтілік металдар тобы — литий, натрий, калий, рубидий, цезий. Бұлардың молекулалары бір атомды, өте активті, оңай балқитын, сумен шабытты әрекеттесетін, қосылыстарында бір валенттілік көрсететін әлементтер.[1] 2. Жай және күрделі заттардың жіктелуі. Генетикалық байланысты қалай қалпына келтіруге болады? Металдар және бейметалдар. Химиялық формула – заттың құрамын химиялық элемент таңбалары және индекстер көмегімен шартты түрде бейнелеу. Заттың салыстырмалы молекулалық массасы, берілген зат молекуласының массасы көміртек атомы массасының 1/12 бөлігінен неше есе ауыр екенін білдіреді. Химиялық формула арқылы салыстырмалы молекулалық массасын табамыз: Мr (H2O) = (2•1)+16=18 Заттың формуласы бойынша мыналарды білуге болады:
Химиялық формула – заттың құрамын химиялық элемент таңбалары және индекстер көмегімен шартты түрде бейнелеу. Заттың салыстырмалы молекулалық массасы, берілген зат молекуласының массасы көміртек атомы массасының 1/12 бөлігінен неше есе ауыр екенін білдіреді. Химиялық формула арқылы салыстырмалы молекулалық массасын табамыз: Мr (H2O) = (2•1)+16=18 Заттың формуласы бойынша мыналарды білуге болады: Жай немесе күрделі зат.(бір немесе бірнеше атом түрлерінен құралғандығын) Сапалық құрамы (яғни атомдардың қандай түрлерінен құралған) Сандық құрамы (яғни әр атом түрінің қаншасы кіреді) Салыстырмалы молекулалық массасы (яғни берілген молекула массасы м.а.б-нен неше есе көп) Элементтердің массалық қатынастары. Металдар– Электр тоғы мен жылуды жақсы өткізетін, пластикалық қасиеті жоғары, жылтыр заттар. Мұндай қасиеттердің болуы металдардың ішкі құрылымымен байланысты. Металдардың (сынаптан басқа) кристалдық тор көздерінде металл атомдарыорналасқан. Олар бір-бірімен металдық байланыспен байланысады. Металдардың иондану энергиясы аз болғандықтан олардың валенттік электрондары оңай бөлініп, бүкіл кристалдың бойында еркін қозғала алады. Сондықтан олардың жиынтығын электрон газы деп те атайды. Су ерітінділеріндегі реакциялар үшін металдың активтілігі оның активті қатардағы орнына байланысты. Металдардың қаттылығы, температураға төзімділігі күнделікті тәжірибеде шешуші рөл атқарады. Егер шыныхроммен кесілсе, ал цезийді адам тырнағымен-ақ кесе алады. Кейбір металдар жұмсақ (күміс, алтын, т.б.) болғандықтан таза металдардың орнына олардың бір-бірімен құймалары қолданылады. Ең алғаш алынған құймалардың бірі – қола. Темір мен оның құймалары (шойын, болат) қара металдар, ал қалғандары түсті металдар; алтын, күміс, платинахимиялық реактивтерге төзімділігіне байланысты асыл металдар; сумен әрекеттесіп сілті түзетін металдарды сілтілік (Lі, Na, K, Rb, Cs), ал жер қыртысының негізін құрайтындарын сілтілік жер металдар; массалық үлесі 0,01%-дан аспайтындарын сирек металдар деп атайды. Өнеркәсіпте металдарды негізінен пирометаллургия,гидрометаллургия және электрметаллургия әдістерімен алады. Металдар электр сымдарын, тұрмысқа қажет бұйымдар (қазан, балға, т.б.) жасауда, т.б. кеңінен қолданылады. Бейметалдар - металл еместер қатарына: сутек, бор, көміртек, кремний, фосфор, мышьяк, оттек, күкірт, селен, теллур, галогендер, асыл газдар жататын химиялық элементтер тобы; оларды металдардан бөліп топтауға қолданылатын атау. Табиғаттағы белгілі бейметалдар саны металдарға қарағанда аса көп емес. Периодтық жүйедегі бейметалдардың орнын анықтау үшін бор элементінен астатка дейін көлденең сызық жүргізсе, кестенің жоғарғы оң жақ бұрышын ала негізгі топшаларда бейметалдардың орналасқаны байқалады. Периодта бейметалл әлемент атомының ядро заряды біртіндеп өседі де, атом мөлшері кішірейеді. Сондықтан электрон қосып алуға бейімділігі жоғары және тотықтырғыштық қасиеті басым болады. Ал бейметалл орналасқан негізгі топшаларда (IV—VII) атомның радиусы неғұрлым кіші болса, ол ең сыртқы электрондарды күшті тартады. Демек, тотықтырғыштық қасиеті басым болады. Мысалы, фтор мен хлор атомын салыстырсақ, ең күшті тотықтырғыш — фтор. Бейметалдардың тотықтырғыш қабілеті электртерістіктің сан мәніне байланысты. Тотықтырғыш қасиеттердің өзгеруіндегі осы заңдылық сол бейметалдар түзетін жай заттарға да тән. 3. Массасы 12,6 г азот қышқылын бейтараптау үшін мыс(II) гидроксиді қанша массасы және мөлшері қажет екенін есептеңдер. Шешуі: 12,6г хг 2HNO3+Cu(OH)2=Cu(NO3)2+H2O 126 98 m(Cu(OH)2)=(12,6×98)/126=9,8г 12,6 хмоль 2HNO3+Cu(OH)2=Cu(NO3)2+H2O 126 1моль х=12,6/126=0,1 немесе есепті шығаруының 2-ші жолы: Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 63 г азот қышқылының мольдік массасы n HNO3=12,6/63=0.2 моль Реакция былай жүреді: 2 HNO3 + Cu(OH)2 ----> Cu(NO3)2 + 2 H2O. Реакциядан айқын көрінетіні мыс гидрооксидінің (II) мольдер саны азот қышқылының мольдік санынан 2 есе аз болуы тиіс, яғни 0,1 моль. n Cu(OH)2-0,2/2=0.1 моль Енді мольдік массаға көбейтеміз m Cu(OH)2=0,1*(64+2*17)=9,75 г. №16 Билет 1. Химиялық элементтердің электр терістігі ұғымдарының айырмасы неде? Периодтық жүйедегі әр период бекзат газбен аяқталады. Олар химиялық, белсенділігі төмен газдар, осы енжарлықты шешу үшін олардың электрондық құрылыстарына үңілейік. Атомдық кұрылыстары бізге белгілі 42He, 2010Ne, 4018Аr газдардың барлырының сыртқы электрондық қабаттары аяқталған 8 электронды. Бұлардан басқа элементтердің химиялық белсенділіктері осы сыртқы электрондық қабаттарының аяқталмағандығынан болады. Олар енді қосылыс түзу арқылы ғана осындай аяқталған қабатқа (инерттілікке) электрондарын беру немесе электрондарды қосу арқылы жетеді. Ал мұның өзі екі жайтқа тәуелді:
Периодтың басында орналасқан элементтің сыртқы қабатындағы электрондар саны аз болады, сондықтан олар осы электрондарын беріп жіберіп, өзіне дейін тұрған бекзат газдың аяқталған электрондық құрылысын алады. Ал периодтың соңын ала орналасқан элементтердің сыртқы қабатындағы электрондар саны көп болғандықтан, аяқталуға жетпей тұрған электрондарды қосып алып, өзінен кейін тұрған бекзат газдың электрондық қабатын алады. Период бойынша элементтердің сыртқы қабатындағы электрондар (валенттілік электрондар) саны біртіндеп артады, атомдардың ядро зарядтары да осы бағытта өседі. Атомдардың электронды өзіне тарту күші солдан оңға қарай артады, сондықтан атом радиустары осы бағытта кемиді. Яғни осы бағытта электронды сыртқы қабатына қосу мүмкіндігі артады. Үшінші периодта орналасқан элементтердің валенттілік электрондарының формулаларын жазып, олардағы дара электрондар сандарын және электрондық қабаттың аяқталуына қанша электрон калғандығын анықтап көрелік. Toп бойынша осы қасиеттің өзгерісін карастырайық. Бір топта орналаскан элементтердің валенттілік электрондарының сандары бірдей, ал электрондық қабат саны, яғни атом радиустары жоғарыдан төмен қарай артады; олай болса, сыртқы қабаттарынан электрондарды беріп жіберуге бейімділіктері артады. Электрондарды беру металдың, ал қосу бейметалдық қасиеттерді сипаттайды. Осыны түсіну үшін бірінші және жетінші топтың негізгі топшаларында орналасқан бізге белгілі элементтердің электрондық құрылыстары мен атом радиустарының мәндерінің арасындағы байланысты қарастырайық. Сонымен, период бойынша солдан оңға қарай металдық қасиет кеміп, бейметалдық біртіндеп артады; ал топ бойынша жоғарыдан төмен қарай металдық қасиет артады. Электртерістілік дегеніміз элемент атомдарының байланыс түзу кезінде өзінің сыртқы қабатына электрондарды тарту арқылы аяқталған электрондық қабат түзу мүмкіндігі. Іс жүзінде салыстырмалы электртерістілік деген түсінік қолданылады, бұл түсінікті ғылымға американ ғалымы JI. Полинг кіргізген, оның мәні 0,7 мен 4,0 аралығында өзгереді. Электртерістілік мәні ең аз элемент - цезий, ал ең жоғары электртерістілік көрсететін элемент - фтор. |
