Химия Билет. 1 Билет Химия ылымыны пайда болуы, дамуы жне маызы
 Скачать 1.16 Mb. Скачать 1.16 Mb.
|
|
2. Изотоп деген не? Сутектің изотоптары қалай аталады? Молекулалық фолрмуласын жаз және аттарын ата. Изотоптар - Масса саны әртүрлі бола тұрса да, атомдық ядро заряды бірдей болып келетін, сондықтан да Менделеев кестесіңде бір ғана орынды иеленетін химиялық элементтер атомы. Бір ғана элементгің әртүрлі изотоптарына тән атомдар өздерінің ядросына кіретін нейтрондар саны жағынан, ядролық қасиеттері тұрғысынан бір-бірінен анық өзгешеленеді, алайда олар, электронды қабаттары құрылысының бірдей болуына байланысты, бір-біріне өте ұқсас химиялық қасиеттерді иемденеді. Химиялық элементтердің көпшілігі атомдық салмақтары әр түрлі изотоп қоспасынан тұрады. Бүгінгі танда 264 тұрақты изотоптар, 50 шамалы табиғи радиоактивті изотоптар және 1000-нан астам жасанды радиоактивті изотоптар белгілі Табиғатта тұрақты екі изотопы 1Н (протий) және 3Н (тритий) кездеседі, 3. 78 г калий сумен әрекеттескенде калий гидроксидінің қандай массасы және қанша мөлшері түзіледі? 2K+H2O--->2KOH+H2 78г----------------хг 78-----------------112(2КОН) 2моль (КОН) х=112гр х=2моль №23 Билет 1. Химиялық элементтердің тірі және өлі табиғатта таралуы. HCl физикалық-химиялық реакция теңдеуі.
Кальций – күмісше жылтыраған ақ металл, ол сілтілік металдар тәрізді өте жеңіл (g = 1,55 г/см3 ), алайда анағұрым қатты болады және оның балқу температурасы да өте жоғары, 851 0 С-ге тең. Са – ізбес. Ол жасуша құрамына еніп, сүйек құрауға, жүрек және бұлшық еттерінің жұмысына қатысады, қанның ұюын қамтамасыз етеді. Калцийдің маңызды қосылыстары: кальций оксиды – СаО – сөндірімеген әк, кальций гидроксиді – Са(ОН)2 – сөндірілген әк, кальций карбонаты – СаСО3 - әкті су, ғаныш (гипс) – СаSO4 *2Н2О Ересек адамдарға тәулігіне 0,5 грамм кальций жеткілікті. Ол сүйекті қатайтуға аса қажет. Кальций – сиыр мен қой сүті, сүтпен жасалатын түрлі тағам – ірімшік, сүзбе, сүтсірнеде (сыр) мол. Қара бидай наны мен жұмыртқаның сары уызыда кальцийге бай. Ағзаға бір тәулікке қажет кальций алу үшін жүз грамм сүтсірне немесе жарты литр сүт жетеді. Ағзада кальций тұздарының жетіспеушілігі сүйек ұлпасының дұрыс емес дамуына, тістер (кариес) ауруына, кейбір ферменттердің белсенділігі төмендеуіне, орталық жүйке жүйесінің қызметінің бұзылуына әкеп соқтырады. Йод - өмірлік маңызы бар элемент. Ол қалқанша без үшін құрылыс материалы (қалқанша без – йод жинақтаушы орган). Өкінішке орай, бұл микроэлемент ағзада жасалмайды, адам оны тек ас, тағам арқылы алады. Сырт қарағанда йод жетіспеушілік білінбейді, ал тапшылық сезілсе түрлі ауруларға шалдықтырады, яғни шаршау, түрлі жұқпалы ауруларды тез қабылдағыштық, белсіздік және ақыл – ой кемістігі. Йод жетіспеушілігіне байланысты ауруларды емдегеннен гөрі алдын – алған жөн. Адам күнделікті өсімдік және жануартекті өнімді қабылдағанмен, ағзаға қажет мөлшердегі дәрумен мен микроэлементтердің орнын толтыра алмайды. Ағза йодты синтездей алмағандықтан, тршілік үшін күнделікті йоды бар тағамдарды пайдалану есебінен қажет мөлшерін толтыру қажет. Фосфор тұздары . Фосфор тұздарының ағза үшін маңызы сүйекті қалыптастыруға қатысумен шектелмейді. Фосфордың органикалық қосылысы – аденозинүшфосфат қышқылы мен креатин – биологиялық қышқылдану барысында босайтын қуаттың нағыз аккумуляторы болып табылады. Ағза бұлшық еті жиырылғанда, сондай – ақ мида, бауырда, бүйректе және басқа ағзаларда жүретін биохимиялық үрдістерде қуатты нақ осы қосылыстар түрінде пайдаланады. Міне сондықтан бұлшық етте қатты жұмыс істеген кезде фосфатты қажетсіну едәуір артады. Егер ересек адамға оның тәуліктік қажеті 1 – 2 грамм болса, ауыр дене еңбегімен шұғылданатын жұмысшыға немесе үлкен қашықтыққа жүгіретін спортшыда бұл қажеттілік екі есе дерлік артуы мүмкін. Адам денесінде фосфор қосылыстары көп. Фосфор қышқылының қалдығы жасуша ядроларында нәсілдік қасиеттер беретін аса маңызды заттарға – нуклеопротеидтерге, май тектес заттарға – фосфатидтерге және көмірсулардан тарайтын әр түрлі заттарға міндетті құрамдас бөлік ретінде кіреді. Сүйек пен тісте фосфор қышқылының тұздары өте – мөте көп. Сондықтан тамақ рационында фосфордың қажетті мөлшерде болғаны жөн. Фосфор мал мен өсімдік өнімдерінде мол. Өсімдік өнімдерінен бөлінген қосылыстар ағзаға нашар сіңеді, өйткені нашар ериді. Фосфор сырда, сүзбеде, етте өте көп. Әр өнімнің 100 г мөлшеріндегі фосфор төмендегі мысалда келтірілген. Мырыш жетіспесе нәрестелердің өліп кетуі де мүмкін екен. Содан соң жасөспірім шағында ер балаларды безеу, шаштың майлы себореясы. Бұдан құтылудың жолы – мол мырыш жеу, мысалы, асқаьақ тұқымын немесе күнбағыс пістесін шағу. Д. И. Менделеев жасаған химиялық элементтердің периодтық жүйесіндегі кездесетін 110 элементтің 80-ге жуығы тірі жасушаның құрамында болатындығы дәлелденді. Олар жасушадағы мөлшеріне қарай үш топқа белінеді. Бірінші топқа: оттек, сутек, көміртек және азот сияқты органикалық және бейорганикалық заттардың молекулаларының негізін құрайтын элементтер жатады. Бұлардың жасушадағы мөлшері 98%-ға жуық болғандықтан, олар макроэлементтер деп аталады. Сонымен қатар бұл топқа нәруыз (белок) бен нуклеин қышқылдарының құрамына кіретін күкірт пен фосфор да кіреді. Бұларды биоэлементтер деп атайды. Екінші топқа: ион түрінде кездесетін калий, натрий, кальций, магний, темір, хлор сияқты және т.б. элементтер жатады. Бұлардың жасушадағы жалпы мөлшері 1%-ға жуық. Бұл элементтердің қысқаша жасушада ерекше қызметтер атқарады. Мысалы, кальций мен фосфор сүйек ұлпасының құрамына кіреді, оның беріктігін арттырады. Сонымен қатар кальций элементі қанның ұюына қатысады.Ал гемоглобин нәруызының құрамында темір болады, ол оттекті өкпеден ұлпаларға тасымалдайды. Өсімдік жасушасындағы хлорофилл пигментінің құрамындағы магний элементі фотосинтез процесін тездетеді. Үшінші топқа: жасушада өте аз мөлшерде кездесетін элементтер жатады. Олардың жасушадағы мөлшері 0,02% болатындықтан микроэлементтер деп аталады. 2. Зат мөлшері деген не? Өлшем бірлігі. Авагадро саны нені көрсетеді? Химия ғылымында сандык. қатынастар жиі колданылады. Мысалы, затта канша молекула бар, ал молекулаларда қанша атом болады деген сұрақтардың шешімін табу үшін химияда «моль» деген түсінік қолданылады.
Моль - зат мөлшерінің өлшемі, ол ν ("ню") грек әрпімен белгіленеді. Сендер физика курсынан «Авогадро саны» деген түсінікпен таныссыңдар: NA = 6,022 141 29(27)×1023 моль−1
Кез келген заттың 1 молінде Авогадро санындай құрылымдық бірліктер (атом, молекула) болады. Олай болса «моль» дегеніміз Авогадро санындай құрылымдык бірлігі бар зат мөлшері. Олай болса 64 г мыста, 18 г суда, 44 г көмірқышкыл газындағы құрылымдық бөлшектердің саны 12 г көміртекте болатын атомдар сандарымен бірдей, сондықтан моль дегеніміз - құрамында 12 г көміртекте болатын атомдар санына тең құрылымдық бөлшектер (атомдар, молекулалар) болатын заттың мөлшері. Заттың 1 молінің массасын молярлық масса деп атайды, ол М әрпімен белгіленеді, өлшемі г/моль. Оның сандық мәні салыстырмалы молекулалық массаға тең. 3. Дәріханада 500 г 9%-тік ерітінді дайындау үшін ас тұзының және судың қандай массасы қажет? m ерітінді = 500г (ерітіндінің массалық үлесі) Wтұз =9%=0,09 m тұз -? Шешуі: m тұз=500г*0,09= 45г m су = 500г-45г=455г №24 Билет 1. Бейтараптану реакциясын теңдеулер арқылы көрсет Бейтараптану ( орыс. нейтрализация ) ( лат. neuter – бейтарап ) - Күшті қышқылдар мен күшті сілтілердің әрекеттесу реакциясы; бұл реакция нәтижесінде сутек ионының қышқылдық, ал гидроксил иондарының сілтілік қабілеттері жоғалып, бейтарап ерітінділер түзілетін болады. ейтараптану реакциясы дегеніміз қышқыл мен негіздердің әрекеттесу реакциясы, нәтижесінде тұз бен су түзіледі. BaO + H2SO4 = BaSO4 + H2O Сu(OH)2 + H2SO4 = CuSO4 + 2H2O H3PO4 + KOH = KH2PO4 + H2O 3NaOH + H3PO4 = Na3PO4 + 3H2O 2. Бейорганикалық қосылыстар арасындағы генетикалық байланыс деген не? Мысалдарды теңдеу арқылы өрнекте. Біз өмір сүретін материалдық әлем жалғыз сонымен қатар үздіксіз әртүрлі. Барлығы үздіксіз қозғалыста, үздіксіз ауысуда болады. Бірақ кейде бұл ауысулар тірі ағзаларға, суға, атмосфераға және тау жыныстарына зиянды әсерін тигізеді. Біз сан рет жапырақтың сарғайып, солуын көбінесе жаңбырдан кейін болатынын байқаймыз. О 1. S + O2→ SO2; SO3 + H2O→ H2SO4 ; 2SO2 + O2→ 2SO3; H2SO4 + CaCO3 О 2. 2Ca + O2→ 2CaO; CaO + H2O→ Ca(OH)2 О 3. H2SO4 + Ca(OH)2→ CaSO4 2H+ +SO42-- + Ca2++2ОН→ CaSO4+H2O Бұл тізбекте әртүрлі класс заттарына жататын бір элемент қайталанып, айналулар нәтижесінде CaSO4 тұзына айналады. бұндай тізбекті генетикалық қатар д.а. Мұндай заттар бір – бірімен генетикалық байланыс түзетін «туыстық заттар» , яғни бір бастауға ие. Бұл заттар генетикалық қатарда туыс болады. №25 Билет 1. Галогендердің атом құрылысы қандай агрегаттық күйінде қандай заңдылықтар болады? Галогендер VIIA топшада орналасқан, олар: фтор F, хлор С1, бром Вr, йод I, астат At. Астат - радиобелсенді элемент. Олардың валенттілік электрондарының жалпы формуласы ns2nр5 (n=2-6). Бұл элементтердің топтық атауы «тұз түзуші» деген түсінікке сәйкес келеді. Галогендердің соңғы электрондары р-деңгейшесіне түседі, сондықтан олар р элементтеріне жатады. Топ бойынша жоғарыдан төмен қарай олардың атом радиустары артады, қайнау температурасы мен тығыздықтары да осы бағытта өседі. Олардың агрегаттық күйлері газдан (F2, С12) сұйықтыққа (Вr2), ары қарай қатты (І2) күйге өзгереді, түстері де біртіндеп қоюлана түседі. Галогендер типтік бейметалдар, себебі олардың сыртқы валенттілік қабаттарының толысуына бір ғана электрон жетіспейді, оны қосқанда тотықтырғыштық қасиет көрсетіп, өзінен кейін тұрған бекзат газдардың электрондық кұрылысын алады. Галогендердің тотықтырғыштық қасиеттері топ бойынша жоғарыдан төмен қарай кемиді, себебі атом радиустары артқандықтан ядроның электрон тарту күші азаяды. Фтор қосылыстарында тек бір валенттілік қана көрсетеді, тотығу дәрежесі үнемі -1,0-ге тең, себебі ол электртерістіктілігі ең жоғары элемент; оның екінші энергетикалық деңгейінде екі ғана деңгейшесі бар, электрондардың дараланып көшетін орны болмағандықтан топ нөміріне сәйкес валенттілік көрсете алмайды. Қалғандары топ нөміріне жеткенше тақ мәнді валенттіліктерді (I, III, V, VII) көрсетеді, тотығу дәрежелері: -1, 0, +1, +3, +5, +7. 2. Металдардың кернеу қатарын және оны қалай түсінесің? 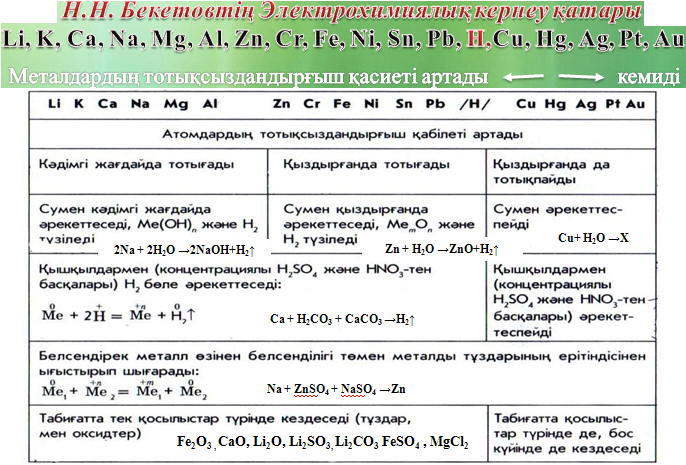 | ||||||||||||||||||||||||||||||||||||||||
