Химия Билет. 1 Билет Химия ылымыны пайда болуы, дамуы жне маызы
 Скачать 1.16 Mb. Скачать 1.16 Mb.
|
|
2) 16HCl(конц.) + 2KMnO4 = 5Cl2↑ + 2MnCl2 + 8H2O + 2KCl 3) 4HCl(конц.) + Ca(ClO)2 = 2Cl2↑ + 32H2O + CaCl2 4) 6HCl(конц.) + KClO3 = 3Cl2↑ + 3H2O + KCl Хлор газын алу үшін кейбір күшті тотықтырғыштарға, мысалы марганец (ІҮ) оксидіне MnO2 , бертолле тұзына KCIO3 , калий перманганатына KMnO4 концентрлі тұз қышқылымен әсер етіп алады: Осы әдіспен хлорды алғаш рет 1774 ж. Швед оқымыстысы К. Шееле алған. Бертолле тұзы мен тұз қышқылын өте сақтықпен жайлап қыздырғанда реакция жүреді де хлор газы бөлінеді. Концентрлі тұз қышқылын калий перманганатының ерітіндісіне құйса, реакция шабытты жүреді. 3. Массасы 28 г. литий суда ерігенде сутектің қанша көлемі түзіледі? Шешуі: 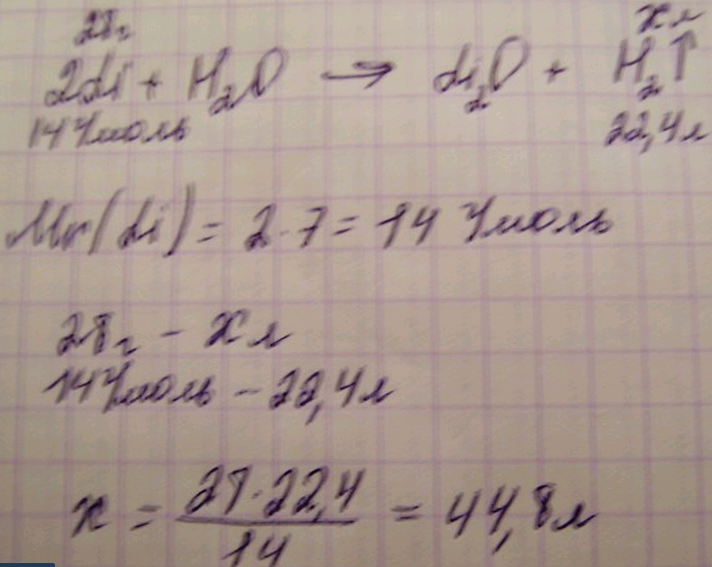 №20 Билет 1. Оттегі химиялық элементінің аллотропиясы қалай аталады? Қандай зат екендігін түсіндір. Оттегінің аллотропиялық түр өзгерістері. Озон Оттегі табиғатта екі түрлі жай зат күйінде кездеседі, оның бірі O2, екіншісі O3, ол озон деп аталады. Енді озонмен жете таныссақ, озон найзағай ойнағанда ауада пайда болады. Сонда электр зарядының әсерінен мына реакция жүреді: 3O2 → 2O3 Бір элементтің бірнеше жай зат күйінде болу құбылысы аллотропия деп аталады. Озонның формуласы О3, салыстырмалы молекулалық массасы 48, оттегінен 1,5 есе ауыр (48 : 32 = 1,5), суда аз еритін, -112°С-да қайнайтын, -193°С-да балқитын газ күйінде қою-көк түсті, ал қатты күйінде көктен қара-күлгін түске дейін боялады. Озонның химиялық қасиеттері Озон оттегіне қарағанда химиялық белсенді зат. Ол тіпті алтын, күміс, платина сияқты асыл металдарды да тотықтыра алады (7-кесте). 6Ag + O3 = 3Ag2O Нөсер жаңбырдан кейін орманға барсақ, онда ауа тазарып дем алу жеңілдейді, себебі ауада пайда болған озон айырылып, ауаны тазартады. Озонның атмосферадағы мөлшері өте аз - 0,004%. О3 → O Озоннан молекулалық және атом күйіндегі оттек бөлінеді, соңғысы күштірек тотықтырғыш, ауадағы бактерияларды жояды. Озон осы қасиетіне қарай ауыз суды, құдыктарды, өндірістік сарқын суларды тазарту үшін (залалсыздандыру) және ағартқыш зат ретінде қолданылады. Атмосфераның жоғары қабатында, жерден 25 км биіктікте (стратосферада) күн сәулесінің әсерінен жерді қорғап тұратын өте жұқа озон қабаты әр түрлі кері әсерлердің салдарынан «тесіліп», сол жерлерден күннің ультракүлгін сәулелері жер бетіне жетіп, ондағы әр түрлі табиғи апаттарға әкеліп соғады. Олар: жер бетінің температурасының біртіндеп артуы, мәңгілік мұздақтар мен мұхиттардағы мұзтауларының еруі, терінің қауіпті ісігі көбейеді. Озонды зертханада озонатор деп аталатын құралда алуға болады. Оттегі мен озонның салыстырмалы сипаттамалары Оттегі (O2) Озон (O3) Ауадан сәл ауыр, түссіз, иіссіз, суда нашар еритін газ (20°С-да судың 100 көлемінде оттегінің 3 көлемі, ал 0°С-да 5 көлемі ериді. Тыныс алу, жану, тотығу, шіру үдерістеріне қатысады. Ашық көк түсті өзіне тән иісі бар, суда жақсы еритін, ауадан 1,655 есе, оттегіден 1,5 есе ауыр газ. Озон оттегіне қарағанда химиялық белсенділігі жоғары зат, бактерицидтік, ағартқыштық қасиеттері бар. Ол озонның ыдырауы нәтижесінде атом күйіндегі оттек бөлінуімен түсіндіріледі: O3 ↔ O2 + "O". Концентрациясы 10-5%-дан артқанда улы болады. Табиғатта озон найзағай жарқылдаған кезде және кейбір органикалық заттар тотыққанда түзіледі (Озоносфера қабаты). Таза озон – улы, микроорганизмдерді өлтіреді, сол себепті суды, ауаны дезинфекциялауда, күшті тотықтырғыш болғандықтан қағаз ағартуда, т.б. қолданылады. 2. Тотықтырғыш және тотықсыздандырғыш туралы түсінік Реакция барысында электрондарын беретін атомдар, иондар және молекулалар тотықсыздандырғыш болып есептеледі. Реакция барысында электрондардың берілуі тотығуға, ал электрондардың қосып алынуы тотықсыздануға жатады. Сол себепті тотығу-тотықсыздану реакцияларының нәтижесінде тотықсыздандырғыш электрондарын беріп, тотығады, ал тотықтырғыш электрондарды қосып алып, тотықсызданады. Электрондардың тотықсыздандырғыштан тотықтырғышқа тасымалдануы барысында белгілі бір атомның, молекуланың немесе ионның тотығу дәрежесі өзгереді және тотығатын заттың тотығу дәрежесі жоғарылайды, ал тотықсызданатын заттікі-төмендейді. Тотығу-тотықсыздану реакцияларын теңестірудің екі тәсілі бар, электронды балансжәнеионды-электрондытәсілдері. 2 тәсілдің де негізі бірдей: ол-тотығу-тотықсыздану процесінде тотықсыздандырғыш берген электрондардың саны тотықтырғыш қосып алған электрондар санына тең болуы шарт. Электрондыбаланстәсілі: Na2SO3+KmnO4+H2SO4→Na2SO4+MnSO4+K2SO4+H2O Реакция кезінде тотығу дәрежесі өзгеретін элементтерді тауып, олардың үстіне жазамыз: +4 +7 +6 +2 Na2SO3+KMnO4+H2SO4→Na2SO4+MnSO4+K2SO4+H2O ТОТЫҚСЫЗДАНДЫРҒЫШ ТОТЫҚТЫРҒЫШ S+4-2e=S+6 Mn+7+5e=Mn+2 Тотығу және тотықсыздану процесіне қатысушы заттардың коэффициенттері электрондық баланс тәсілінің шарты бойынша тотықсыздандырғыш берген, тотықтырғыш қосып алған электрондар санына тең болады: 5S+4-2e=S+6 2Mn+7+5e=Mn+2 Негізгітотықтырғыштарментотықсыздандырғыштар. Медицинадақолданылуы.Практикада көп қолданылатын аса маңызды тотықтырғыштарға металл еместер (F2, Cl2, Br2, I2, O2), калий перманганаты KmnO4, калий дихроматы мен хроматы K2Cr2O7, K2CrO4, азот қышқылы және оның тұздары, концентрлі H2SO4, галогендердің құрамында оттегі бар қышқылдары және олардың тұздары (KClO3 -калий хлораты және KClO–гипохлориті), және жоғары тотығу дәрежедегі металл иондары, сутек ионы +1тотығу дәрежесінде (негізінен қышқылдардың құрамында). Аса маңызды тотықсыздандырғыштарға кернеу қатарында сутектен бұрын орналасқан активті металдар (сілтілік және сілтілік жер металдар, Zn, Al, Fe), сондай-ақ кейбір металл еместер H2, C, P, Si, галогенсутектер, күкіртсутек(HCl, HBr, HI, H2S) және кейбір төменгі зарядты металл иондары (Sn2+, Fe2+, Cu+) жатады. 3. Массасы 0,1 моль барий хлориді қанша моль күкірт қышқылымен әрекеттесе алады? Шешуі: BaCl2+H2SO4=BaSO4+2HCl Олардың қатынасы 1:1 тең, сондықтан 0,1 моль барий хлориді 0,1 моль күкірт қышқылымен әрекеттесе алады. Жауабы: 0,1 моль барий хлориді 0,1 моль күкірт қышқылымен әрекеттесе алады. №21 Билет 1. Табиғаттағы судың маңызы және физикалық/химиялық қасиеті және қолданылуы Су — сутегі мен оттегінің қалыпты жағдайларда тұрақтылығын сақтайтын қарапайым химиялық қосылысы. Ауыз су, тіршілік көзі, ол Жер шарының 3 / 4 бөлігін алады, тірі ағзалардың 60-70%-ы, ал өсімдіктердің 90 % -ы судан тұрады.[1] Жер бетінде тіршілік ең алғаш сулы ортада пайда болды. Су — бүкіл тіршілік иелерінің негізгі құрамдас бөлігі. Бұдан басқа судың тіршілік үшін физикалық-химиялық қасиеттердің: жоғары жылу өткізгіштік және жылу сыйымдылық, жоғары тығыздық, ауа тығыздығының шамамен 800 есе артуы, мөлдірлік, тұтқырлық, қатқан кезде мұздың көлемін ұлғайтуы және тағы басқа қолайлы қасиеттері болады. Біржасушалы және көпжасушалы ағзалар жасушаларының биохимиялық үдерістерінің барлығы сулы ортада өтеді. Су әр түрлі климаттық жағдайлардағы физиологиялық үдерістердің калыпты өтуіне себепкер болады. Ол сондай-ақ көптеген минералдық және ағзалық заттардың жақсы еруіне себепкер бола алады. Табиғи су құрамында сан алуан тұздың болатыны да сондықтан. Ағзалар жұғымды заттарды тек еріген түрінде сіңіреді. 2. Химиялық реакцияның жылу эффекті деген не? Өлшем бірлігі Химиялық реакциялардың жылу эффекті Химиялық реакциялар Экзотермиялық реакция (жылу бөле жүретін) +Q - жылу бөліну Эндотермиялық реакция (жылу сіңіре жүретін) - Q - жылу сіңірілу Анықтамалар «Экзо» - гректің «сыртқа» деген сөзі. Жылудың реакция жүріп жатқан ортадан, сыртқы қоршаған ортаға бөлініп шығатынын білдіреді. «Эндо» - гректің «ішке» деген сөзі. Жылудың сырттағы қоршаған ортадан реакция жүріп жатқан ортаға берілетінін білдіреді. Реакцияның жылу эффекті көрсетілген химиялық реакциялар термохимиялық теңдеулер деп аталады. 3. 50 г 16%-тік сілті ерітіндісін дайындау үшін қанша грамм сілті алу керек? Берілгені: m(ерітінді) = 50 г W(ерітінді) = 16% Табу керек: m(сілті ерітіндісі) -? Шешуі: W(ерітінді)= m(сілті ерітіндісі)/ m(ерітінді)*100% → m=(m(ерітінді)* W(ерітінді)/ 100% m(сілті ерітіндісі) = (50г*16%)/100% = 8г. Жауабы: 8 г. сілті алу керек. немесе есепті шығаруының 2-ші жолы: 50*16=800 800/100=8 грамм сілті алу керек! №22 Билет 1. Табиғаттағы тірі организмдердегі және адам тіршілігіндегі химиялық реакциялардың биологиялық маңызы қандай? Мысал келтір. Денедегі зат алмасу процесі қуат алмасуымен тығыз байланысты. Зат алмасу барысында қоректік заттардағы потенциалдық энергия босанып, ол механикалық, жылу, электр, сәуле энергияларына айналады да, ең соңыңда организмнен жылу түрінде бөлінеді. Демек, организмге энергия қоректік заттар құрамында келеді де, ол тіршілік әрекеттерін атқаруға, түрлі өнімдер өндіруге жұмсалады. Өлі табиғаттағы энергия алмасуынан жасушаларда жүретін процес-тер үш түрлі принциппен ерекшеленеді 1) қоректік заттардың химиялық энергиясы жылу энергиясына айналмай-ақ бірден әртүрлі жұмыстар атқаруға пайдаланыла береді және энергияның басқа түріне ауыса алады. Демек, тірі организм хемодинамикалық принциппен жұмыс істеп, энергия көзін тиімді пайдаланады. 2) тірі организмде энергия мысқалданып бөлінеді. Бұл организмді Энергиялық думпуден сақтап, қуатты толық пайдалануға мүмкіндік береді. 3) көмірсулар, белоктар, майлар ыдыраған кезде бөлінген энергияның артық мөлшері энергияның биологиялық аккумуляторы — мол қуатты заттардың (макроэрттердің) құрамына ену арқылы организмде жинақталып, қорда сақталады. Жасушаларда энергия үшкарбон қышқылы айналымына қатысатын маңызды метаболиттердің түзіліп, тотығуы кезінде босанып, жинақталады. Бұл процесс үстінде сутегі молекуласы бөлініп, көмір қышқыл газы түзіледі. Босанған сутегі молекуласы дегидрогеназалар коферменттерінің (НАД, НАДФ, ФАД) көметімен тотығу тізбетіне немесе тыныстық тізбекке қосылады. Бұл тізбекте сутегі электрондары біртіндеп жоғары энергетикалық тізбектен төменгі энергетика-лық тізбекке өтеді де, ең соңғы акцепторға — оттегіне беріледі, басқаша айтқанда ол тотығады. Бұл процесс барысында бөлінген энергияның аздау бөлігі (30-40%) жылу түрінде болінеді де, қалған бөлігі (60-70%) АТФ-тың макроэргиялық байланыстарында жинақталады. АТФ-тың осылай тыныстык тізбектегі сутегінің тотығу энергиясының есебінен түзілу жолын тотықпалы фосфорлану деп атайды. Сонымен, энергия өзгерістерінің негізінде қоректік заттардан электрондар босанып шығуы салдарынан олардағы қуаттың организмдегі химиялық реакцияларды жаңдандыратын қасиеттері жатады. Организмдегі энергая алмасуын энергия тендестігін анықтау арқылы зерттейді. Ол үшін организм қабылдаған және бөлген энергия мөлшерін салыстырады. Организмнің қорекпен қабылдаған энергиясының мөлшерін брутто (жалпы) энергия деп атайды. Брутто энергия мен организмнің зәрмен, нәжіспен, түрлі газдармен бөлген және қабылданған қорек пен ішкен суды жылытуға шығындаған энергиясының айырмасын нетто-энергия дейді. Демек, нетто-энергия организмнің тіршілік әрекеті үшін жұмсалатын энергия. Брутто-энергия мен нәжіс энергиясының айырмасын қорыту энергиясы дейді. Ал, қорыту энергиясы мен зәрмен бөлінген энергия айырмасын алмасу энергиясы деп атайды. Алмасу энергиясы организмнің тіршілік әрекеті мен өнім өндіруге (жұмыс атқаруға) жұмсалатын энергия. Организм қабылдаған жалпы энергияны қоректік заттардың қуаттық құндылығына сүйене отырып анықтайды. Ал, қоректік заттардың қуаттық құндылығын анықтау үшін арнаулы аспап-калоримет-риялық құты (бомба) қолданылады. Бомбаның ішіне 1 г зерттелетін зат салынады да, оны таза оттегімен толтырып, электртогын қосып, жағады. Зерттелетін зат бөлген жылу мелшері Джоуль бірлігімен өлшенеді. Калориметриялық бомбада жанғанда 1 г көмірсу 17,6 кДж (4,1 ккал), 1 г белок — 24,3 кДж (5,7 ккал), 1 г май — 38,9 қДж (9,3 ккал) энергая бөледі. Организмде белок толық тотықпайды белок құрамынан бөлінген амин тобынан түзілген несепнөр өзімен бірге біршама энергияны ұстап қалады. Осымен байланысты белоктар организмде 17,6 кДж (4,1 ккал) ғана энергия бөледі. Рацион құрамыңдағы көмірсулар, белоктар және майлар мөлшерін анықтағаннан соң, организм қабылдаған энергия мөлшерін есептеп шығаруға болады, Калориметриялық бомба көмегімен зәрдің, нәжістің кұрамындағы энергияны есептеп шығаруға болады. Газдардың калориялық коэффициенті организмде тотыққан орга-никалық заттардың табиғатына байланысты өзгеріп отырады. Мысалы, белок тотыққанда организм сіңірген оттегінің, әр литріне 4,8 ккал энергия, май тотыққанда — 4,7 ккал, ал көмірсулар тотыққанда -5,05 ккал энергия бөлінеді. Демек, организм шығындаған энергияны анықтау үшін денеде тотыққан запъщ табиғатын білу керек. Ал, оны тыныс коэффициенгі (ТК) арқылы анықтайды. Тыныс коэффициенгі деп организмнен бөлінген көмір қышқыл газының ол сіңірген оттегіге көлемдік катынасын айтады. Организмде көмірсулар тотыққаңда тыныс коэффициенті 1-ге тең, белок то-тықса — 0,8, май тотықса — 0,7-ге тең болады. Аралас азықпен қоректенген жағдайда тыныс коэффициенті 0,7-1 аралығында, көбінесе 1-ге жақын, ал жыртқыш аңдарда — 0,75 шамасында қалыптасады. Организмде көмірсулардың майға айналу процесі жүрсе, тыныс коэффициенті 1-ден артып кетеді. Оның себебі көмірсулар құрамында маймен салыстырғанда оттегі көп, сондықтан майды түзуден артылған оттегі тотығу процесінде пайдаланылады да, ауадан оттегі аз сіңіріледі. Ашығу жағдайында организмде майдың көмірсуға айналу процесі жүрсе, тыныс коэффициенті 0,7-ден төмендеп кетеді. Бұл жағдайда ауадан сіңірілген оттегі тек қана майларды тотықтыру үшін ғана емес, көмірсулар молекуласын түзу үшін де жаратылады. Осы себепті ауадан оттегі көп мөлшерде қабылданады. Сонынен, организмнің энергия шығынын жанама жолмен анықтау үшін алдымен тыныс коэффициентін есептеп шығарады да, арнаулы таблицадан сол коэффициентке сай оттегінің немесе көмір қышқыл газының калориялық коэффициентін табады. Осы санды организм қабылдаған оттегі немесе бөлген көмір қышқыл газы мөлшеріне көбейту арқылы белгілі бір уақыт ішіндегі энергия шығынын анықтайды. Изотермия нерв жүйесінің дамуымен байланысты қалыптасқан қасиет, сондықтан төменгі сатыңағы жануарларда изотермия болмайды. Барлық омыртқасыз жануарларда, балықтарда, қос мекенділерде, бауырымен жорғалаушыларда дене температурасы тұрақсыз және қоршаған орта температурасына тәуелді озгеріп отырады. Осындай дене температурасының тұрақтылығын сақтай алмайтын жануарларды салқын қанды (пойкилотермиялы) жануарлар деп атайды. Дене температурасын тұрақты деңгейде сақтайтын жануарларды жылы қанды (гомойотермиялы) жануарлар дейді. Кейбір жануарлар жылдың бір мезгілінде гомойотермиялы орга-низм тәрізді, ал екінші бір мезгілінде пойкилотермиялы организмдер тәрізді тіршілік етеді Мұндай жануарларды гетеротермиялы жануарлар дейді. Гетеротермия — эволюция процесінде гомойотермиядан кеш пайда болған қасиет деп есептеледі. Бұл қасиет ортаның түрлі қолайсыз жағдайларына бейімделуде маңызды рөл атқарады. Қоректік заттар, су жетіспеген жағдайда, қоршаған орта температурасы төмендеп суығанда мұндай организмдер ұйқыға кетеді де, қолайлы жағдай туғанда оянып, гомойотермиялы жануарлар сияқты тіршілік етеді. 2. Тірі табиғат химиялық құрылыммен сипатталады. Негізгі химиялық механизмдер және негізгі заттар барлық тірі табиғата бір тұтас. Барлық ақуыздар жиырма аминқышқылдардан, барлық нуклеин қышқылдар төрт нуклеотидтерден құралады. Бір және сол атомды құрылымдар барлық организмдерде болады. Биохимиялық процестер іргелі және ұқсас (біртекті) болып келеді. Организмнің және клеткалардың қасиеті және құрылысы, ақуыздарды синтездеуге генетикалық ақпаратын беретін, яғни заң шығаруға ие болатын нуклеин қышқылдармен (ДНК және РНК) басқарылады. Ақуыздар өз кезегінде орындаушы болып келеді, өйткені клеткадағы бір де бір химиялық реакциялар арнай ферменттер қатысуынсыз жүрмейді. Организмдегі химиялық реакциялар метаболизмнің көп сатылы процестеріндегі тура және қайтымды байланыстармен реттелген сияқты, клеткалы және клетка ішілік мембраналармен жүзеге асатын компартментация әсерінен реакцияның кеңістіктік бөлінуімен реттеледі. Биологиялық молекулалар биологиялық эволюцияның дамуы кезінде пайда болатын әртүрлі организмдердің тіршілік әрекетінің процестеріне қатысады. Үлкен және кіші биологиялық молекулалар биосинтез, метоболизм және биоэнергетиканы қамтамасыз етеді. Нуклеин қышқылдар ақуыздардың биосинтезіне жауапты. Осыдан олар «заң шығарушы» қызметін атқаратынын көруге болады. Өз кезегінде «орындаушылар» ақуыздар барлық биохимиялық процестерге ката¬лизатор-фермент ретінде міндетті түрде қатысады. Биосинтезді және метаболизмді жүзеге асыру үшін клеткалардағы химиялық түрде жиналған қажетті энергия, көбінесе АТФ болып саналады. Метоболиттік биоэнергетикалық процестердің өзіндік нәтижесі АДФ және неорганикалық фосфаттан АТФ-ты синтездеуге ие болады. Бұл тыныс алу және ащу процестерінде жүреді. Оттегінің қатысуымен өтетін метоболиттік процестер (ен алдымен тыныс алу кезіндегі тотығып фосфорилдену) аноэробты процестерге қарағанда біршама аз және эволюциясы кеш анықталған. Оттегі қатысуынсыз азық заттарындағы органикалық молекула толық жануы (тотығу) мүмкін емес. Оған қарамастан осы күнгі анаэробтық клетканың қасиеті көрсеткендей және олар өмір сүру үшін қажетті энергияны тотығу-тотықсыздану процестері жүру кезінде алынады. Аэробты жүйеде сутегі акцептор (тотықтыру) ретінде О2, ал анаэробтыда басқа заттар болады. Оттегінсіз (О2) тотығу екі ашу жолымен жүзеге асады. Гликолиз және спирттік ашу. Гликолиз үш көміртегінен тұратын екі молекула пируватқа (пирожүзім қышқылы) дейін гексозаның (глюкоза) көп сатылы ыдырауы кезінде жүреді. Осы жолда НАД-тың екі молекулалары НАД-қа дейін тотықсызданады және АДФ-тың екі молекулалары фосфорилденіп АТФ-тың екі молекуласы алынады. Қайтымды реакция әсерінен НАД•H НАД+H пируваттан лактат (сүт қышқылы) алынады. Спирттік ашу кезінде пируваттан этил спиртті алынады. Қосымша СО2 бөлінеді. Реакцияда: С6Н12 О6 +4НАД +2АДФ-2Ф 2Н3С•CO•COOH+4НАД•Н+2АТФ, пируват 2Н3С•CO•COOH+4НАД•Н 2Н3С•CН (OH)•COOH+ 4НАД, лактат 2Н3С•CO•COOH+4НАД•Н 2С2Н5 ОН +2СО2 +4НАД Судың ыдырауы және СО2 бөлінуімен жүретін пентозофосфат деп аталатын гликолиттік және спирттік ашу қосымша саты болып табылады. Сыртқы ортада СО2 болғандықтан фотосинтез жүру мүмкіндігіне ие болды. Алғашқы бактериалды фотосинтез, ал сосын жасыл өсімдік фотосинтезі 3-2•109 (3-2миллион) жыл бұрын дамыған. Фотосинтез жарықтың жұтылуынан және оның энергиясы биологиялық молекулалардың химиялық энергиясына айналуынан тұрады. Бұл үшін жарықты сіңіретін (жұтатын) қосылыс қажет болды. Соның бірі порфиринді циклдерден тұратын хлорофилл және цитохромдар. Кванттық жарықтың жұтылу нәтижесінде хлорофилдегі электрондар жүйесі жоғарғы деңгейдегі энергияға ауысады. Әр қарай электрон¬дарды тасмалдайтын тізбек жұмыс істейді, оның негізгі қатысушылар тотығу-тотықсыздану ферменттері цитохромдар болып табылады. Алғашқыда хлорофилдегі жиналған энергия қоры биологиялық тиімді түрге АТФ және НАДФ-ке бөлінеді. Фотофосфорилдену жүреді. Демек, эволюцияның ең соңғы сатысында СО2–ның көмірсуларға дейін фотосинтетикалық тотықсыздану (тотығу) пайда болған. Сонда прокариоттағы суттегі (бактериалды фотосинтез) көзі ретінде әр түрлі молекулалар, ал жасыл өсімдіктерде су қызмет етеді. Қоршаған ортаға оттегі бөлінеді. Оның атмосфераға жиналуы фотосинтездің нәтижесі болып табылады. Жалпы реакциясы: 6СО2+12Н2О С6Н12 О6 +6Н2О +6О2 Метоболизмнің күрделі процестері, қор болып жиналған және жұмсалған энергия клеткада шоғырланған (локализованы). Тыныс алу митохондрия мембранасында, ал фотосинтез хлоропластың мембрана¬сында жүзеге асады. Биологиялық процестер эволюциялы бейім¬делген. Шөлдегі жануарлар және құстардың метоболиттік энергия көзі гликоген емес май болып табылады. Шөлде тек қана энергияның шығуын ғана қамтамасыз етпейді, сонымен бірге гликогеннің тотығуына қарағанда судың максималды бөлінуін қажет ететін майдың тотығу кезінде екі есе суды өндіру керек. Механикалық энергияны жылуға (үйкеліс жолымен, соғу және басқа) тез айналдыру белгілі, бірақ жылулықты механикалық энер-гияға айналдыру оңай емес. Ол үшін күрделі қүрылғымен, инженерлік қондырғы қажет. Одан, жүйеден жылу бөлігін алып кетіп, оны түрлендірусіз жүмысқа айналдыру. Бұл жердегі, теңсіз бағалы жылулық, кері бағытпен ағуы - сыртқы күйіне байланыстылығы, қайтымсыздық процессімен сипатталады. Мұндай түрдегі қайтымсыздық, дәл осындай болуы, соңғы температуралары кезіндегі, дене аралық жылу алмасу процессінде өтеді. Жылу өтуі, әр уақытта ыстық денеден аз қызған денеге, өзінен өзі тез өтеді, бірақ, кері процесс үшін қосымша жұмыс шығынын қажет ететін, салқынатқыш қондырғы керек. Жұмыстық дененің тепе-теңдік күйін өзгерту үшін, жылулық теңдігін (газдың барлық массаларындағы температураларының, әрбір нүктелерінің процессінде бірдей болуы) және механикалық (әрбір нүктедегі процесстері газдың барлық массаларындағы қысым, бірдей болуы шарт) жағдайын сақтау керек. Бүл, идеалды жағдайға жетуі мүмкін, мысалы, цилиндрдегі піспектің шексіз баяу қозғалыс кезінде, олардың қысымы барлық газдар көлемінде түрақталып үлгеруі тиіс. Піспекке тез немесе секірмелі түрде түсуінен, қысымның өзеруі, піспек жанындағы газ қысымы көп болғанмен, одан қашықтаған сайын азаяды. Жылулықтың тепе-теңдікке жетуі үшін, болжау қажет, жылу көзімен, газдың аралығындағы температураның, шексіз аз айырмашылығы кезіндегі, процесстің әр нүктесіне жылу берілуі жүргізіледі. Сонымен, сірә, әртүрлі температураға өтуін қайтарымды процесстерді жүргізу үшін, кезінде, әртүрлі температуралардағы шексіз өте көп, санды жылу көзінің шегін қажет етеді. Механикалық және жылулықтағы Р, V, Т - негізгі көрсеткіш-терінің тепе-теңдігі жағдайының өзгеруіне қарай, олар уақыт аралығында ауыспалы, бірақ газдардың орналасуындағы әрбір, моменттегі барлық көлемі бойынша бірдей болады. Егер, тепе-теңдік процессінің не мына, не басқа багытта пайда болмауы, сол жумыстық денеде қалған соңғы өзгеруін қошаган ортадагы қайтымдылыгы деп аталады. Осы жагдайларды қанагаттандырмаса, онда қайтымсыз деп аталады. |
