Миология. 1. Физиологическая роль углеводов в организме
 Скачать 122.5 Kb. Скачать 122.5 Kb.
|
|
1.Физиологическая роль углеводов в организме. Физиологическое значение углеводов в основном определяется их энергетическими свойствами. Углеводы являются динамогенными поставщиками энергии, используемыми в организме в процессе мышечной деятельности. Каждый грамм углеводов обеспечивает поступление 16,7 кДж (4 ккал). Значение углеводов как источника энергии определяется их способностью окисляться в организме, как аэробным, так и анаэробным путем. Углеводы в наибольшей степени способны удовлетворить потребности организма в энергии и способствовать снижению ацидотических сдвигов. При всех видах физического труда отмечается повышенная потребность в углеводах. Углеводы входят в состав клеток и тканей и в какой-то мере участвуют в пластических процессах. Несмотря на постоянное расходование клетками и тканями своих углеводов на энергетические цели содержание углеводов в них поддерживается на постоянном уровне при условии достаточного их поступления с пищей. Некоторые углеводы обладают выраженной биологической активностью, выполняя в организме специализированные функции. К таким углеводам относятся аскорбиновая кислота, обладающая С-витаминными свойствами, гепарин, предотвращающий свертывание крови в сосудах, гиалуроновая кислота, препятствующая проникновению бактерий через клеточную оболочку, олигосахариды женского молока, задерживающие развитие некоторых кишечных бактерий, гетерополисахариды крови, определяющие специфичность групп крови, и др. Углеводы и их метаболиты играют важную роль в синтезе нуклеиновых кислот, аминокислот, гликопротеинов, мукополисахаридов, коэнзимов и других жизненно необходимых веществ. В организме углеводы депонируются ограниченно и запасы их невелики. Имеющееся в печени углеводное депо характеризуется относительно небольшой емкостью, и для удовлетворения потребностей организма углеводы поступают бесперебойно в составе пищи. Углеводы тесно связаны с обменом жира - при больших физических нагрузках, когда расход энергии не покрывается углеводами пищи и углеводными запасами организма, происходит образование сахара из жира, всегда в достаточном количестве содержащегося в жировых депо организма. Однако чаще наблюдается обратное влияние, т.е. образование новых количеств жира и пополнение ими жировых депо организма за счет избыточного поступления углеводов с пищей. Избыток углеводов — широко распространенное явление. Это один из основных факторов в формировании избыточной массы тела. Углеводы являются основной частью пищевого рациона. За счет углеводов обеспечивается около половины суточной энергетической ценности пищевого рациона, Потребление углеводов составляет 400-500 г/сут. Удовлетворение потребности в углеводах осуществляется за счет растительных источников. B растительных продуктах (зерновые и др.) углеводы составляют не менее 75% сухого вещества. Потребность в углеводах может удовлетворяться и за счет сахара, который представляет собой чистый углевод. Усвояемость углеводов достаточно высока: в зависимости от пищевого продукта и характера углеводов, она колеблется от 85 до 98%. Так, коэффициент усвояемости углеводов хлебных и крупяных продуктов составляет 94---96, овощей -- 85, картофеля — 95, фруктов и ягод -- 90, кондитерских изделий -- 95, сахара -- 99, молока и молочных продуктов-98. Правильная кулинарная обработка, измельчение и тщательная тепловая обработка повышают усвояемость углеводов и других компонентов пищи. Значение животных продуктов как источника углеводов невелико. Основным углеводом животного происхождения является гликоген, обладающий свойствами крахмала, содержится в животных тканях в небольшом количестве. Другой углевод лактоза (молочный сахар) - содержится в молоке в количестве 5 г на 100 г. продукта и более. При систематическом потреблении молока, оно может служить источником углеводов, особенно в детском и пожилом возрасте. 2.Пищевые источники и потребность организма в углеводах. Переваривание углеводов в желудочно-кишечном тракте. Судьба всосавшихся моносахаридов. Наследственные нарушения обмена полисахаридов и дисахаридов: галактоземия , непереносимость фруктозы, непереносимость дисахаридов. Гликогенозы и агликоненозы. Углеводы – это основной и незаменимый источник энергии в организме, они обеспечивают около 60% энергозатрат человека. Потребность в углеводах более всего зависит от возраста, характера и интенсивности труда. Согласно традиционной системе питания, в среднем, взрослый здоровый человек, должен потреблять 300-500 г углеводов в сутки, а в отдельных случаях этот показатель может вырасти до 600-800 г. Пищевые источники углеводов разделяют на группы исходя из количества содержащихся углеводов, а также по скорости их расщепления в организме. По количеству входящих в состав углеводов, продукты делятся на следующие группы: Наибольшее количество углеводов (более 65 г на 100 г продукта) содержат следующие продукты: сахар, конфеты, мед, варенье, мармелад, зефир, печенье сдобное, рис, макароны, крупы, финики, изюм, чернослив, сухофрукты. Большое количество углеводов (40-60 г на 100 г продукта) содержат следующие продукты: хлеб, фасоль, горох, черный шоколад, халва, пирожные, шиповник сушенный, инжир сушенный, ликер. Средние количества углеводов (20-40 г на 100 г продукта) содержат следующие продукты: хлеб бородинский, бананы, шиповник свежий, соя, фисташки, кокос, белый шоколад. Малое количество углеводов (менее 20 г на 100 г продукта) содержат следующие продукты: молоко и молочные продукты, овощи, большинство фруктов, бобы, грибы, яичный порошок, орехи. Рацион взрослого здорового человека в среднем должен содержать около 300-500 г углеводов в сутки, но не ниже 100-150 г В ежедневный рацион должно входить не менее 25 г пищевых волокон, старайтесь получать их из натуральных источников, таких как овощи и фрукты Употребляйте углеводы с низким или средним показателем ГИ, особенно если у вас проблемы с лишним весом, они позволят вам долго не испытывать чувство голода Различают следующие пищевые углеводы 80% приходится на долю крахмала – резервного полисахарида растений. В продуктах животного происхождения содержится гликоген – «животный крахмал». С растительной пищей поступает целлюлоза. С пищей также поступают дисахариды – сахароза, или тростниковый сахар, лактоза- или молочный сахар, а также моносахариды: глюкоза – виноградный сахар, фруктоза. Этих моносахаридов также много в меде. В составе НП в организм поступают пентозы. Роль углеводов пищи: 1) энергетическая – 99%потребляемых увд используется на производство свободной энергии; 2) пластическая, строительная, или структурная – ГАГи, ГП и другие белки (почти все белки организма имеют в своем составе углеводы), НК, липиды, Ко, глюкуронаты, ГЛ мембран; 3) резервная – гликоген запас глюкозы; 4) сигнальная – углеводы входят в состав рецепторов (их узнающей части) и в состав ряда гормонов, например, в состав ТТГ, ФСГ. Углеводы обеспечивают антигенность тканей. Переваривание и всасывание углеводов 1 этап – переваривание. В ротовой полости начинается переваривание крахмала и гликогена пищи под действием альфа-амилазы слюны. В желудке нет гликозидаз, но пищевой комок продолжает перевариваться распаду под действием альфа-амилазы слюны до тех пор, пока не пропитается кислым содержимым желудка. При этом альфа-амилаза слюны ингибируется, т.к. рН желудка не соответствует оптимуму рН данного фермента. В кишечнике рН 8,0-9,0 и действие альфа-амилазы слюны возобновляется. Сюда же поступает альфа-амилаза поджелудочной железы и оба фермента расщепляют крахмал и гликоген до мальтозы. В кишечнике мальтоза расщепляется до 2-х глюкоз под действием мальтазы (образуется кишечными клетками). Здесь же под влиянием лактазы кишечного сока лактоза расщепляется до галактозы и глюкозы. Под действием сахаразы кишечного сока сахароза расщепляется до фруктозы и глюкозы. Целлюлоза в ЖКТ не распадается из-за отсутствия соответствующих ферментов, ее роль заключается в активации перистальтики кишечника и очищении ворсинок кишечника. Переваривание НК дает пентозы. Т.о., все углеводы пищи перевариваются в кишечнике до гексоз. Все процессы переваривания идут на поверхности эпителия кишечника и поэтому называются пристеночным пищеварением. 2 этап – всасывание продуктов переваривания. Моносахариды всасываются микроворсинками эпителия тонкого кишечника с различной скоростью. Первой всасывается галактоза, затем глюкоза, фруктоза и пентозы. Различие в скорости всасывания зависит от типа всасывания. Галактоза, глюкоза всасываются путем вторично-активного транспорта в виде фосфорилированных производных (галактозо-6-фосфата, глюкозо-6-фосфата), которые в клетках кишечника дефосфорилируются и поступают в кровь воротной вены в свободном виде. Фруктоза и пентозы всасываются путем простой диффузии (пассивно). Считается, что часть фруктозы может превратиться в глюкозу. При большом содержании галактозы, глюкозы и фруктозы в просвете кишечника эти моносахара также могут всасываться пассивно. Т.о., в крови воротной вены имеются различные моносахариды, их качество зависит от вида принимаемой пищи. Количество их также сильно варьирует – в разгар пищеварения их много, натощак мало. Моносахариды быстро поглощаются паренхиматозными клетками печени, где происходит превращение всех моносахаридов в глюкозу. Т.о., глюкоза – единственный моносахарид, поступающий в большой круг кровообращения. 3.Глюкоза как важнейший метаболит углеводного обмена: общая схема источников и путей использования глюкозы в организме. Глюкоза (от греч. glykys — сладкий), виноградный сахар, декстроза; углевод, наиболее часто встречающийся в природе; относится к гексозам, т. е. моносахаридам, содержащим 6 углеродных атомов. Бесцветные кристаллы, tпл 146,5 °С. Хорошо растворима в воде. Раствор глюкозы содержит молекулы в a-форме и b-форме; равновесное состояние достигается при соотношении этих форм 37% и 63%. Глюкоза оптически активна, вращает поляризованный луч вправо. a-Глюкоза — необходимый компонент всех живых организмов — от вирусов до высших растений и позвоночных животных (включая человека); входит в состав различных соединений — от сахарозы, целлюлозы и крахмала до некоторых гликопротеидов и вирусной рибонуклеиновой кислоты. Для ряда бактерий глюкоза — единственный источник энергии. Глюкоза участвует во многих реакциях обмена веществ Содержание глюкозы в крови человека около 100 мг%, оно регулируется нейро-гуморальным путём (см. Углеводный обмен). Снижение содержания глюкозы (см. Гипогликемия) до 40 мг% вызывает резкое нарушение деятельности центральной нервной системы. Основные пути использования глюкозы в организме: анаэробные превращения, сопровождающиеся синтезом АТФ (см. Аденозинфосфорные кислоты) и заканчивающиеся образованием молочной кислоты (см. Гликолиз); синтез гликогена; аэробное окисление до глюконовой кислоты под действием фермента глюкозооксидазы (процесс присущ некоторым микроорганизмам, использующим его для получения энергии, протекает с поглощением кислорода воздуха); превращения в пентозы и др. простые сахара (пентозофосфатный цикл). При полном ферментативном окислении глюкозы до CO2 и H2O выделяется энергия: C6H12O6 + 6O2 ® 6CO2 + 6H2O + 686 ккал/моль, значительная часть которой аккумулируется макроэргическими соединениями типа АТФ. Синтез глюкозы из неорганических компонентов представляет обратный процесс и осуществляется растениями и некоторыми бактериями, использующими энергию солнечного света (фотосинтез) и химических окислительных реакций (хемосинтез). 4.Гликоген как резервный полисахарид. Глюкостатическая функция печени: А)Синтез гликогена из глюкозы(гликогеногенез). Б)Амилолитический инфосфоролитический пути распада гликогена. Гликоген (С6Н10О5)n – резервный полисахарид, который содержится в животных организмах, а также в клетках грибов, дрожжей и некоторых растений (кукурзы). В животных организмах гликоген локализируется в печени (20%) и мышцах (4%). Гликогеногенез. 5% глюкозы превращается в гликоген. Образование гликогена называется гликогеногенезом. 2/5 запасов гликогена (примерно 150 грамм) откладывается в паренхиме печени в виде глыбок (10% на сырую массу печени). Остальной гликоген откладывается в мышцах и других органах. Гликоген служит резервом углеводов для всех органов и тканей. Запас углеводов в виде гликогена обусловлен тем, что гликоген как ВМС в отличие от глюкозы не повышает осмотического давления клеток. Гликогеногенез — сложный, многоступенчатый процесс, катализируемый гликогенсинтетазой и использующий энергию УТФ. Синтез гликогена начинается с переноса глюкозы в виде УДФ-глюкозы на остаток гликогена, который выполняет роль затравки. Глюкоза присоединяется к конечной молекуле глюкозы гликогена с помощью гликогенсинтетазы, наращивающей линейную полисахаридную цепь. Амилолитический путь распада гликогена происходит при участии фермента амилазы. Фосфоролитический путь – основной путь распада гликогена с образованием глюкозы:  В мышечной ткани нет фермента глюкозо-6-фосфатазы, поэтому гликоген мышц не распадается с образованием глюкозы, а окисляется или аэробным или анаэробным путем с освобождением энергии. Через 10-18 часов после приема пищи запасы гликогена в печени значительно истощаются. Регуляция уровня глюкозы в крови. Роль ЦНС, механизм действия инсулина, адреналина, глюкагона, СТГ, глюкокортикоидов, тироксина и их влияние на состояние углеводного обмена. Ведущее значение в регуляции углеводного обмена принадлежит центральной нервной системе. Снижение уровня глюкозы в крови приводит к повышенной секреции адреналина, глюкагона, которые, поступая в орган-мишень для этих гормонов (печень), узнаются рецепторами мембран клеток печени и активируют фермент мембраны аденилатциклазу, запуская механизм, приводящий к распаду гликогена с образованием глюкозы. Адреналин – повышает уровень глюкозы за счет активации фермента фосфорилазы (аденилатциклазная система), которая приводит к распаду гликогена с образованием глюкозы, блокирует фермент гликогенсинтазу, т.е. синтез гликогена. Глюкагон – действует подобно адреналину, но плюс к этому активирует ферменты глюконеогенеза. Глюкокортикоиды – повышают уровень глюкозы крови, являясь индукторами синтеза ферментов глюконеогенеза. СТГ актвирует глюконеогенез, тироксин активирует инсулиназу, расщепляющую инсулин, влияет на всасывание глюкозы в кишечнике. 5.Глюкоза крови. Регуляция уровня глюкозы крови. Роль адреналина, глюкагона, инсулина, тиреоидных гормонов. Глюкоза крови Сахар крови норма 3,3–5,5 ммоль/л – норма независимо от возраста; кровь из пальца (натощак): 3,3–5,5 ммоль/л – норма независимо от возраста; 5,5–6,0 ммоль/л – предиабет, промежуточное состояние. Его также называют нарушением толерантности к глюкозе (НТГ), или нарушенной гликемией натощак (НГН); 6,1 ммоль/л и выше – сахарный диабет. Если кровь брали из вены (тоже натощак), норма примерно на 12% выше – до 6,1 ммоль/л (сахарный диабет – если выше 7,0 ммоль/л). Сдвиги в концентрации глюкозы в крови воспринимаются глюкорецепторами гипоталамуса. Эти влияния обусловливают срочное повышение или снижение выработки инсулина, глюкагона и адреналина эндокринным аппаратом поджелудочной железы и надпочечников. Более медленный эффект осуществляется через гормоны гипофиза. Существует и более короткая связь —вырабатываются инсулин и глюкагон специализированными клетками поджелудочной железы, составляющими островки Лангерганса. 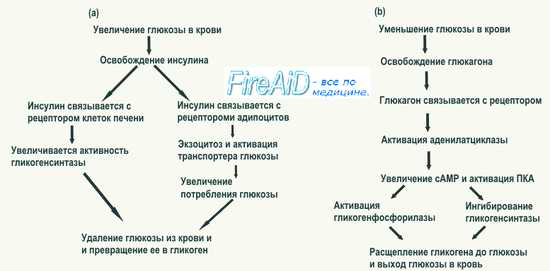 Инсулин.В ответ на повышение уровня сахара в крови поджелудочная железа начинает выделять инсулин. В открытую инсулином клетку начинает поступать из крови глюкоза, которая превращается в энергию, и содержание сахара в крови снижается.Основное действие инсулина направлено на клетки печени, мышц и жировую ткань. В клетках печени инсулин помогает преобразовывать глюкозу в гликоген – форму хранения глюкозы и производить триглицериды - форму хранения жира. В мышцах при помощи инсулина осуществляется транспорт глюкозы в мышечные клетки. В жировой ткани инсулин приостанавливает распад триглицеридов и выход жирных кислот в кровоток. Глюкагон вырабатывается альфа-клетками островков Лангерганса, что происходит при понижении уровень глюкозы в крови. Гормон вызывает превращение гликогена в глюкозу и выделение ее в кровь, а также побуждает печень, мышцы и другие клетки организма вырабатывать глюкозу из других веществ, например из белков. Адреналин выделяется из мозгового вещества надпочечников. Он усиливает распад гликогена в мышцах и печени, активируя фосфорилазу гликогена и переход глюкозы в кровь за счет активизации глюкозо-6-фосфотазы, что стимулирует выведение глюкозы из печени в кровь.Адреналин оказывает преимущественное действие на мышечные клетки, а глюкагон – на клетки печени. Глюкокортикоиды, проявляя катаболическое действие, вызывают снижение проницаемости клеточных мембран и соответственно торможение поглощения глюкозы, происходит усиление глюконеогенеза (образование молекул глюкозы из молекул других органических соединений —например, свободных аминокислот, молочной кислоты, глицерина. Уровень глюкозы в крови называется гликемией. Повышенное содержание сахара в крови называется гипергликемия, а пониженное — гипогликемия. Норма сахара в крови — 3,3 – 5,5 ммоль/л натощак и до 7,8 ммоль/л после еды. Или от 70 г до 110 г на 100 мм. 6.Гипо- и гипергликемия. Гипергликемия здоровых людей(алиментарная,эмоциональная). Гипогликемия новорожденных. Патологическая гепергликемия. Гипо- и гипергликемия. Сахарный диабет, биохимические основы накопления кетоновых тел при сахарном диабете. Для синтеза глюкозы в печени необходим фосфоенолпируват. Однако его образование в печени окажется очень неэффективным, если фосфоенолпируват будет дефосфорилироваться под действием пируваткиназы с образованием пирувата. Как избежать этого холостого цикла? Почему этот механизм не подходит для мышц? Гипергликемия – клинический симптом, обозначающий увеличение содержания глюкозы в сыворотке крови: Гипогликемия – патологическое состояние, характеризующееся снижением уровня глюкозы периферической крови ниже нормы (3,3 ммоль/л). ГИПЕРГЛИКЕМИЯ(от греч. hyper — сверх, чрезмерно, glykys — сладкий и haima — кровь), увеличение содержания сахара в крови. Кол-во сахара (в основном глюкозы) в крови большинства животных составляет 40,0—140 мг%. Этот уровень сахара регулируется адреналином и инсулином, функция к-рых находится под влиянием гипофиза и ц. н. с. Временная Г. может возникнуть у здоровых животных после приёма кормов, содержащих большое кол-во легко усвояемых углеводов (пищевая Г.), при воздействии стрессовых факторов, сильных болях, усиливающих поступление в кровь адреналина, а также после введения адреналина и тиреоидина. Стойкая Г. развивается в результате нарушения нервно-эндокринной регуляции углеводного обмена и встречается при диабете сахарном и др. эндокринных болезнях, при опухолях надпочечников, поражениях гипофиза, болезнях головного мозга, беременности, гиповитаминозах С и B1, лихорадке, эфирном и хлороформенном наркозе и др. Резкая Г. отмечается при гипоксич. состояниях, обусловленных аcфиксией, кровопотерей, отравлением окисью углерода. Более 30 лет известен тот факт, что уровень сахара в крови у новорожденных, и особенно у недоношенных, может быть настолько низким, что приводит к тяжелым последствиям, проявляющимся в более старшем возрасте. В последние годы было показано, что часть случаев гипогликемии у новорожденных также не безвредна, она представляет собой опасное состояние, которое при определенных условиях может привести к необратимым изменениям в нервной системе и даже к смерти ребенка. Уже в первые часы жизни уровень сахара в крови новорожденных снижается до 50 мг%, а у недоношенных - до 40 мг%. При голодании уровень сахара еще более понижается, однако клиническая симптоматика появляется только, когда уровень сахара падает ниже 20 мг%. Отметим, что речь идет об «истинном» сахаре или об «истинной» глюкозе, а не об определяемых по методу Хагедорна- Йенсена «общих редуцирующих веществах». Гипогликемии, проявляющейся «симптоматическими» клиническими признаками, в основном подвержены следующие категории новорожденных: 1. дети с внутриутробной гипотрофией, 2. недоношенные с низким весом, 3. дети матерей, страдающих диабетом, 4. дети, родившиеся в глубокой асфиксии, 5. дети, которым было произведено обменное переливание крови. Так как примерно 1/3 всех новорожденных с весом менее 2,5 кг составляют дети с внутриутробной гипотрофией, а у 6% этих детей обнаруживается симптоматическая гипогликемия, понятно, что именно эта категория новорожденных имеет наибольшее клиническое значение с точки зрения опасности гипогликемии. У детей, родившихся от матерей, страдающих диабетом, признаки гипогликемии появляются уже в первые часы жизни, у других новорожденных - в первые 12-72 часа. Ранними признаками гипогликемии являются гипотония, тремор, беспокойство, нистагм, бледность. Наиболее частым и в то же время наиболее опасным признаком являются приступы апноэ: дыхание останавливается на полминуты и более, появляется цианоз, после нескольких беспорядочных вдохов дыхание снова несколько стабилизируется; но иногда, если помощь не оказана вовремя, может наступить смерть вследствие паралича дыхательного центра. Гипогликемические судороги (общие конвульсии) отмечаются только у половины больных. Патологические типы гипергликемий обусловлены эндокринными расстройствами, в частности нарушением оптимального соотношения между секрецией гормонов гипер- и гипогликемического действия. Наиболее распространенная форма патологической гипергликемии – сахарный диабет, обусловленный дефицитом инсулина. В норме продукцию инсулина секреторными клетками поджелудочной железы стимулирует глюкоза, лейцин и глутаминовая кислота, кетоновые тела и некоторые жирные кислоты. Дефицит инсулина может быть обусловлен генетическими нарушениями синтеза этого гормона или заболеваниями поджелудочной железы (панкреатит, панкреонекроз) – вторичный диабет. При дефиците инсулина развивается гипергликемия, которая вызвана нарушением транспорта глюкозы в клетки. Кроме того, дефицит инсулина приводит к стимуляции глюконеогенеза и гликогенолиза. Глюкозурия (глюкоза в моче) связана с нарушением инсулинзависимой реабсорбции глюкозы. Кетонемия и кетонурия обусловлены тем, что дефицит глюкозы в клетках активирует окисление жирных кислот где образуется большое количество ацетил-КоА. Он не может быть полностью использован в ЦТК и часть его идет на синтез кетоновых тел. Накопление их в крови приводит к кетоацидозу, т.е. к смещению кислотно-основного состояния организма в кислую сторону. Помимо сахарного диабета гипергликемии могут быть обусловлены повышенной секрецией соматотропного гормона и АГКТ, катехоламинов и глюкокортикоидов как результат заболеваний гипоталамуса и надпочечников. 7.Глюкозурия. Понятие о почечном пороге для глюкозы крови. Глюкозурии У здорового человека в почке происходит практически полная реабсорбция профильтровавшейся глюкозы, если ее концентрация в плазме крови нормальная или низкая. и, соответственно, в первичной моче вся глюкоза реабсорбируется. При избытке глюкозы в крови, а значит, в первичной моче может произойти максимальная загрузка канальцевых систем транспорта, т.е. всех молекул-переносчиков. В этом случае глюкоза больше не сможет реабсорбироваться и появится в конечной моче (глюкозурия). Глюкозурия - появление глюкозы в моче. Появление глюкозы в моче зависит от трех факторов: — концентрации глюкозы в крови; — количества фильтрата клубочков почки за 1 минуту; — количества реабсорбированной в канальцах глюкозы. Причинами глюкозурии могут быть: дефицит инсулина снижение функции почек и/или печени нарушение гормональной регуляции углеводного обмена, употребление в пищу большого количества углеводов Появление глюкозы в моче зависит либо от её концентрации в крови либо от процессов фильтрации и реабсорбции глюкозы в нефроне: повышение сахара в крови выше 9,9 ммоль/л вызывает появление глюкозурии (преодоление так называемого «почечного порога»). Глюкозурия, связанная с гипергликемией, может быть физиологической и патологической(сахарный диабет, глюкокортикоидов, адреналина). 8.Клиническое значение качественного и количественного определения глюкозы в моче. Качественные реакции на глюкозу, основанные на ее восстанавливающей способности. Качественное определение глюкозы в моче можно проводить с помощью давно используемых методов Ниландера, Троммера, Феллинга, Альтхаузена, основанных на редуцирующих свойствах глюкозы. В настоящее время с этой целью используют индикаторные полосы, определяющие глюкозу ферментным глюкозооксидным методом. В Риге «Реагент» выпускают индикаторные полоски «Глюкотест», позволяющие определить минимальные (от 0,1%) количества глюкозы в моче. В присутствии аскорбиновой кислоты в моче индикаторные полосы дают ложноположительные результаты. В большинстве лабораторий количественное определение содержания сахара в моче проводится поляриметрическим методом, результаты которого во многом зависят от содержания в моче различных веществ. Глюкоза, характеризуется правовращающими свойствами. Пенициллин, также обладающий правовращающими свойствами (плюсзначения), повышает результаты определения сахара в моче, напротив, левовращающий тетрациклин (минусзначения) снижает их. При содержании сахара в моче более 1% целесообразно использовать ферментные методы определения. Определение содержания глюкозы в моче имеет большое значение не столько для диагностики, сколько для контроля за состоянием больных сахарным диабетом. Иногда диагностике диабета помогает определение кетоновых тел в моче. Их определяют с помощью набора для определения ацетона в моче, выпускаемого отечественной промышленностью, а также индикаторных полос (ацетотест, кетостикс). Для диагностики сахарного диабета можно использовать и другие пробы с нагрузкой глюкозой, в частности внутривенную пробу с нагрузкой глюкозой, не зависящую от всасывания глюкозы в кишечнике. Методика пробы: определяют глюкозу крови натощак, после чего обследуемому вводят в вену 150 мл раствора, состоящего из 50 мл 50% раствора глюкозы и 100 мл 0,9% раствора хлорида натрия в течение 5 мин. Затем каждые 10 мин в течение часа определяют содержание глюкозы в крови. Диагностические критерии внутривенного теста на толерантность к глюкозе: К < 1,0 диабетический; К — 1,0—1,2 — сомнительный; К — 1,2—2,2 нормальный; К > 2,2 — повышенная толерантность к глюкозе; К — процентная константа элиминации. Качественные реакции на глюкозу основаны главным образом на ее способности восстанавливать окиси металлов; таковы например: проба Тром-мера или Фелинга—восстановление окиси меди в закись, проба Бетгера-Ниландера— восстановление окиси висмута в металлический висмут, восстановление окиси серебра. Другие реакции—получение глюко-зазона, проба на брожение, поляриметрическое исследование. С помощью всех этих реакций можно открывать присутствие глюкозы в моче. Количественное определение содержания Г. в моче и крови производится с помощью разных методов, основанных также на восстанавливающей способности Г. Для мочи пользуются чаще всего способом Фелинга-Певи. Содержание глюкозы в крови чаще всего определяют по способу Банга или Хагедорн - Иенсена. Существуют также колориметрические методы (Фолина, Бенедикта). 9.Изучение углеводного обмена методов однократной сахарной нагрузки: А)Нормальная сахарная кривая. Биохимические механизмы, определяющие изменения концентрации глюкозы после сахарной нагрузки. Б)Изменения сахарной кривой, характерные для заболеваний печении, щитовидной и поджелудочной желез. Инсулин – единственный гормон, понижающий уровень глюкозы в крови. Механизм: -повышает проницаемость клеточных мембран для глюкозы в клетках жировой и мышечной ткани, под его влиянием белки-транспортеры ГЛЮТ-4 перемешаются из цитоплазмы в мембрану клетки, где соединяются с глюкозой и транспортируют её во внутрь клетки; -активирует гексокиназу, фруктокиназу, пируваткиназу (стимулирует гликолиз); -активирует гликогенсинтетазу (стимулирует синтез гликогена); -активирует дегидрогеназу пентозо-фосфатного пути; -по механизму хронической регуляции является индуктором синтеза гексокиназы и репрессором синтеза ферментов глюконеогенеза (блокирует глюконеогенез); -30% углеводов превращает в липиды; -стимулирует ЦТК, активируя фермент синтетазу, которая катализирует реакцию взаимодействия ацетил-КоА с ЩУК; Сахарный диабет (СД) классифицируют с учетом различия генетических факторов и клинического течения на две основные формы: диабет I типа – инсулинзависимый (ИЗСД), и диабет II типа – инсулиннезависимый (ИНСД). ИЗСД – заболевание, вызванное разрушением β-клеток островков Лангерханса поджелудочной железы, вследствие аутоиммунных реакций, вирусных инфекций (вирус оспы, краснухи, кори, эпидемический паротит, аденовирус). При СД снижено соотношение инсулин/глюкагон. При этом ослабевает стимуляция процессов депонирования гликогена и жиров, и усиливается мобилизация энергоносителей. Печень, мышцы и жировая ткань даже после приема пищи функционируют в режиме постабсорбтивного состояния. Гипергликемия – повышение конц. глюкозы в крови. Она обусловлена снижением скорости использования глюкозы тканями вследствие недостатка инсулина или снижения биологического действия инсулина в тканях-мишенях. При дефиците инсулина уменьшается количество белков-переносчиков глюкозы (ГЛЮТ-4) на мембранах инсулинзависимых клеток (жировой ткани мышц). В мышцах и печени глюкоза не депонируется в виде гликогена. В жировой ткани уменьшается скорость синтеза и депонирования жиров. Активируется глюконеогенез из аминокислот, глицерола и лактата. Глюкозурия – выделение глюкозы с мочой. В норме проксимальные канальцы почек реабсорбируют всю глюкозу, если ее уровень не превышает 8,9 ммоль/л. Повышение концентрации глюкозы в крови превышает концентрационный почечный порог, что становится причиной появления ее в моче. Кетонемия – повышение концентрации в крови кетоновых тел. Жиры не депонируются, а ускоряется их катаболизм. Повышается концентрация неэтерифицированных жирных кислот, которые захватывает печень и окисляет их до ацетил – КоА. Ацетил-КоА превращается в β-гидроксимасляную и ацетоуксусную кислоты. В тканях происходит декарбоксилирование ацетоацетата до ацетона, поэтому от больных исходит его запах. Увеличение концентрации кетоновых тел в крови (выше 20 мг/л) приводит к кетонурии. Накопление кетоновых тел снижает буферную емкость крои и вызывает ацидоз. Дефицит инсулина приводит к снижению скорости синтеза белков и усилению их распада. Это вызывает повышение концентрации аминокислот в крови, которые дезаминируются в печени. Образующийся при этом аммиак вступает в орнитиновый цикл, что приводит к увеличению концентрации мочевины в крови и моче – азотемия. Полиурия – повышенное мочеотделение (3-4л в сутки и выше), т.к. глюкоза повышает осмотическое давление. Полидипсия – постоянная жажда, сухость во рту, вследствие потери воды. Полифагия – испытывают голод, часто едят, но теряют в массе тела, т.к. глюкоза не является источником энергии - «голод среди изобилия». ИНСД – возникает в результате относительного дефицита инсулина вследствие: - нарушения секреции инсулина - нарушения превращения проинсулина в инсулин - повышения катаболизма инсулина -дефекта рецептора инсулина, повреждения внутриклеточных посредников инсулинового сигнала. Поражает людей старше 40 лет, характеризуется высокой частотой семейных форм. Главная причина поздних осложнений сахарного диабета – гипергликемия, которая приводит к повреждению кровеносных сосудов и нарушению функций различных тканей и органов. Одним из основных механизмов повреждения тканей при сахарном диабете является гликозилирование белков, приводящее к изменению их конформации и функций. Макроангиопатии проявляются в поражении крупных и средних сосудов сердца, мозга, нижних конечностей (гангрена). Микроангиопатия является результатом повреждения капилляров и мелких сосудов и проявляется в форме нефро-, нейро- и ретинопатии. В возникновении микроангиопатий определенную роль играет гликозилирование белков, что приводит к возникновению нефропатии (нарушение функции почек) и ретинопатии (вплоть до потери зрения). Коллаген составляет основу базальных мембран капилляров. Повышенное содержание гликозилированного коллагена ведет к уменьшению его эластичности, растворимости, к преждевременному старению, развитию контрактур. В почках такие изменения приводят к запустению клубочков и хронической почечной недостаточности. Гликозилированные липопротеины, накапливаясь в сосудистой стенке, приводят к развитию гиперхолестеринемии и липидной инфильтрации. Они служат основой атером, происходит нарушение сосудистого тонуса, что приводит к атеросклерозу. Нормальные величины: натощак 3,9-5,8 ммоль/л (100 %) через 60 мин 6,7-9,4 ммоль/л (150-175%) через 120 мин ниже 6,7 ммоль/л Это заболевание, возникающее вследствие абсолютного или относительного дефицита инсулина. |
