1. Иммунитет. Определение, виды и их сравнительная характеристика. Иммунитет
 Скачать 0.69 Mb. Скачать 0.69 Mb.
|
|
Иммуноглобулин класса E называют также реагином. Содержание в сыворотке крови крайне невысоко - примерно 0,00025 г/л. Молекулярная масса около 190 кД, константа седиментации примерно 8S, мономер. На его долю приходится около 0,002% всех циркулирующих Ig. Этот уровень достигается к 10-15 годам жизни. Синтезируется зрелыми В-лимфоцитами (Βε) и плазматическими клетками преимущественно в лимфоидной ткани бронхолегочного дерева и желудочно-кишечного тракта. Не связывает комплемент. Не проходит через плацентарный барьер. Обладает выраженной цитофильностью - тропностью к тучным клеткам и базофилам. Участвует в развитии гиперчувствительности немедленного типа - реакция I типа . Иммуноглобулин класса D практически полностью содержится в сыворотке крови в концентрации около 0,03 г/л (около 0,2% общего количества циркулирующих Ig). IgD имеет молекулярную массу 160 кД и константу седиментации 7S, мономер. Не связывает комплемент. Не проходит через плацентарный барьер. Экспрессируется на предшественниках В-лимфоцитов.
Рецепторные иммуноглобулины, или мембранные, локализуются на цитоплазматической мембране В-лимфоцитов и выполняют функции их антигенспецифических рецепторов. Имеют те же изотип и специфичность, что и синтезируемые в межклеточную среду антитела. Содержат особый дополнительный M-пептид, благодаря которому молекула рецепторного Ig фиксируется в цитоплазматической мембране иммунокомпетентной клетки. Нормальные антитела, или естественные, - совокупность Ig сыворотки крови человека различной специфичности, формирующих их базальный уровень. К ним относят изогемагглютинины - антитела к эритроцитарным антигенам групп крови (например, система АВ0), антигенам бактерий кишечной группы, кокков и некоторых вирусов. Эти антитела постоянно образуются в организме без видимой антигенной стимуляции. Отражают готовность макроорганизма к иммунному реагированию, а также свидетельствуют об отдаленном контакте с антигеном. 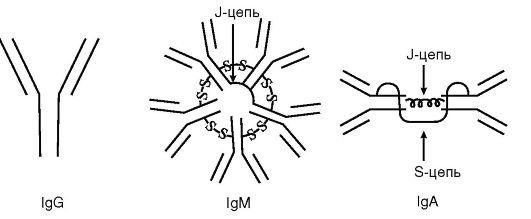 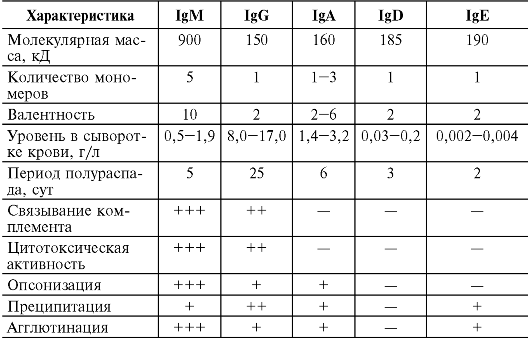 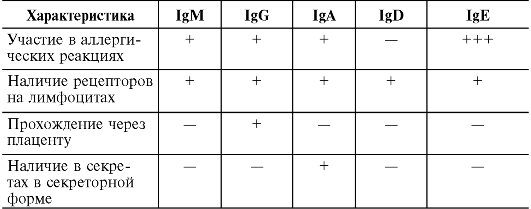 32) Антигенные свойства иммуноглобулинов, изотипы, аллотипы, идиотипы. Полные и неполные антитела. Иммуноглобулин, как и всякий белок, обладает антигенностью и выраженной иммуногенностью. В молекуле Ig различают 4 типа атигенных детерминант: видовые, изотипические, аллотипические и идиотипические. Видовыеантигенные детерминанты характерны для Ig всех особей данного вида (например, кролика, собаки, человека). Они определяются строением легкой и тяжелой цепей. По этим детерминантам можно идентифицировать видовую принадлежность антител. Изотипическиеантигенные детерминанты являются групповыми. Они локализуются в тяжелой цепи и служат для дифференцировки Ig на 5 изотипов (классов) и множество подклассов . Аллотипическиеантигенные детерминанты являются индивидуальными, т.е. присущими конкретному организму. Они располагаются в легкой и тяжелой полипептидных цепях. На основании строения аллотипических детерминант можно различать особи внутри одного вида. Идиотипическиеантигенные детерминанты отражают особенности строения антигенсвязывающего центра самой молекулы Ig. Они образованы V-доменами легкой и тяжелой цепей молекулы Ig. Обнаружение идиотипических антигенных детерминант послужило основанием для создания теории идиотип-антиидиотипической регуляции биосинтеза антител. Полные и неполные антитела.Такое подразделение основано на способности образовывать в реакции агглютинации или преципитации (in vitro)хорошо различимый глазом результат. Таким свойством обладают полные антитела.К ним относятся IgМ, а также некоторые IgA и G. Неполные антителалишены такой способности, несмотря на то, что они специфически связываются с антигеном - их еще называют неагглютинирующими, непреципитирующими или блокирующими антителами. 33) Моноклональные антитела.Получение( гибридомная технология) и применение. Каждый В-лимфоцит и его потомки, образовавшиеся в результате клеточного деления (т.е. клон), способны синтезировать антитела с паратопом строго определенной специфичности. Такие антитела получили название моноклональных.В естественных условиях макроорганизма получить моноклональные антитела практически невозможно, так как на одну и ту же антигенную детерминанту одновременно реагируют до 100 различных клонов В-лимфоцитов, незначительно различающихся антигенной специфичностью. Поэтому в результате иммунизации даже монодетерминантным антигеном мы всегда получаем поликлональныеантитела. Принципиально получение моноклональных антител выполнимо, если провести предварительную селекцию антителопродуцирующих клеток и их клонирование, т.е. получение необходимых клонов. Однако задача осложняется тем, что число генераций В-лимфоцитов, как и других эукариотических клеток, ограничено. Тем не менее проблема была успешно решена Д. Келлером и Ц. Мильштайном (1975). Исследователи получили гибриды иммунных В-лимфоцитов и миеломных (опухолевых) клеток, которые обладали свойствами антителопродуцента и «бессмертием» раково-трансформированной клетки. Такой вид клеток получил название гибридом.В ходе дальнейшей селекции были отобраны клоны с наивысшей продуктивностью и аффинностью специфических антител. Гибридомные моноклональные антитела нашли широкое применение при создании диагностических и лечебных иммунобиологических препаратов. 34) Генетика антителообразования. Для структуры молекул Ig характерно уникальное генетическое кодирование. Методами молекулярной генетики было доказано, что структура молекулы Ig контролируется большим числом генов, которые имеют фрагментарную организацию, образуют три группы, располагаются в трех различных хромосомах и наследуются независимо. Первая группа генов кодирует первичную структуру легкой цепи λ-типа, вторая - легкой цепи κ-типа, а третья - всех типов тяжелых цепей (α, δ, ε, γ и μ). Гены, относящиеся к каждой группе, находятся на соответствующей хромосоме в непосредственной близости друг от друга, располагаются последовательно и разделены интронами. Участок ДНК, кодирующий строение легкой цепи λ-типа, содержит 2 V-сегмента(контролируют структуру V-доменов) и 4 C-сегмента(контролируют структуру C-доменов). Между C- и V-сегментами располагается J-сегмент(от англ. join- соединяющий). Легкая цепь κ-типа кодируется несколькими сотнями V-сегментов ДНК, 4 J-сегментами и одним C-сегментом. Группа генов, контролирующая структуру тяжелых цепей, имеет еще более сложное строение. Наряду с V-, C- и J- сегментами ДНК в их состав входят 20 D-сегментов (от англ. divercity - разнообразие). Кроме того, имеется M-сегмент, который кодирует биосинтез мембраноассоциированного участка молекулы рецепторного Ig. Созревание пре-В-лимфоцитов сопровождается перестройками в их генетическом аппарате. Происходят произвольное сближение отдельных фрагментов ДНК и сборка в пределах соответствующих хромосом единых функциональных генов. Этот процесс называется сплайсинг (от англ. splicing - сращивание, состыковывание). Пропущенные участки ДНК исключаются из дальнейшего считывания. С функциональных генов в дальнейшем транскрибируется про-мРНК, а затем окончательная мРНК, кодирующая первичную аминокислотную последовательность L- и H-цепей молекулы Ig. Параллельно со сплайсингом в отдельных участках V-сегментов генов иммуноглобулинов могут происходить точечные мутации и нематричная достройка олигонуклеотидов. Эти участки ДНК получили название гипермутабельных областей.
Сплайсинг и мутационный процесс в генах Ig носят случайный характер. Они происходят в каждом лимфоците независимо друг от друга и уникальны, что в бесконечное количество раз повышает разнообразие V-доменов и в конечном счете структуры паратопов и идиотипических антигенных детерминант молекулы Ig. Поэтому в организме всегда существуют или в любой момент могут появиться В-лимфоциты, специфичные практически к любому антигену. Этот тезис составляет основу молекулярно-генетической теории происхождения многообразия специфичностей антител, разработанной С. Тонегавой (1983). В процессе первичного иммунного ответа размножение В-лимфоцитов также сопровождается рекомбинационными перестройками в пределах иммуноглобулиновых генов, но уже в пределах С-сегментов. Это проявляется последовательной сменой класса Ig: на ранних этапах дифференцировки В-лимфоциты синтезируют Ig классов М и D, на более поздних - классов G, A или E (редко). 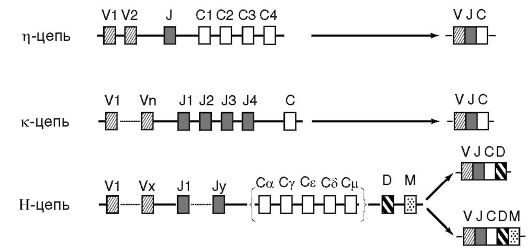 35) Иммунологическая память. Первичный и вторичный ответ. При повторной встрече с антигеном организм в норме формирует вторичный иммунный ответ - более активную и быструю иммунную реакцию. Этот феномен получил название иммунологической памяти. Иммунологическая память имеет высокую специфичность для конкретного антигена, распространяется как на гуморальное, так и клеточное звено иммунитета, обусловлена В- и Т-лимфоцитами и длительно сохраняется годами. Иммунологическая память - надежная гарантия защиты организма от повторных антигенных интервенций.
Существует два механизма формирования иммунологической памяти. Один из них предполагает длительное сохранение антигена в организме, что поддерживает в напряжении иммунную систему. Этому имеется множество примеров: инкапсулированный возбудитель туберкулеза, персистирующие вирусы кори, полиомиелита, ветряной оспы и некоторые другие патогены. Вероятно также наличие долгоживущих дендритных АПК, способных длительно сохранять и презентировать антиген. Другой механизм предусматривает образование специальных клеток иммунологической памяти в процессе развития в организме продуктивного иммунного ответа. Эти клетки отличаются высокой специфичностью к конкретной антигенной детерминанте и большой продолжительностью жизни (до 10 лет). Они активно рециркулируют в организме, распределяясь в тканях и органах, что обеспечивает постоянную готовность иммунной системы реагировать на повторный контакт с антигеном по вторичному типу. Феномен иммунологической памяти широко используется в практике вакцинации людей для создания напряженного иммунитета и поддержания его дительное время на защитном уровне. Осуществляют это 2-3-кратными прививками при первичной вак- цинации и периодическими повторными введениями вакцинного препарата - ревакцинациями . Однако феномен иммунологической памяти имеет и отрицательные стороны. Например, повторная попытка трансплантировать уже однажды отторгнутую ткань вызывает быструю и бурную реакцию - криз отторжения. Динамика антителообразования существенно зависит от первичности или вторичности контакта с антигеном. При первичном контакте с антигеном развивается первичный иммунный ответ. Для него характерны длительные латентная и логарифмическая (7-15 сут) фазы. Первые диагностически значимые титры специфических антител регистрируются на 10-14-е сутки от момента иммунизации. Стационарная фаза продолжается 15-30 сут, а фаза снижения - 1-6 мес. В течение первичного иммунного ответа происходят созревание, размножение клонов и дифференцировка антигенспецифических В-лимфоцитов, а также переключение биосинтеза Ig с изотипа M на изотопы G, A или Е. В итоге первичного иммунного реагирования формируются многочисленные клоны антигенспецифических антителопродуцирующих клеток и клеток иммуноло-гической памяти, а во внутренней среде макроорганизма в высоком титре накапливаются специфические IgG и/или IgA. Таким образом обеспечиваются активное противодействие иммунной системы внедрению в макроорганизм антигена и высокая готовность к повторной с ним встрече. Со временем антительный ответ угасает. Элиминация антигена исключает новое стимулирование к клонообразованию, а появившиеся ранее плазматические клетки имеют короткую продолжительность жизни. Вместе с тем В-лимфоциты иммунологической памяти надолго остаются циркулировать в организме.
Повторный контакт иммунной системы с тем же антигеном ведет к формированию вторичного иммунного ответа .Его латентная фаза значительно укорочена, а логарифмическая фаза отличается более интенсивной динамикой прироста и более высокими титрами специфических антител. Для стационарной фазы и фазы снижения свойственна затяжная динамика (несколько месяцев или даже лет). При вторичном иммунном ответе организм сразу же в подавляющем большинстве синтезирует IgG. Это обусловлено подготовленностью иммунной системы к повторной встрече с антигеном за счет формирования иммунологической памяти :многочисленные клоны антигенспецифических В-лимфоцитов, оставшиеся после первичного иммунного реагирования, быстро размножаются и интенсивно включаются в процесс антителогенеза. 36) Мех-мы противоинфекционного (противобактериального и противовирусного) иммунитета Особенности иммунитета при различных состояниях Макроорганизм имеет широкий спектр средств защиты своей целостности и поддержания гомеостаза. Однако для минимизации энергетических и пластических затрат макроорганизм для устранения конкретного антигена использует лишь наиболее эффективные механизмы и факторы защиты. Поэтому при воздействии различных по природе и свойствам антигенов иммунное реагирование макроорганизма имеет свои особенности. Особенности иммунитета при бактериальных инфекциях Иммунная реакция макроорганизма в ответ на бактериальную инфекцию в значительной степени определяется факторами патогенности микроба и в первую очередь его способностью к токсинообразованию. Различают иммунитетантибактериальный - против структурных компонентов бактериальной клетки и антитоксический - против белковых токсинов. Основными факторами антибактериальной защиты являются антитела и фагоциты. Антитела эффективно инактивируют биологически активные молекулы бактериальной клетки (токсины, ферменты агрессии и др.), маркируют их, запускают антителозависимый бактериолиз и иммунный фагоцитоз. Фагоциты непосредственно осуществляют фагоцитоз, в том числе иммунный, антителозависимый бактериолиз и внеклеточный киллинг патогена при помощи ион-радикалов и ферментов. Важная роль в борьбе с грамположительными микробами принадлежит лизоциму, а с грамотрицательными - комплементу (альтернативный путь активации), кроме того, существенное значение имеют белки острой фазы (С-реактивный и маннозосвязывающий протеин).
Ряд бактерий, относящихся к факультативным внутриклеточным паразитам, отличается повышенной устойчивостью к действию комплемента, лизоцима и фагоцитов (незавершенный фагоцитоз). К их числу относятся микобактерии, йерсинии, бруцеллы, сальмонеллы и некоторые другие. В такой ситуации макроорганизм вынужден переключать нагрузку на клеточное звено иммунитета, что ведет к аллергизации организма по механизму ГЗТ. Особое значение приобретают активированные макрофаги и естественные киллеры, осуществляющие АЗКЦТ, а также γδТ-лимфоциты. Напряженность специфического антибактериального иммунитета оценивают в серологических тестах по титру или динамике титра специфических антител, а также по состоянию клеточной иммунореактивности (например, по результатам кожно-аллергической пробы). Особенности противовирусного иммунитета Особенности иммунной защиты макроорганизма при вирусных инфекциях обусловлены двумя формами существования вируса: внеклеточной и внутриклеточной. Основными факторами, обеспечивающими противовирусный иммунитет, являются специфические антитела, Т-киллеры, естественные киллеры, интерферон и сывороточные ингибиторы вирусных частиц. Специфические противовирусные антитела способны взаимодействовать только с внеклеточным вирусом, так как у них нет доступа внутрь живой клетки. Антитела нейтрализуют вирусные адгезины и нейраминидазы, препятствуя адсорбции вирусов на клетках-мишенях и их инфицированию. Они также связывают вирусные белки и нуклеиновые кислоты, образовавшиеся после разрушения зараженных вирусами клеток. Сформировавшиеся иммунные комплексы элиминируются путем иммунного фагоцитоза. Специфическое связывание антител с вирусными белками, экспрессированными на цитоплазматической мембране инфицированных клеток, индуцирует естественные киллеры к АЗКЦТ.
Клетки, инфицированные вирусом и приступившие к его репликации, экспрессируют вирусные белки на цитоплазматической мембране в составе молекул антигенов гистосовместимости - MHC I класса. Измененная структура MHC I класса этих антигенов гистосовместимости является маркером для Т-киллеров, которые распознают зараженные вирусом клетки и уничтожают их. Мощным противовирусным свойством обладает интерферон. Он не действует непосредственно на внутриклеточный вирус, а связывается с рецептором на мембране клетки и подавляет в ней все биосинтетические процессы. Сывороточные ингибиторы неспецифически связываются с вирусной частицей и нейтрализуют ее, препятствуя тем самым адсорбции вируса на клетках-мишенях. Напряженность противовирусного иммунитета оценивают преимущественно в серологических тестах по нарастанию титра специфических антител в парных сыворотках в процессе болезни. Определяют также концентрацию интерферона в сыворотке крови. |
