ответы материалка. 1. Классификация и строение металлов. Абессонова Общая классификация металлов
 Скачать 1.63 Mb. Скачать 1.63 Mb.
|
|
1.Классификация и строение металлов. Абессонова 1.Общая классификация металлов. Делят на : черные(сплавы железа)/ цветные По физико-химическим свойством: Магнитные (обладают магнитными свойствами) легкие(низкая плотность) Легкоплавкие( T плавления<500) Тугоплавкие (T плавления >1539) Благородные (золото серебро платиновая группа) Редкоземельные(Используются как присадки к различным сплавам) Щелочно-земельные (натрий калий) Урановые По механическим свойствам: Твердость, прочность,упругость, пластичность, вязкость,износостойкость По типу решеток: ОЦК - объемно-центрированная кубическая ГЦК - Гранецентрированная кубическая ГПУ - Гексагональная плотноупакованная 2.Физические и механические свойства металлов. Блеск - способность отражать свет Цвет - свойство света вызывать зрительное ощущение в соответствии со спектральным составом отражаемого/испускаемого излучения Плотность - отношение массы к объембу (легкие и тяжелые металлы) Температура плавления - температура перехода из твердого кристаллического состояния в в жидкое (легкоплавкие / тугоплавкие) Электропроводность - способность металла проводить электричество (Проводники/полупроводники/диэлектрики) Теплопроводность - способность материальных тел проводить тепловую энергию от более нагретых частей тела к менее нагретым частям тела путем хаотического движения частиц тела, величина характеризующая теплопроводящие свойства металла зависит от химической природы среды и ее состояния Магнитные свойства - это характеристика различий реакции вещества и материала на воздействие внешнего магнитного поля, проявляющаяся в результате движения электронов, входящих в состав вещества, и зависящая в первую очередь от ориентации магнитных моментов электронов (а не ядер) в соответствующем структурном объеме вещества 3.Кристаллические и аморфные тела. Их характеристики. Кристаллические тела (кристаллы) - это твердые тела, атомы или молекулы которых занимают упорядоченные положения в пространстве. Частицы кристаллических тел образуют в пространстве правильную кристаллическую пространственную решетку. Каждому химическому веществу, находящемуся в кристаллическом состоянии, соответствует определенная кристаллическая решетка, которая задает физические свойства кристалла. Аморфные тела (от греческого «аморфос» — бесформенный) — это твёрдые тела, которые не имеют кристаллической структуры. К ним относятся: стёкла (искусственные и вулканические), смолы (естественные и искусственные); пластмассы, пластилин; шоколад, парафин, клей, сургуч, эбонит и т.д. Аморфные тела обладают текучестью и не имеют определённой температуры плавления. 4.Элементарная кристаллическая решетка(ЭКЯ) Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки. ОЦК - объемно-центрированная кубическая 9 атомов, 8 по углам ячейки, 1 в центре ГЦК - Гранецентрированная кубическая 14 атомов, 8 по углам, по 1 в центре каждой грани ГПУ - Гексагональная плотноупакованная 17 атомов, 12 по узлам, по 1 в середине оснований, 3 в средней плоскости призмы Параметры решетки: Период - расстояние между центрами соседних атомов элементарных ячеек (ангстрем) (ОЦК/ГЦК - длина одной стороны, ГПУ - высота призмы и длина одной из сторон основания) Координационное число - число атомов находящихся на равном расстоянии от данного к (ОЦК - 8, ГЦК/ГПУ - 12) Коэффициент компактности/плотность упаковки - отношение объема занятого атомами к объему всей решетки характеризуется координационным числом, чем оно больше, тем больше плотность (ОЦК - 68%, ГЦК/ГПУ - 74%) 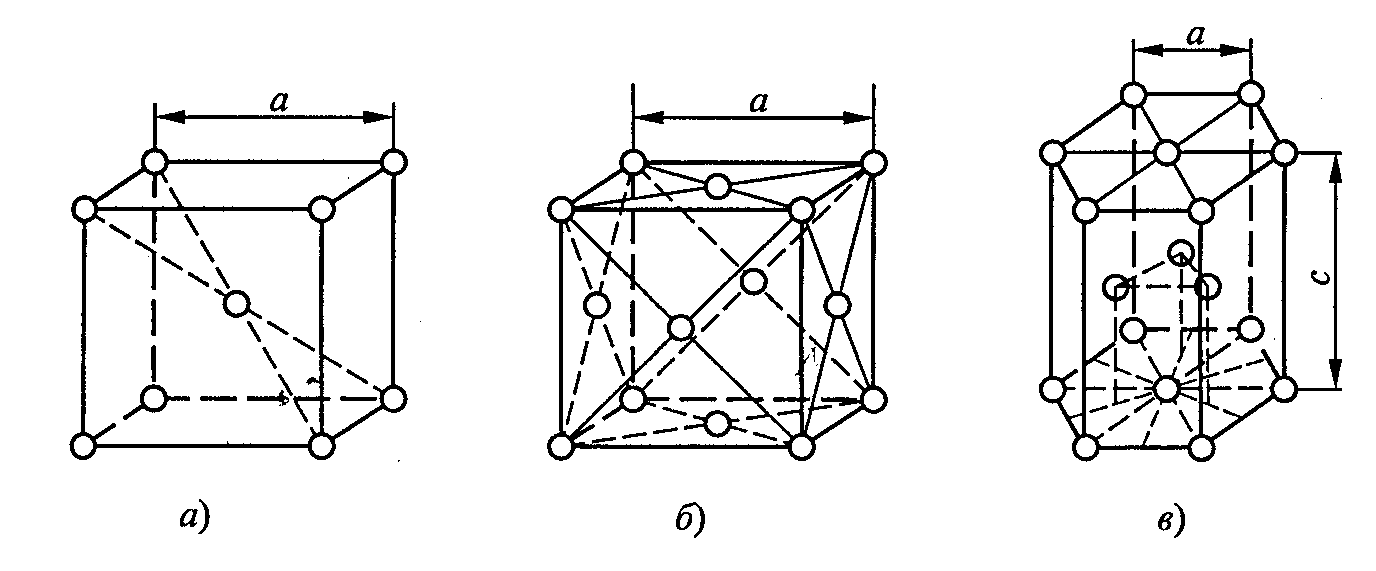 5.Элементы кристаллографии. Понятия кристаллической решетки. Ее плотность. Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки. Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток: атомная (ковалентные связи), молекулярная (ковалентные связи и притяжение между молекулами), металлическая (металлические связи), ионная (ионные связи). Координационное число - число атомов находящихся на равном расстоянии от данного к (ОЦК - 8, ГЦК/ГПУ - 12) Коэффициент компактности/плотность упаковки - отношение объема занятого атомами к объему всей решетки характеризуется координационным числом, чем оно больше, тем больше плотность (ОЦК - 68%, ГЦК/ГПУ - 74%) Бабенкова 6.Дефекты кристаллического строения металлов. Металлы и сплавы состоят из большого количества кристаллов, то есть, имеют поликристаллическое строение. Эти кристаллы называются зернами. Они имеют неправильную форму и различно ориентированы в пространстве. Каждое зерно имеет свою ориентировку кристаллической решетки, отличную от ориентировки соседних зерен, вследствие чего свойства реальных металлов усредняются, и явления анизотропии не наблюдается. В кристаллической решетке реальных металлов имеются различные дефекты (несовершенства), которые нарушают связи между атомами и оказывают влияние на свойства металлов. Различают следующие дефекты кристаллического строения: точечные – малые во всех трех измерениях; линейные – малые в двух измерениях и сколь угодно протяженные в третьем; поверхностные – малые в одном измерении; объемные Точечные дефекты Одним из распространенных несовершенств кристаллического строения является наличие точечных дефектов (рис. 1.2): – вакансия – отсутствие атомов в узлах кристаллической решетки, «дырки». – дислоцированный атом - это атом, вышедший из узла решетки и занявший место в междоузлие. – примесь - атомы примесей, которые всегда присутствуют в металле, так как практически невозможно выплавить химически чистый металл. Основными линейными дефектами являются дислокации. Дислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей 7.Характер разрушения металлов. Под разрушением понимают процесс зарождения и развития в металле трещин, приводящий к разделению его на части. Разрушение происходит в результате или развития нескольких трещин, или слияния рядом расположенных трещин в одну магистральную трещину, по которой происходит полное разрушение. Разрушение может быть хрупким и вязким. Вид разрушения зависит от многих факторов: состава металла, его структурного состояния, условий нагружения и температуры. Вид разрушения вязкий или хрупкий определяют в результате изучения изломов. Хрупкое разрушение характеризуется ручьистым изломом. Вязкое разрушение происходит срезом под действием касательных напряжений и сопровождается значительной пластической деформацией. Для вязкого разрушения характерен волокнистый (матовый) излом детали или образца. Хрупкое разрушение происходит под действием нормальных растягивающих напряжений, вызывающих отрыв одной части тела от другой без заметных следов макропластической деформации. Для хрупкого разрушения характерен кристаллический (блестящий) излом. Хрупкому разрушению предшествует пластическая деформация до достижения трещины критического размера и затем хрупкое бездислокационное разрушение. Хрупкое разрушение – это самопроизвольный процесс. 8.Кристаллизация металлов. Основные понятия. Теоретическая и реальная прочность металла. Переход металла из жидкого состояния в твердое кристаллическое называется кристаллизацией. Кристаллизация начинается с образов так называемых центров кристаллизации и продолжается в процессе роста их числа и размеров кристаллов. Различают два вида кристаллизации: 1)Первичную – т.е образование твердого кристаллического в-ва из расплава 2)Вторичная – образов кристаллов в твердом в-ве – рекристаллизация Теоретическая прочность рассчитывается зная силы межатомного взаимодействия, а реальная определяется экспериментально. Реальная прочность в сотни тыс. раз ниже теоретической. 9.Первичная кристаллизация. Строение стального слитка. Кристаллизация – это переход металла из жидкого состояния в твердое с образованием кристаллического строения. Это первичная кристаллизация (в отличие от вторичной, когда кристаллы металлических фаз выделяются из твердого вещества). Кристаллизация жидкого металла начинается у стенок изложницы, охлаждение весьма интенсивное, приводящее к образованию огромного числа центров кристаллизации. Из-за большой скорости охлаждения образовавшиеся кристаллы не успевают вырасти, поэтому первая зона слитка имеет мелкозернистое строение  Рис. 1.23. Строение слитка (схема): 1 – зона мелкозернистого строения; 2 – зона столбчатых кристаллов; 3 – зона крупных равноосных кристаллов После образования первой зоны условия кристаллизации изменяются. Снижение температуры охлаждаемого металла и повышение температуры стенок изложницы приводят к уменьшению скорости охлаждения. Для этой стадии кристаллизации характерен направленный отвод теплоты перпендикулярно стенкам изложницы. Образующиеся при этом кристаллиты растут в направлении отвода тепла, т.е. перпендикулярно стенкам изложницы, что приводит к образованию второй зоны слитка – зоны столбчатых: кристаллов. Внутренняя часть отливки – третья зона – состоит из крупных равноосных кристаллитов. Причины такого строения – малая скорость охлаждения и отсутствие направленности отвода тепла. Жидкий металл имеет больший объем, чем твердый, поэтому в верхней части слитка, которая застывает в последнюю очередь, образуется усадочная раковина – пустота. Усадочная раковина обычно окружена наиболее загрязненной частью металла. Верхнюю часть слитка отрезают и переплавляют, а остальной металл подвергают обработке давлением. 10.Полиморфизм металлов. Полиморфизм это такое явление, когда материал в одном интервале температур или давлений имеет одну кристаллическую структуру, а в других интервалах – другую. У металлов полиморфизм проявляется преимущественно под воздействием температур. Если нагреть вещество до определенного значения, ионы и атомы в его кристаллической решетке начнут перестраиваться, изменяя свое положение относительно друг друга. В итоге вещество приобретет иные свойства и перейдет в другую модификацию. Температуру и давление, при которых происходит смена кристаллической структуры материала, называют соответственно температурой и давлением полиморфного или аллотропического превращения Бакаева 11.Определение металлического сплава. Фазы. Сплав этот материал, образующийся в результате затвердевания расплавов, состоящих из двух или нескольких компонентов. Компонентами называют химические элементы или их соединения, образующие сплав. Чистый металл представляет собой однокомпонентную систему, сплав двух металлов - двухкомпонентную систему и т. д. Так, для цветных металлических сплавов компонентами могут быть металлы (например, медь с цинком образует латунь), а для железоуглеродистых - металлы с небольшим содержанием неметаллов (железо с углеродом - чугун, сталь). Сплавы могут быть получены сплавлением исходных компонентов, их спеканием, электролизом, возгонкой и другими способами. При этом свойства полученного сплава в значительной мере будут зависеть от его структуры. Фаза – однородная часть системы, отделенная от других частей системы поверхностного раздела, при переходе через которую структура и свойства резко меняются. Совокупность фаз, находящихся в состоянии равновесия, называют системой. Вариантность (C) (число степеней свободы) – это число внутренних и внешних факторов (температура, давление, концентрация), которые можно изменять без изменения количества фаз в системе. · Если вариантность C = 1 (моновариантная система), то возможно изменение одного из факторов в некоторых пределах, без изменения числа фаз; · Если вариантность C = 0 (нонвариантная cистема), то внешние факторы изменять нельзя без изменения числа фаз в системе. Существует математическая связь между числом компонентов (К), числом фаз (Ф) и вариантностью системы (С). Это правило фаз или закон Гиббса: С = К — Ф + 2 Если принять, что все превращения происходят при постоянном давлении, то число переменных уменьшится: С = К — Ф + 1 С – число степеней свободы; К – число компонентов; Ф – число фаз; 1,2 – учитывает возможность изменения температуры. Фазы в металлических сплавах. Сплавы в зависимости от взаимодействия компонентов подразделяются на: · смеси зерен с ограниченной растворимостью, т.е. механические смеси; · растворы с неограниченной растворимостью компонентов, т.е. твердые растворы; · химические соединения компонентов. Твердый раствор – фаза, к которой один из компонентов сплава (растворитель) сохраняет свою кристаллическую решетку, а другой (другие) компонент располагается в решетке растворителя, изменяя ее размеры. Различают следующие виды твердых растворов – твердый раствор замещения и твердый раствор внедрения.  Рисунок 1. Расположение атомов в твердых растворах: а – замещения, б – внедрения (○ – атом компонента растворителя, ● – атом растворенного компонента). При образовании твердого раствора замещения атомы растворенного компонента замещают часть атомов растворителя в его кристаллической решетке (Рис.1 а). При образовании твердого раствора внедрения атомы растворенного компонента размещаются между атомами растворителя (Рис.1 б). При образовании твердого раствора кристаллическая решетка всегда искажается, и периоды ее изменяются. При образовании твердого раствора замещения период решетки может увеличиваться или уменьшаться в зависимости от соотношения атомных радиусов растворителя и растворенного компонента. Твердый раствор состоит из двух или нескольких компонентов, имеет один тип решетки и представляет собой одну фазу. Твердые растворы мягки и пластичны. Благодаря высокой пластичности они хорошо поддаются ковке и другим видам обработки давлением. Литейные свойства и обрабатываемость резанием у твердых растворов низкие. Примерами твердых растворов внедрения, имеющих промышленное значение, являются твердые растворы внедрения углерода в железо. Механическая смесь образуется тогда, когда при кристаллизации компоненты сплава не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Свойства механической смеси определяются количественным соотношением входящих в неё кристаллов компонентов. Сплавы механические смеси имеют хорошие литейные свойства. Сплавы химические соединения образуются между элементами значительно различающимися по строению и свойствам, если сила взаимодействия между однородными атомами больше чем между разнородными. 12.Твердые растворы. Химические соединения. Твёрдые растворы это фазы в которых один из компонентов сплавов сохраняет свою кристаллическую решетку, а атомы другого располагаются в кристаоической решётке первого компонента. Твердые растворы бывают замещения и внедрения. Твёрдый раствор замещения образуются путём замены атомов одного компонента атомами другого. Твёрдый раствор внедрения образуется путём внедрения в междуузельное пространство атомов одного компонента атомами другого Твердые растворы замещения могут быть с ограниченными и неограниченной растворимостью компонентов. Твердые растворы внедрения только с ограниченной, т.е. атомы растворимого элемента должны иметь маленький атомный радиус. Особенности химического соединения Свойства соединения отличаются от свойств компонентов Кристаллическая решётка соединения отличается от решётки компонентов Сохраняется простое кратное массовое соотношение элементов 13.Методика построения диаграмм состояния. В отличие от чистых металлов сплавы кристаллизуются не при постоянной температуре, а в интервале температур. Поэтому на кривых охлаждения сплавов имеется две критические точки. В верхней критической точке, называемой точкой ликвидус, начинается кристаллизация. В нижней критической точке, которая называется точкой солидус, кристаллизация завершается.  Диаграмму состояния строят в координатах температура – концентрация. Линии диаграммы разделяют области разных фазовых состояний. Для построения диаграммы используют большое количество кривых охлаждения для сплавов различных концентраций. Критические точки переносятся с кривых охлаждения на диаграмму и соединяются линией. В получившихся на диаграмме областях записывают фазы и их структурные составляющие. Линия диаграммы состояния, на которой при охлаждении начинается кристаллизация сплава, называется линией ликвидус, а линия, на которой кристаллизация завершается, - линией солидус. |
