ответы. биохимия.. 1 Классификация и строение углеводов. Функции углеводов различных классов
 Скачать 468 Kb. Скачать 468 Kb.
|
К наиболее распространенным вторичным посредникам относятся цАМФ (Аденозинмонофосфат) и другие циклические нуклеотиды, ионы кальция, оксид азота.Концентрация вторичных посредников в цитозоле может быть повышена различными путями:-активацией ферментов, которые их синтезируют, как, например в случае активации циклаз, образующих циклические формы нуклеотидов (цАМФ, цГМФ), -путем открывания ионных каналов, позволяющих потоку ионов металлов, например, ионов кальция войти в клетку. Эти малые молекулы могут далее связывать и активировать эффекторные молекулы — протеинкиназы, ионные каналы и разнообразные другие белки.А. Циклический АМФ Биосинтез. Нуклеотид синтезируется мембранными аденилатциклазами — семейством ферментов, катализирующих реакцию циклизации АТФ (АТР) с образованием цАМФ и неорганического пирофосфата. Расщепление цАМФ с образованием АМФ (AMP) катализируется фосфодиэстеразами, которые ингибируются при высоких концентрациях метилированных производных ксантина, например кофеином. Активность аденилатциклазы контролируется G-белками, которые в свою очередь сопряжены с рецепторами третьего типа, управляемыми внешними сигналами. Большинство G-белков (Gs-белки) активируют аденилатциклазу, некоторые G-белки ее ингибируют (Gi-белки). Некоторые аденилатциклазы активируются комплексом Са2+. Механизм действия. цАМФ является аллостерическим эффектором протеинкиназА (ПК-Α) и ионных каналов. В неактивном состоянии ПК-Α является тетрамером, две каталитические субъединицы (К-субъединицы) которого ингибированы регуляторными субъединицами (Р-субъединицы) (аутоингибирование). При связывании цАМФ Р-субъединицы диссоциируют из комплекса и К-единицы активируются. Фермент может фосфорилировать определенные остатки серина и треонина в более чем 100 различных белках, в том числе во многих ферментах и факторах транскрипции. В результате фосфорилирования изменяется функциональная активность этих белков. Наряду с цАМФ функции вторичного мессенджера может выполнять и цГМФ (гуанозинмонофосфат). Оба соединения различаются по метаболизму и механизму действия. Б. Роль ионов кальция Уровень ионов кальция. Концентрация ионов Са2+ в цитоплазме нестимулированной клетки очень низка. Низкий уровень поддерживается кальциевыми АТФ-азами (кальциевыми насосами) и натрий-кальциевыми обменниками. Резкое повышение концентрации ионов Са2+ в цитоплазме происходит в результате открывания кальциевых каналов плазматической мембраны или внутриклеточных кальциевых депо (гладкого и шероховатого эндоплазматического ретикулума). Открывание каналов может быть вызвано деполяризацией мембран или действием сигнальных веществ, нейромедиаторов (глутамат и АТФ), вторичных мессенджеров (цАМФ), а также вещества растительного происхождения рианодина. В цитоплазме и клеточных органеллах имеется множество белков способных связывать Са2+, некоторые из них выполняют роль буфера. При высокой концентрации в цитоплазме ионы Са2+ оказывает на клетку цитотоксическое действие. Поэтому уровень кальция в отдельной клетке испытывает кратковременные всплески, увеличиваясь в 5-10 раз. Действие кальция опосредовано специальными Са2+-связывающими белками («кальциевыми сенсорами»), к которым принадлежат аннексин, кальмодулин и тропонин. Кальмодулин — сравнительно небольшой белок — присутствует во всех животных клетках. При связывании четырех ионов Са2+ кальмодулин переходит в активную форму, способную взаимодействовать с многочисленными белками. За счет активации кальмодулина ионы Са2+ оказывают влияние на активность ферментов, ионных насосов и компонентов цитоскелета. 42. макроэргические соединения и их роль в метаболизме К макроэргическим соединениям относятся аденозинтрифосфорная кислота (АТФ), аденозиндифосфорная кислота (АДФ), а также пирофосфат (H4P2O7), полифосфаты (полимеры метафосфорной кислоты) и др. Самое важное макроэргическое соединение — АТФ. Используя энергию, заключенную в макроэргических связях АТФ, при действии ферментов, переносящих фосфатные группы, можно получить другие макроэргические соединения, например, ГТФ (гуанозинтрифосфорная кислота), ФЕП (фосфоенолпировиноградная кислота) и др. Образуется АТФ в процессах биологического окисления и при фотосинтезе. Энергия макроэргических связей используется для совершения любой работы: активации соединений (например, глюкозы, чтобы могла начаться цепь ее окислительных превращений), синтеза биополимеров (нуклеиновых кислот, белков, полисахаридов), избирательного поглощения веществ из окружающей клетку среды и выброса из клетки ненужных продуктов, мышечного сокращения и восстановления активного состояния организма и т. д. Запас этих соединений позволяет организму быстро реагировать на изменение внешних условий и совершать физическую работу. При спортивной тренировке содержание макроэргических соединений в мышцах и скорость их образования возрастают. Есть и другие формы запасания энергии. Во-первых, это разность электрических потенциалов на биологических мембранах, которая может быть использована для синтеза макроэргических соединений и на поддержание которой клетке приходится расходовать энергию. Во-вторых, поскольку любой организм способен окислять углеводы и жиры с образованием макроэргических соединений, то можно считать, что жировые капли, зерна крахмала, частицы гликогена — это не только запасы пластического («строительного») материала, но и запасы энергии, только в более инертной и менее доступной для быстрого использования форме, чем макроэргические соединения. 43. Дыхательная цепь в митохондриях Система структурно и функционально связанных трансмембранных белков и переносчиков электронов. Она позволяет запасти энергию, выделяющуюся в ходе окисления NAD*H и ФАДН2 молекулярным кислородом в форме трансмембранного протонного потенциала за счёт последовательного переноса электрона по цепи,сопряжённого с перекачкой протонов через мембрану. Транспортная цепь у эукариот локализована на внутренней мембране митохондрий. В дыхат.цепи 4 мультиферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ. 1ый- КоА-оксидоредуктаза. 1.Принимает электроны от НАДН и передает их на коэнзим Q (убихинон). 2.Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 2ой-ФАД-зависимые дегидрогеназы. 1.Восстановление ФАД 3ий-цитохром с-оксидоредуктаза. 2.Принимает электроны от коэнзима Q и передает их на цитохром с. 3.Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 4ый-цитохром с-кислород оксидоредуктаза. 1.Принимает электроны от цитохрома с и передает их на кислород с образованием воды. 2.Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. Все атомы водорода, отщепленные дегидрогеназами от субстратов в аэробных условиях, достигают внутренней мембраны митохондрий в составе НАДН или ФАДН2. 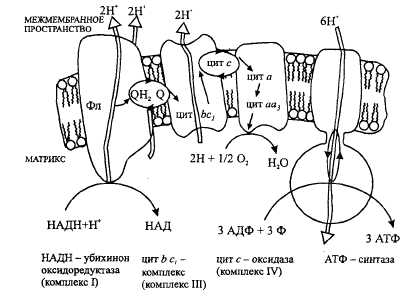 Электроны по мере передвижения теряют энергию->энергия тратиться комплексами на перекачку протонов Н.Перенос ионов Н происходит в строго определённых участках->участках сопряжения.Результат: происходит наработка АТФ: ионы H+ теряют свою энергию, проходя через АТФ-синтазу.Часть этой энергии тратится на синтез АТФ. Другая часть рассеивается в виде тепла. Дыхательная цепь митохондрий состоит из 5 мультифер-ментных комплексов, субъединицы которых кодируются как ядерными, так и митохондриальными генами. В переноске электронов участвуют коэнзим Q10 и цитохром с. Электроны поступают от молекул NAD*H и FAD'H и переносятся по дыхательной цепи. Высвобождаемая энергия используется для транспорта протонов к внешней мембране митохондрий, а возникающий электрохимический градиент — для синтеза АТФ с помощью комплекса V дыхательной цепи митохондрий 44. Последовательность и строение переносчиков электронов в дыхательной цепи 1 комплекс. НАДН-КоQ-оксидоредуктаза Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН (флавинмононуклеотид), 22 белковых молекулы, из них 5 железосерных белков с общей молекулярной массой до 900 кДа. - Принимает электроны от НАДН и передает их на коэнзим Q (убихинон). - Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 2 комплекс. ФАД-зависимые дегидрогеназы Он включает в себя ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса НАДН в митохондрию). - Восстановление ФАД в окислительно-восстановительных реакциях. - Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q. 45. Процесс окислительного фосфорилирования его биологическая роль Окислительное фосфорилирование — один из важнейших компонентов клеточного дыхания, приводящего к получению энергии в виде АТФ Субстратами окислительного фосфорилирования служат продукты расщепления органических соединений — белки жиры и углеводы. Процесс окислительного фосфорилирования проходит на кристах митохондрий. Однако чаще всего в качестве субстрата используются углеводы Так, клетки головного мозга не способны использовать для питания никакой другой субстрат, кроме углеводов. Предварительно сложные углеводы расщепляются до простых, вплоть до образования глюкозы. Глюкоза является универсальным субстратом в процессе клеточного дыхания. Окисление глюкозы подразделяется на 3 этапа: -гликолиза -окислительное декарбоксилирование и цикл Кребса -окислительное фосфорилирование. При этом гликолиз является общей фазой для аэробного и анаэробного дыхания. Для синтеза 1 молекулы АТФ необходимо 3 протона У животных, растений и грибов окислительное фосфорилирование протекает в специализированных субклеточных структурах-митохондриях 46. Биохимические механизмы разобщения окисления и фосфорилирования факторы их вызывающие Разобщение дыхания и фосфорилирования Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH2возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители - липофильные вещества, легко проходящие через липидный слой мембраны. Одно из таких веществ - 2,4-динитрофенол (рис. 6-17), легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс. Примерами разобщителей могут быть также некоторые лекарства, например дикумарол - антикоагулянт (см. раздел 14) или метаболиты, которые образуются в организме, билирубин - продукт катаболизма тема (см. раздел 13), тироксин - гормон щитовидной железы (см. раздел 11). Все эти вещества проявляют разобщающее действие только при их высокой концентрации. Выключение фосфорилирования по исчерпании АДФ либо неорганического фосфата сопровождается торможением дыхания (эффект дыхательного контроля). Большое число повреждающих митохондриальную мембрану воздействий нарушает сопряжение между окислением и фосфорилированием, разрешая идти переносу электронов и в отсутствие синтеза АТФ (эффект разобщения) 1. Суммарный выход: Для синтеза 1 молекулы АТФ необходимо 3 протона. 2. Ингибиторы окислительного фосфорилирования: Ингибиторы блокируют V комплекс: Олигомицин — блокируют протонные каналы АТФ-синтазы. Атрактилозид, циклофиллин — блокируют транслоказы. 3. Разобщители окислительного фосфорилирования: Разобщители — липофильные вещества, которые способны принимать протоны и переносить их через внутреннюю мембрану митохондрий минуя V комплекс(его протонный канал). Разобщители: Естественные — продукты перекисного окисления липидов, жирных кислот с длинной цепью; большие дозы тиреоидных гормонов. Искусственные — динитрофенол, эфир, производные витамина К, анестетики. 47. Механизмы образования свободных радикалов. Антиоксидантные системы в клетках Свободные радикалы в химии — частицы (как правило, неустойчивые), содержащие один или несколько неспаренных электронов на внешней электронной оболочке. По другому определению свободный радикал — вид молекулы или атома, способный к независимому существованию (то есть обладающий относительной стабильностью) и имеющий один или два неспаренных электрона. Неспаренный электрон занимает атомную или молекулярную орбиталь в одиночку. Как правило, радикалы обладают парамагнитными свойствами, так как наличие неспаренных электронов вызывает взаимодействие с магнитным полем. Кроме этого наличие неспаренного электрона способно значительно усилить реакционную способность, хотя это свойство радикалов широко варьируется. Образование Радикал может образоваться в результате потери одного электрона нерадикальной молекулой: или при получении одного электрона нерадикальной молекулой: Большинство радикалов образуются в ходе химических реакций при гомолитической диссоциации связей. Они сразу же претерпевают дальнейшие превращения в более устойчивые частицы: Зарождение радикальной цепи можно инициировать действием на вещество жестких условий (высокие температуры, электромагнитное излучение, радиация). Многие перекисные соединения — также хорошие радикалообразующие частицы. Антиоксиданты (антиокислители, консерванты) — ингибиторы окисления, природные или синтетические вещества, способные замедлять окисление (рассматриваются преимущественно в контексте окисления органических соединений). Основной внутренний источник опасности для клеточного гомеостаза анаэробных огранизмов - это интермидиаты, участвующие в передаче кислорода, и продукты, образованные в результате метаболизма кислорода. Анаэробные организмы в процессе эволюции выработали хорошо отрегулированные механизмы для нейтрализации окислительных эффектов кислорода и его активных метаболитов. Эти самоподдерживающиеся защитные компоненты называют "антиокислительными системами защиты" . |
