1. Медицинская микробиология. Предмет, задачи, методы, связь с другими науками. Значение медицинской микробиологии в практической деятельности врача
 Скачать 0.96 Mb. Скачать 0.96 Mb.
|
|
Различают три разновидности метода: прямой, непрямой, с комплементом. Прямой метод РИФ основан на том, что антигены тканей или микробы, обработанные иммунными сыворотками с антителами, меченными флюорохромами, способны светиться в УФ-лучах люминесцентного микроскопа. Бактерии в мазке, обработанные такой люминесцирующей сывороткой, светятся по периферии клетки в виде каймы зеленого цвета. Непрямой метод РИФ заключается в выявлении комплекса антиген - антитело с помощью антиглобулиновой (против антитела) сыворотки, меченной флюорохромом. Для этого мазки из взвеси микробов обрабатывают антителами антимикробной кроличьей диагностической сыворотки. Затем антитела, не связавшиеся антигенами микробов, отмывают, а оставшиеся на микробах антитела выявляют, обрабатывая мазок антиглобулиновой (антикроличьей) сывороткой, меченной флюорохромами. В результате образуется комплекс микроб + антимикробные кроличьи антитела + антикроличьи антитела, меченные флюорохромом. Этот комплекс наблюдают в люминесцентном микроскопе, как и при прямом методе. Механизм. На предметном стекле готовят мазок из исследуемого ма териала, фиксируют на пламени и обрабатывают иммунной кроличьей сывороткой, содержащей антитела против антигенов возбудителя. Для образования комплекса антиген — антитело препарат помещают во влажную камеру и инкубируют при 37 °С в течение 15 мин, после чего тщательно промывают изото ническим раствором хлорида натрия для удаления не связавших ся с антигеном антител. Затем на препарат наносят флюоресци рующую антиглобулиновую сыворотку против глобулинов кро лика, выдерживают в течение 15 мин при 37 °С, а затем препарат тщательно промывают изотоническим раствором хлорида натрия. В результате связывания флюоресцирующей антиглобулиновой сыворотки с фиксированными на антигене специфическими анти телами образуются светящиеся комплексы антиген — антитело, которые обнаруживаются при люминесцентной микроскопии. 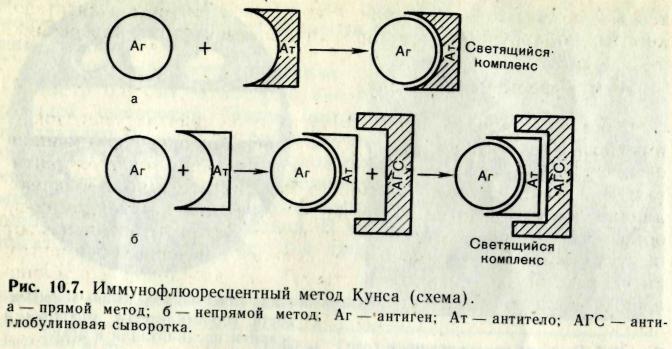 56. Иммуноферментный анализ. Иммуноблотинг. Механизмы. Компоненты. Применение. Иммуноферментный анализ или метод — выявление ан тигенов с помощью соответствующих им антител, конъюгированных с ферментом-меткой (пероксидазой хрена, бета-галактозидазой или щелочной фосфатазой). После соединения антигена с меченной ферментом иммунной сывороткой в смесь добавляют субстрат/хромоген. Субстрат расщепляется ферментом и изменяется цвет продукта реакции — интен сивность окраски прямо пропорциональна количеству свя завшихся молекул антигена и антител. ИФА применяют для диагностики вирусных, бактериальных и паразитарных бо лезней, в частности для диагностики ВИЧ-инфекций, гепати та В и др., а также определения гормонов, ферментов, лекар ственных препаратов и других биологически активных ве ществ, содержащихся в исследуемом материале в минорных концентрациях (1010-1012 г/л). Твердофазный ИФА— вариант теста, когда один из компо нентов иммунной реакции (антиген или антитело) сорбирован на твердом носителе, напр., в лунках планшеток из полистирола. Компоненты выявляют добавлением меченых антител или анти генов. При положительном результате изменяется цвет хромоге на. Каждый раз после добавления очередного компонента из лунок удаляют несвязавшиеся реагенты путем промывания, I. При определении антител (левый рисунок) в лунки планшеток с сорбированным антигеном последовательно добавляют сы воротку крови больного, антиглобулиновую сыворотку, ме ченную ферментом, и субстрат/хромоген для фермента. II. При определении антигена (правый рисунок) в лунки с сорби рованными антителами вносят антиген (напр., сыворотку кро ви с искомым антигеном), добавляют диагностическую сыво ротку против него и вторичные антитела (против диагностиче ской сыворотки), меченные ферментом, а затем субстрат/хро моген для фермента. Конкурентный ИФАдля определения антигенов: искомый антиген и меченный ферментом антиген конкурируют друг с другом за связывание ограниченного количества антител иммунной сыворотки. Другой тест - Конкурентный ИФА для определения антител: искомые анти тела и меченные ферментом антитела конкурируют друг с дру гом за антигены, сорбированные на твердой фазе. Иммуноблоттинг — высокочувстви тельный метод выявления белков, основанный на сочетании электрофореза и ИФА или РИА. Иммуноблоттинг ис пользуют как диагностический метод при ВИЧ-инфекции и др. Антигены возбудителя разделяют с помощью электрофоре за в полиакриламидном геле, затем переносят их из геля на активированную бумагуили нитроцеллюлозную мембрану и проявляют с помощью ИФА. Фирмы выпускают такие полоски с «блотами» антиге нов. На эти полоски наносят сыворотку больного. Затем, после инкубации, отмывают от несвязавшихся антител боль ного и наносят сыворотку против иммуноглобулинов челове ка, меченную ферментом. Образовавшийся на полоске комплекс [антиген + антитело больного + антитело против Ig человека] выявляют добавлением хромогенного субстрата, изменяющего окраску под действием фермента. 57. Вакцины. Определение. Современная классификация вакцин. Требования, предъявляемые к вакцинным препаратам. Вакцина — медицинский препарат, предназначенный для создания иммунитета к инфекционным болезням. Классификации вакцин: 1.Живые вакцины - препараты, действующим началом в которых являются ослабленные тем или иным способом, потерявшие свою вирулентность, но сохранившие специфическую антигенность штаммы патогенных бактерий. Примером таких вакцин являются БЦЖ и вакцина против натуральной оспы человека, в качестве которой используется непатогенный для человека вирус оспы коров. 2.Инактивированные (убитые) вакцины – препараты, в качестве действующего начала включающие убитые химическим или физическим способом культуры патогенных вирусов или бактерий, (клеточные, вирионные) или же извлечённые из патогенных микробов комплексы антигенов, содержащие в своём составе проективные антигены (субклеточные, субвирионные вакцины). В препараты иногда добавляют консерванты и адьюванты. Молекулярные вакцины – в них антиген находится в молекулярной форме или даже в виде фрагментов его молекул, определяющих специфичность т. е. в виде эпитопов, детерминант. Корпускулярные вакцины – содержащие в своем составе протективный антиген 3.Анатоксины относятся к числу наиболее эффективных препаратов. Принцип получения – токсин соответствующей бактерии в молекулярном виде превращают в нетоксичную, но сохранившую свою антигенную специфичность форму путем воздействия 0.4% формальдегида при 37t в течение 3-4 недель, далее анатоксин концентрируют, очищают, добавляют адьюванты. 4.Синтетические вакцины. Молекулы эпитопов сами по себе не обладают высокой иммуногенностью для повышения их антигенных свойств эти молекулы сшиваются с полимерным крупномолекулярным безвредным веществом, иногда добавляют адьюванты. 5.Ассоциированные вакцины – препараты, включающие несколько разнородных антигенов. Требования, предъявляемые к современным вакцинам: Иммуногенность; Низкая реактогенность (аллергенность); Не должны обладать тератогенностью, онкогенностью; 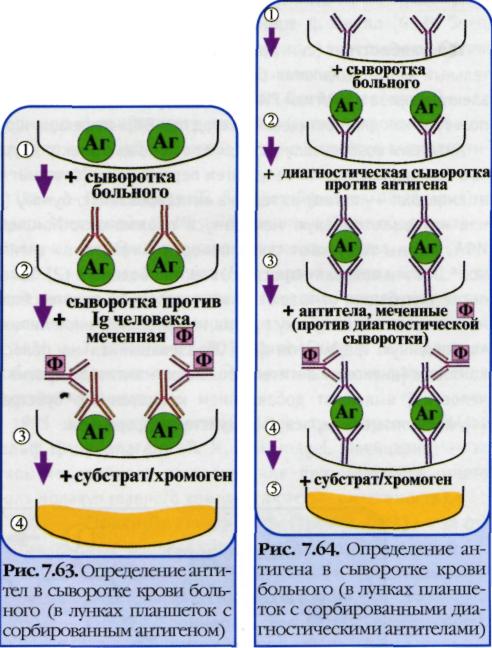 Штаммы, из которых приготовлена вакцина, должны быть генетически стабильны; Длительный срок хранения; Технологичность производства; Простота и доступность в применении. 58. Вакцинопрофилактика. Вакцины из живых бактерий и вирусов. Принципы получения вакцинных штаммов. Способы аттенуации. Примеры вакцин из живых бактерий и вирусов. Преимущества и недостатки аттенуированных вакцин. Первое поколение вакцин – цельномикробные, цельновирионные
Очень опасные и заразные:
Против вирусов:
Вакцины против
Преимущества живых вакцин:
Недостатки:
!!!Живые вакцины не ставят людям с иммунодефицитами!!! Между введениями живых вакцин рекомендован интервал не менее 1 месяца, в противном случае возможны тяжелые побочные реакции, иммунный ответ может быть пониженным. 59. Вакцинопрофилактика. Вакцины из убитых бактерий и вирусов. Принципы приготовления. Примеры убитых вакцин. Ассоциированные вакцины. Преимущества и недостатки убитых вакцин.
Преимущества:
Недостатки:
Ассоциированные вакцины. Это комбинированные вакцины, в результате действия которых иммунтет формируется одновременно к нескольким инфекциям. АКДС (ассоциированная коклюшно-дифтерийная столбнячная) – из убитых коклюшных бактерий и инактивированных экзотоксинов дифтерии и столбняка. Тривакцина – из аттенуированных (ослабленных) вирусов кори, краснухи и праротита. Тетракокк – из анатоксинов дифтерии и столбняка и убитых коклюшных бактерий и инактивированных вирусов полиомиелита. 60. Молекулярные вакцины: анатоксины. Получение. Использование анатоксинов для профилактики инфекционных заболеваний. Примеры вакцин. Молекулярные вакцины – в них антиген находится в молекулярной форме или даже в виде фрагментов его молекул, определяющих специфичность т. е. в виде эпитопов, детерминант. В процессе культивирования природных патогенных микробов можно получить протективный антиген, синтезируемый этими бактериями токсин затем превращается в анатоксин, сохраняющий специфическую антигенность и иммуногенность. Анатоксины являются одним из видов молекулярных вакцин. Анатоксины – препараты, полученные из бактериальных экзотоксинов, полностью лишенные своих токсических свойств, но сохранившие антигенные и иммуногенные свойства. Получение: токсигенные бактерии выращивают на жидких средах, фильтруют с помощью бактериальных фильтров для удаления микробных тел, к фильтрату добавляют 0,4% формалина и выдерживают в термостате при 30-40t на 4 недели до полного исчезновения токсических свойств, проверяют на стерильность, токсигенность и иммуногенность. Эти препараты называются нативными анатоксинам, в настоящее время почти не используются, т. к. содержат большое количество балластных веществ, неблагоприятно влияющих на организм. Анатоксины подвергаю физической и химической очистке, адсорбируют на адъювантах. Такие препараты называются адсорбированными высокоочищенными концентрированными анатоксинами. Титрование анатоксинов в реакции фолликуляции производят по стандартной фолликулирующей атитоксической сыворотке, в которой известно количество антитоксических единиц. 1 антигенная единица анатоксина обозначается Lf, это то количество анатоксина, которое вступает в реакцию фолликуляции с 1 единицей дифтерийного анатоксина. Анатоксины применяются для профилактики и реже, для лечения токсинемических инфекций дифтерия, газовая гангрена, ботулизм, столбняк). Так же анатоксины применяются для получения антитоксических сывороток путем гипериммунизации животных. Примеры препаратов: АКДС, АДС, адсорбированный стафилококковый анатоксин, ботулинистический анатоксин, анатоксины из экзотоксинов возбудителей газовых инфекций. 61. Генно-инженерные вакцины. Получение. Применение. Преимущества и недостатки. Генно-инженерные вакцины – это препараты, полученные с помощью биотехнологии, которая по сути сводиться к генетической рекомбинации . Для начала получают ген, который должен быть встроен в геном реципиента. Небольшие гены могут быть получены методом химического синтеза. Для этого расшифровывается число и последовательность аминокислот в белковой молекуле вещества, затем по этим данным узнают очерёдность нуклеотидов в гене, далее следует синтез гена химическим путем. Крупные структуры, которые довольно сложно синтезировать получаются путем выделения(клонирования), прицельного выщепления этих генетических образований с помощью рестриктаз. Полученный одним из способов целевой ген с помощью ферментов сшивается с другим геном, который используется в качестве вектора для встраивания гибридного гена в клетку. Вектором могут служить плазмиды, бактериофаги, вирусы человека и животных. Экспрессируемый ген встраивается в бактериальную или животную клетку, которая начинает синтезировать несвойственное ей ранее вещество, кодируемое эксперссируемым геном. В качестве реципиентов экспрессируемого гена чаще всего используется E. coli, B. subtilis, псевдомонады, дрожжи, вирусы. некоторые штаммы способны переключаться на синтез чужеродного вещества до 50% своих синтетических возможностей – эти штамм называются суперпродуцентами. Иногда к генно-инженерным вакцинам добавляется адъювант. Примерами таких вакцин служат вакцина против гепатита В (энджерикс), сифилиса, холеры, бруцеллёза, гриппа, бешенства. Есть определённые сложности в разработке и применении: - длительное время к генно-инженерным препаратам относились настороженно. - на разработку технологии для получения вакцины затрачиваются значительные средства - при получении препаратов данным способом возникает вопрос об идентичности полученного материала природному веществу. Третье поколение вакцин – генно-иненерные вакцины
Вакцины от Гепатита В:
Преимущества:
Недостатки: Менее эффективны по сравнению с традиционными, так как вирусы вариабельны.
ИРС-19; Бронхомунал; Рибомунил. 62. Вакцинотерапия. Понятие о лечебных вакцинах. Получение. Применение. Механизм действия. |
