бх итоговая. БХ_итоговая_ласт. 1. Нервная и гуморальная регуляция как единая система регуляции обмена веществ. Гормоны первичные посредники в передаче информации
 Скачать 1.44 Mb. Скачать 1.44 Mb.
|
27. Энзимодиагностика: механизмы изменения уровня активности ферментов в крови; Энзимодиагностика при инфаркте миокарда и заболеваниях печени.Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях: - при повреждении клеток в крови или других биологических жидкостях увеличивается концентрация внутриклеточных ферментов повреждённых клеток; - количество высвобождаемого фермента достаточно для его обнаружения; - активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени и отличается от нормальных значений; - ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность); - существуют различия во внутриклеточной локализации ряда ферментов. Причины, приводящие к увеличению количества ферментов в крови Ферменты плазмы крови можно разделить на 2 группы. Первая, относительно небольшая группа ферментов активно секретируется в плазму крови определёнными органами. Например, печень синтезирует неактивные предшественники ферментов свёртывающей системы крови. Ко второй относят большую группу ферментов, высвобождающихся из клеток во время их нормального функционирования. Обычно эти ферменты выполняют свою функцию внутри клетки и не имеют физиологического значения в плазме крови. У здорового человека активность этих ферментов в плазме низкая и достаточно постоянная, т.к. постоянно соотношение скоростей высвобождения их из клеток и скоростей разрушения. При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе). Определение в крови активности ряда ферментов хорошо налажено в биохимических лабораториях, что используют для диагностики заболеваний сердца, печени, скелетной мускулатуры и других тканей. Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток. Для энзимодиагностики имеют большое значение знание субклеточной локализации ферментов. Так, появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например, о некрозе. Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках или при нарушенном клиренсе (способности выводиться почками) наблюдают повышение концентрации в крови определённых ферментов. Следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются от показателей, характерных для взрослых здоровых людей. Энзимодиагностика при инфаркте миокарда Примерно 30% больных инфарктом миокарда имеют атипичную клиническую картину этого заболевания. Поэтому необходимо проводить дополнительные методы исследования для подтверждения повреждения сердечной мышцы. При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы - ACT, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. Типичную кривую изменения активности этих ферментов можно видеть на рисунке. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы MB, однако фермент быстро удаляется из кровотока. Обнаружение повышенной активности КК в плазме крови - основной энзимодиагностический критерий инфаркта миокарда. Если у пациента с загрудинными болями не обнаружено изменения в активности КК, диагноз инфаркта миокарда маловероятен. Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов ACT и ЛДГ в крови больных. Динамика изменений этих активностей также представлена на этом рисунке. Активность ACT в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность ACT повышается через 4-6 ч; максимум активности наблюдают в течение 2-3 дней. Уровень ЛДГ также увеличивается в плазме крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затей наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы. 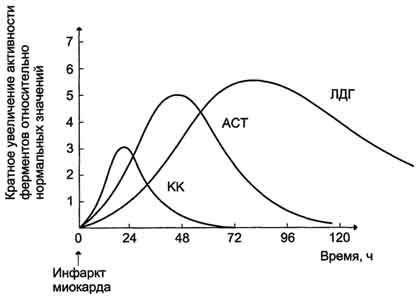 Печень продуцирует большое число ферментов, поступающих непосредственно в кровь. При поражениях печени количество одних ферментов в сыворотке крови понижается, а других – повышается. Ферменты, которые обнаруживаются в норме в плазме или сыворотке крови, условно можно разделить на 3 группы. Секреторные ферменты, синтезируясь в печени, в норме выделяются в плазму крови, где играют определенную физиологическую роль, например ферменты, участвующие в процессе свертывания крови (протромбиназа), холинэстераза. При поражении печени их синтез снижается, и активность этих ферментов падает. Индикаторные ферменты попадают в кровь из тканей, где они выполняют определенные внутриклеточные функции. Одни из них находятся в цитозоле клеток (ЛДГ, АлАТ, АсАТ), другие – в митохондриях (ГДГ, АсАТ) и т.д. При поражении печени ферменты из клеток вымываются в кровь, и активность их возрастает. Наибольшее диагностическое значение имеет определение активности АлАТ и АсАТ. Активность трансаминаз в сыворотке крови: АсАТ – 5 – 40 Е/л, АлАТ – 5 – 43 Е/л. При остром паренхиматозном гепатите АлАТ увеличивается в 20 – 30, а иногда в 100 раз и более. Несколько меньше повышается активность АсАТ. Экскреторные ферменты синтезируются главным образом в печени (щелочная фосфатаза). В физиологических условиях эти ферменты в основном выделяются с желчью. При многих патологических процессах выделение экскреторных ферментов с желчью нарушается, а активность их в плазме крови повышается. Щелочная фосфатаза. Увеличение активности щелочной фосфатазы (ЩФ) при заболеваниях печени является результатом увеличенного синтеза фермента клетками, расположенными в желчных канальцах, обычно в ответ на холестаз, который может быть интра- и внепеченочным. Холестаз, даже непродолжительный, приводит к увеличенной активности фермента, по крайней мере, вдвое превышающий нормальный уровень. Высокая активность ЩФ может также наблюдаться при инфильтративных заболеваниях печени (например, опухолях). Это также характерно для цирроза. Печень не является единственным источником активности ЩФ. Умеренные количества ЩФ представлены в костях, тонком кишечнике, плаценте, почках. Лактатдегидрогеназа. Уровень ЛДГ часто возрастает при гепатоцеллюлярной дисфункции, хотя на практике определение активности этого фермента редко используют в диагностике заболеваний печени из-за низкой специфичности показателя (фермент широко распространен в организме). γ-глутамилтранспептидаза. γ-глутамилтранспептидаза (ГГТП) – это микросомальный фермент, широко представленный в тканях, особенно таких, как печень и почечные канальцы. Активность γ-глутамилтранспептидазы в плазме резко повышается (иногда более, чем в 50 раз) при холестазе и является показателем печеночной недостаточности. Увеличение активности ГГТП наблюдается также у лиц, употребляющих алкоголь, даже в отсутствии явной патологии печени. При остром поражении печени изменение активности ГГТП параллельны изменениям активности трансаминаз. Глутаматдегидрогеназа катализирует превращение глутаминовой кислоты в альфа-кетоглутаровую и аммиак; фермент сосредоточен в митохондриях клеток, преимущественно в гепатоцитах. Он также обнаружен в незначительном количестве в нервной ткани, скелетных мышцах, миокарде и молочной железе. Глутаматдегидрогеназа - один из органоспецифических ферментов, определяется в сыворотке крови при заболеваниях печени. Поскольку фермент является митохондриальным, то степень повышения его активности отражает глубину цитолиза при заболеваниях печени, по её уровню можно судить о тяжести патологического процесса. Сорбитолдегидрогеназа – органоспецифический фермент печени, катализирующий обратимое превращение сорбитола во фруктозу с участием НАД в качестве кофермента. Фермент локализован в цитоплазме гепатоцитов. Сывороточная активность энзима повышается при вирусных гепатитах. Как правило повышение активности СДГ наблюдается в дожелтушный период вирусного гепатита, предшествует увеличению активности других (ферментов, отражающих поражение печени. Однако высокие цифры активности СДГ выявляются в разгар болезни, иными словами, тест уступает по чувствительности другим органоспецифический ферментам и определению активности аминотрансфераз. Кроме того, активность СДГ нормализуется быстрее, чем активность аминотрансфераз, что также является недостатком теста. Другие заболевания печени (токсические гепатиты, циррозы, гипоксические поражения печени) сопровождаются незначительным увеличением активности энзима. |
