механика. 1. Основные понятия кинематики (путь, перемещение, скорость и ускорение материальной точки) Нормальное и тангенциальное ускорение
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
|
15. Цикл Карно и теоремы Карно. Сочетая различные термодинамические процессы, можно получить множество циклов, каждому из которых будет соответствовать определённое значение термического КПД ηt. Возникает естественный вопрос, какой же цикл будет иметь ηt = ηt max. При исследовании проблемы повышения КПД тепловых машин, Сади Карно в 1824 году был предложен идеальный обратимый цикл, носящий в настоящее время его имя. Н 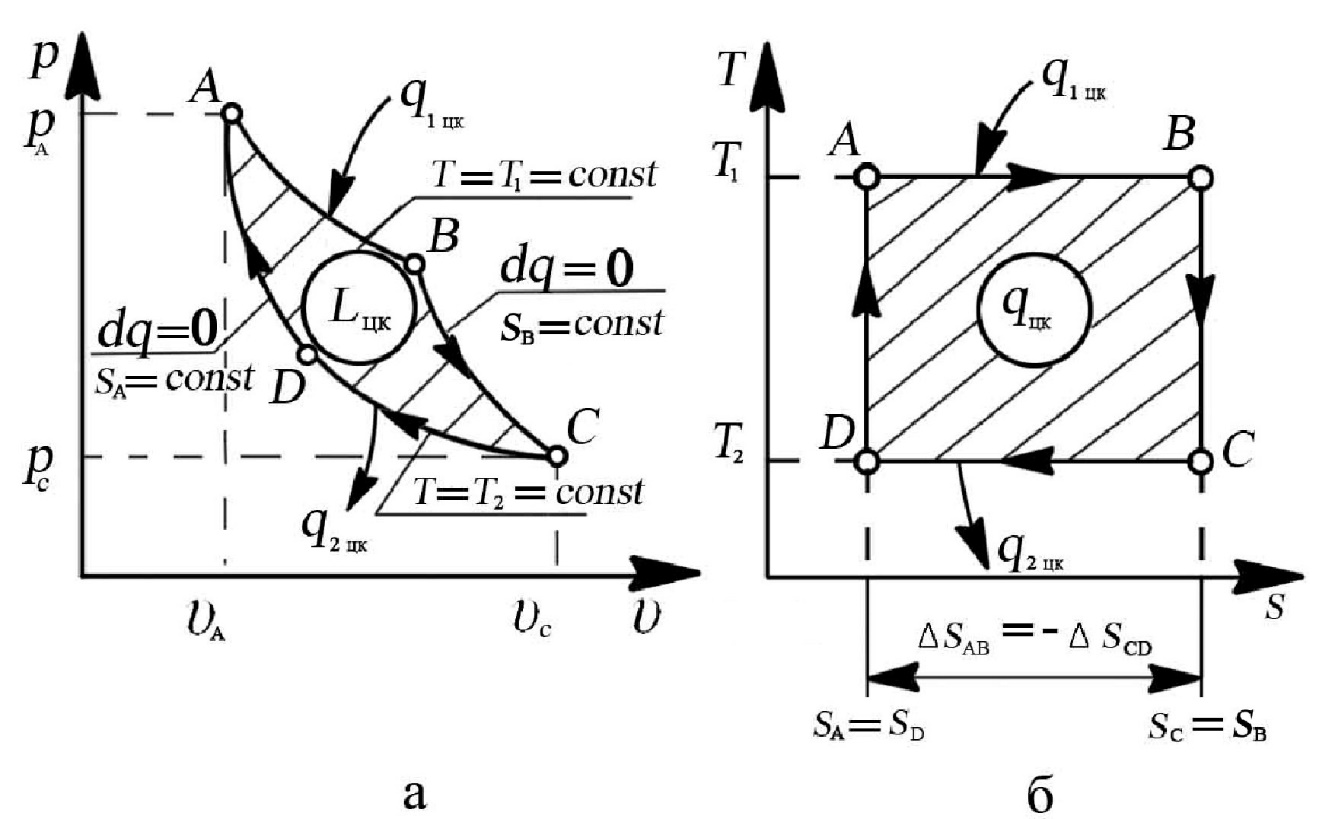 а рис. 4.3. показан идеальный обратимый цикл Карно в рабочей и тепловой диаграммах. а рис. 4.3. показан идеальный обратимый цикл Карно в рабочей и тепловой диаграммах.Рис. 4.3. Цикл Карно: а – изображение цикла Карно в рабочей “p-υ” диаграмме, б – изображение цикла Карно в тепловой “T-s” диаграмме Процессы, составляющие этот цикл, протекают следующим образом. Пусть теплоотдатчик имеет постоянную температуру T1, а теплоприемник – постоянную температуру T2 < T1. Считаем, что их размеры настолько велики, что подвод теплоты q1 цк к рабочему телу и отвод от него теплоты q2 цк на величину T1 и T2 не влияют. Рабочим телом является идеальный газ. От исходного состояния А (рис. 4.3,а) рабочее тело расширяется изотермически (T1 = const) до состояния В, получая от теплоотдатчика теплоту q1 цк. Дальнейшее расширение происходит адиабатным процессом ВС до тех пор, пока температура рабочего тела не снизится до величины T2. Для возвращения рабочего тела в исходное состояние осуществляется его сжатие в изотермическом процессе CD (T2 = const). При этом в теплоприемник отводится теплота q2 цк. Цикл замыкается адиабатным процессом сжатия DA,в котором рабочее тело возвращается в исходное состояние A с температурой T1. Таким образом, цикл Карно состоит из двух изотермических и двух адиабатных процессов. Заметим, что поскольку цикл обратим, то изотермические процессы подвода и отвода тепла должны происходить при бесконечно малой разнице между температурами теплоотдатчика (или теплоприемника) и рабочего тела. Это позволяет считать, что в процессе изотермического расширения температура рабочего тела равна температуре теплоотдатчика T1, а в процессе изотермического сжатия – температуре теплоприемника T2. На рис. 4.3,б цикл Карно представлен в тепловой “T-s” диаграмме: 1. В “T-s” диаграмме изотермический процесс подвода тепла к системе изображается линией AB, параллельной оси абсцисс. В этом процессе рабочее тело получает теплоту q1 цк > 0, в результате чего его энтропия возрастает от sAдо sB на величину: 2. Далее следует адиабатное расширение по линии BC, в ходе которого температура рабочего тела уменьшится от T1 до T2, и при этом энтропия рабочего тела остаётся неизменной sB = sС. 3. При температуре T2 происходит изотермический процесс сжатия по линии CD, в ходе которого рабочее тело отдает приёмнику теплоту в таком количестве q2 цк, чтобы энтропия рабочего тела от значения sB = sС, снова вернулась к значению sA = sD, 4. Цикл завершается адиабатным сжатием DA, в ходе которого температура повышается от T2 до T1, принимая, таким образом, первоначальное значение. Теперь легко определить КПД цикла Карно, т.е. КПД идеального теплового двигателя. В уравнение (4.4) подставим значения количеств теплоты q1 цк и q2 цк из (4.5 и 4.6), выраженных через температуры и изменения энтропии в процессах AB и CD: Так как ΔsAB = |ΔsCD|, имеем, что: Из полученного выражения (4.7) видно, что термический КПД цикла Карно зависит только от температур источника (T1) и приёмника (T2) теплоты. Никакие физические свойства рабочего тела не вошли в выражение для ηt цк. Эти выводы составляют содержание так называемой теоремы Карно, которая формулируется следующим образом: Термический КПД цикла Карно зависит только от температур теплоотдатчика (T1) и теплоприёмника (T2) и не зависит от свойств рабочего тела. Из анализа формулы (4.7) следует: 1. Чем выше T1 и чем ниже T2, тем выше ηt цк. Хотя в настоящее время имеется техническая возможность получения очень высоких температур (сотни тысяч градусов), однако в реальных двигателях использовать эти температуры практически не представляются возможным, так как материалы, из которых изготовлены детали двигателей, не способны выдерживать такие температуры. Максимальная температура (T1), практически реализуется в большинстве двигателей, близка к 1000…2000 К. Имеются двигатели (например, ракетные), в которых используются более высокие температуры до 4000 К. Однако эти двигатели рассчитаны на очень короткий срок службы (не более нескольких десятков минут). Что касается температуры T2, то она приблизительно составляет 300 К, поскольку приёмником теплоты для всех двигателей, работающих в наземных условиях, является либо атмосферный воздух, либо вода в водоемах, реках, морях. Вообще говоря, искусственно может быть получена температура, даже близкая к нулю, однако получение температур ниже температуры окружающей среды связанно с затратой работы. Затрата работы оказывается больше, чем выигрыш в КПД, поэтому такой путь увеличения КПД оказывается неприемлемым. 2. Эффективность превращения теплоты в работу (термический КПД) в любом цикле не может быть больше, чем в цикле Карно, осуществляемом в том же интервале температур. 3. Термический КПД цикла Карно всегда меньше единицы, так как не существует источников теплоты с бесконечно высокой температурой (T1 = 4. Когда T1 = T2, термический КПД цикла ηt цк = 0, следовательно, если все тела термодинамической системы имеют одинаковую температуру, т.е. находится в тепловом равновесии, то преобразование теплоты в работу невозможно. Хотя теоретически цикл Карно является наиболее экономичным циклом, он не нашел практической реализации в тепловых машинах, использующих в качестве рабочего тела различные газы. Цикл Карно с газообразным рабочим телом осуществлять нельзя, т.к. обеспечить изотермическое сжатие с непрерывным отводом теплоты в изотермическом компрессоре и изотермическое расширение с непрерывном подводом теплоты в изотермической турбине. Только в паросиловых установках отвод теплоты и иногда частично подвод теплоты происходят при постоянных температурах в процессах конденсации пара и при парообразовании. В тепловом двигателе, работающему по циклу Карно и развивающему необходимую для практических целей мощность, диапазон изменения давления и объёма рабочего тела должен быть настолько большим, что двигатель получился бы недопустимо громоздким и тяжелым. Смысл рассмотрения цикла Карно заключается в том, что его энергетические показатели Lцк и ηt цк являются предельно высокими по сравнению с любимыми другими циклами тепловых машин в заданном интервале температур максимальной T1 = Tг и минимальной T2 = Tн. Поэтому показатели цикла Карно являются общим критерием оценки энергетической эффективности тепловых установок, в том числе ГТД и ДВС. Таким образом, цикл Карно является базовым для оценки совершенства любого произвольного цикла, в том числе и цикла авиационного ГТД. 16. Второе начало термодинамики. Обратимые и необратимые процессы. Энтропия. Второй закон термодинамики (второе начало термодинамики): самопроизвольно протекают процессы, приводящие к увеличению общей энтропии системы и окружающей среды ΔSсист + ΔSсреды ≥ 0 или ΔS ≥ 0 Для химической реакции изменение энтропии Энтропия (S) -мера энергетического беспорядка в системе, мера хаоса, мера той энергии, которая рассеивается в виде тепла и не превращается в работу. Изменение энтропии ∆S наиболее просто определяется для обратимых изотермических процессов, оно равняется тепловому эффекту процесса, делённому на абсолютную температуру. Энтропия – экстенсивная функция. Энтропия системы равна сумме энтропий составных частей. Её изменение зависит только от начального и конечного состояния системы и не зависит от пути перехода. Энтропию относят к 1 молю вещества в стандартных условиях S°298 ; измеряют ее в энтропийных единицах (э.е.): 1 Дж/мoль*К = 1 э.е. Больцман постулировал, что энтропия связана с термодинамической вероятностью логарифмической зависимостью S = k ln W уравнение Больцмана k – константа Больцмана: k = 1,38∙10-23 Дж/градус; W – число микросостояний, с помощью которых можно реализовать данное макросостояние: W= ; Р – вероятность того, что система находится именно в этом микросостоянии. Термодинамически обратимый процесс– процесс, протекающий в прямом и в обратном направлении без изменений в системе и в окружающей среде, т.е. при переходе из начального состояния в конечное все промежуточные состояния являются равновесными. При наличии неравновесных промежуточных состояний процесс считают термодинамически необратимым. Энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтропийного факторов. Термодинамические условия равновесия. Энергия Гиббса– функция состояния, являющаяся критерием самопроизвольности процессов в открытых и закрытых системах. G=H–TS H- энтальпия, Т- температура, S- энтропия. Изменение ЭГ определяется формулой: ΔG=ΔH–TΔS Стандартная ЭГ определяется формулой: где 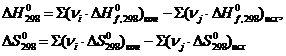 Критериями направления самопроизвольного протекания необратимых процессов являются неравенства ΔG<0 (для закрытых систем),ΔS> 0 (для изолированных систем). Самопроизвольное течение реакций в закрытых системах контролируется как энтальпийным (ΔrH), так и энтропийным (ΔrS) фактором. Для реакций, у которых ΔrH<0 и ΔrS> 0, энергия Гиббса всегда будет убывать, т.е. ΔrG< 0, и такие реакции могут протекать самопроизвольно при любых температурах В изолированных системах энтропия максимально возможное для данной системы значение Smax; в состоянии равновесия ΔS= 0. |
