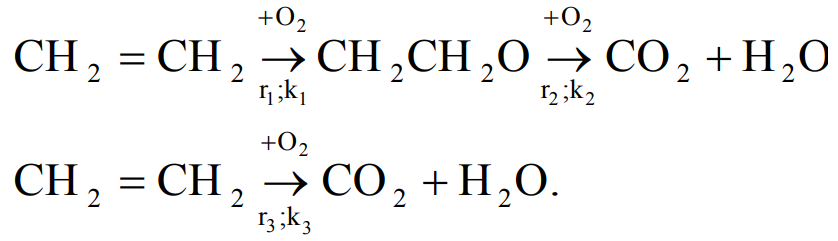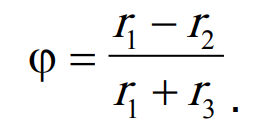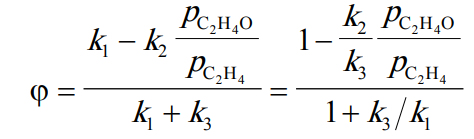|
|
экз. 1. Особенности технологий большой единичной мощности. Их преимущества и недостатки
Часть углеводородного слоя возвращается на орошение в колонну 1, а остальное его количество направляется на отмывку водой от ацетонитрила в колонну 2.
Отмытая бутановая фракция с верха колонны 2 далее поступает на азеотропную осушку.
Насыщенный бутенами ацетонитрил из куба колонны 1 поступает в десорбционную колонну 3, предназначенную для выделения бутенов.
Верхний продукт колонны 3, представляющий собой смесь бутенов, ацетонитрила и воды, после конденсации разделяется в сепараторе на два слоя – водный и углеводородный. Последний частично возвращается на орошение колонны 3, а остальное его количество поступает на отмывку от ацетонитрила в колонну 4.
Промывные воды из колонн 2 и 4 поступают в отпарную колонну 5 для отгонки ацетонитрила от избыточной воды.
Фузельная вода с низа колонны после охлаждения подается на орошение в колонны 2 и 4. Отбираемый с верха колонны 5 ацетонитрил вместе с потоком экстрактивного агента, выделяемым в кубе колонны 3, после охлаждения подается в экстрактивную колонну.
59. Технология двухстадийного дегидрирования н-бутана в 1,3-бутадиен, реакторная подсистема дегидрирования бутенов в 1,3-бутадиен.
Дегидрирование бутенов в 1,3-бутадиен является двухсторонней эндотермической реакцией:
С4Н8 ↔ C4H6 + H2 – 113,7 кДж/моль
Основными побочными процессами являются крекинг бутадиена с образованием более легких углеводородов и кокса; полимеризация олефинов и бутадиена; изомеризация бутенов в изобутен; газификация кокса за счет реакции с водой и водородом.
Дегидрирование бутенов проводится в адиабатических реакторах со стационарным слоем катализатора. В промышленности применяют два типа катализаторов: железосодержащие, состоящие из 2–50% Cr2O3, 25–90% Fe2O3 и до 15% K2CO3 и др. и хромкальцийникельфосфатные, имеющие формулу Ca8Ni(PO4)6 с промотирующей добавкой 2% Cr2O3.
Более активными являются хромкальцийникельфосфатные катализаторы, однако они имеют существенный недостаток – быстрое закоксовывание и потеря активности. Поэтому на данных катализаторах применяются короткие циклы дегидрирования, большое разбавление водяным паром и пониженная объемная скорость.
Степень конверсии бутенов составляет 40–45%;
Селективность 85%.
Железосодержащие катализаторы способны работать до 24 часов, после чего саморегенерируются. На этих катализаторах процесс ведут при меньшем разбавлении исходной смеси водяным паром.
Степень конверсии достигает 17–20%;
Селективность 80–85%.
Принципиальная технологическая схема дегидрирования бутенов представлена на рисунке 3. Бутеновую фракцию и водяной пар перегревают в трубчатых печах 1 и 2 до 500 0С и 700 0С, а затем смешивают в смесителях 3, устанавливая на входе в реактор необходимую температуру (600 – 650 0С).
Перегревать бутены свыше 500 0С не рекомендуется во избежание их термического разложения. Водяной пар понижает парциальное давление углеводородов, является теплоносителем и подавляет коксообразование.
Смесь бутенов с водяным паром поступает в реактор 4 и проходит слой катализатора сверху вниз. На выходе из реактора контактный газ, имеющий температуру 585 0С, подвергается «закалке» – быстрому охлаждению до 530 0С путем впрыска воды (это необходимо для предотвращения побочных реакций разложения и уплотнения).
Затем газовая смесь охлаждается в котле-утилизаторе 5 до 250 0С, после чего направляется на водную промывку в скруббер 6 и далее на разделение. Так как продолжительность работы катализатора невелика, то необходимо два реактора, которые можно будет быстро переключать с дегидрирования на регенерацию.
Регенерация проводится паровоздушной смесью при температуре контактирования. Пар реагирует с коксом с образованием СО2, СО и Н2.
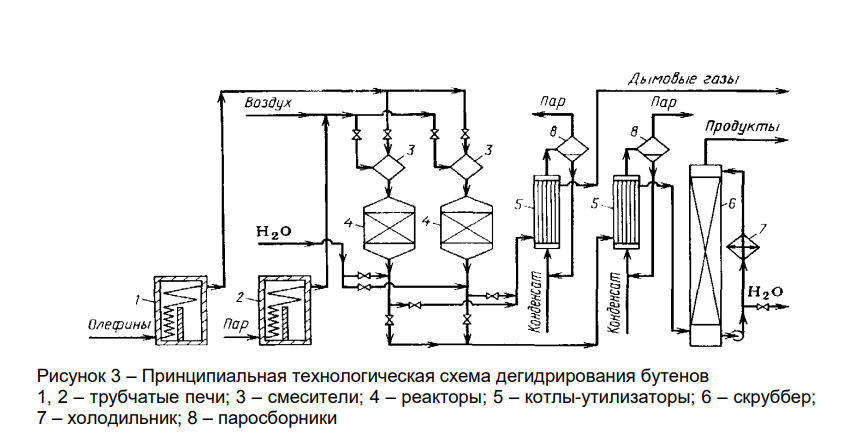
Газы регенерации охлаждаются в котле-утилизаторе 5, а затем после дополнительного охлаждения выбрасываются в атмосферу.
После окончания регенерации реактор продувается водяным паром и вновь переключается на дегидрирование. Все операции по переключению реакторов с одного цикла на другой выполняются автоматически.
60. Теоретические основы процесса окислительного дегидрирования.
Процесс окислительного дегидрирования бутенов является сопряженным, необратимым и протекает по следующей брутто реакции:
С4Н8 + 0,5О2 → C4H6 + H2О + 125 кДж/моль
Процесс окислительного дегидрирования эффективен, так как тепло, выделяемое реакцией окисления, используется для эндотермического дегидрирования.
Выделяющийся водород окисляется, что обеспечивает общую необратимость процесса:
С4Н8 ↔ C4H6 + H2
Н2 + 0,5О2 → H2О
Реальный процесс протекает несколько иначе:
С4Н8 + МОх →C4H6 + H2О + МОх-1
МОх-1 + 1/2О2 → МОх
и представляет собой сопряженную реакцию с общим интермедиатом – оксидом металла.
Основные побочные реакции – реакции полного окисления бутенов с образованием оксидов углерода:
С4Н8 + 6О2 → 4CO2 + 4H2О
С4Н8 + 4О2 → 4CO + 4H2О
В результате неполного окисления образуются также незначительные количества кислородсодержащих продуктов (формальдегид, ацетальдегид, ацетон, фуран, акролеин и др.). Наиболее нежелательная примесь – изобутилен, при содержании которого в сырье выше 0,5%, уменьшается конверсия бутенов и выход бутадиена вследствие большой реакционной способности изобутилена.
Катализаторами окислительного дегидрирования являются оксидные композиции Bi+Mo, Bi+Mo+P, Bi+W, Fe+Sb и др. Все они активны при температуре 400–600 0С.
Окислительное дегидрирование является непрерывным процессом, проводится в адиабатических реакторах со стационарным слоем катализатора, особенностью которого является необходимость разработки водородсодержащим газом при температуре 500–560 0С с последующим окислением паровоздушной смесью при 400–420 0С.
Принципиальная технологическая схема окислительного дегидрирования бутенов представлена на рисунке 4.
Пар и воздух смешивают и перегревают в трубчатой печи 1 до 500 0С.
Непосредственно перед реактором 2 в паровоздушную смесь вводят бутеновую фракцию. Реакционные газы отводятся снизу реактора, последовательно охлаждаются в котле-утилизаторе 3 и скруббере 4, а затем поступают в абсорбер 6, где промываются минеральным маслом.

Продукты крекинга, азот и непрореагировавший кислород отводятся с верха абсорбера и в дальнейшем используются в качестве топливного газа в трубчатой печи 1.
Минеральное масло вместе с растворенными в нем углеводородами С4 поступает в отпарную колонну 8, где оно выделяется в виде кубового продукта и после охлаждения возвращается в абсорбер 6.
Фракция С4 с верха колонны 8 поступает в блок выделения 1,3-бутадиена.
Основные параметры процесса окислительного дегидрирования:
Температура в реакторе 350-600 0С
Температура реагентов на входе 350-400 0С
Температура на выходе 590-600 0С
Соотношение мольное бутен/кислород/пар 1:0,8:15
Выход бутадиена на пропущенные бутены 45-48% масс.
Селективность 82-85% масс.
Конверсия 50-52% масс.
Примерный состав контактного газа окислительного дегидрирования бутенов
Компоненты % масс. Компоненты % масс.
С1–С3 0,04 С5+ 1,46
Изобутилен 0,04 СО+СО2 12,16
Бутены 22,86 О2 0,8
Бутан 3,52 N2 22,18
Бутадиен 36,40 Кислородсодержащие 0,35
61. Оксиды олефинов. Способы получения и направления использования. Основные промышленные способы получения оксидов олефинов.
Оксиды олефинов используются при промышленном производстве поверхностноактивных веществ, пластификаторов, антифризов и полиуретанов. В промышленном масштабе освоено производство оксидов этилена и пропилена.
Первым способом получения окиси этилена был хлоргидринный метод, основанный на гипохлорировании этилена хлорноватистой кислотой в водных растворах хлора: 
Второй стадией процесса являлось омыление кислых растворов этиленхлоргидрина концентрированными растворами едких щелочей:
Технология позволяла использовать разбавленные этиленсодержащие газовые смеси, имела простое аппаратурное оформление.
Наряду с оксидом этилена в качестве побочного продукта получали 1,2-дихлорэтан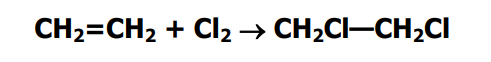
Причем его количество позволяло говорить о совместном получении двух целевых продуктов в ходе одного технологического процесса. Тем не менее, использование этой технологии практически прекращено.
В настоящее время оксиды олефинов производятся в основном рассмотренным ранее способом гидроперекисного эпоксидирования, а также прямым окислением этилена.
Единственным известным в настоящее время катализатором прямого окисления олефинов в соответствующие оксиды является активное серебро.
В качестве катализатора на всех производствах оксидов олефинов используется серебро с промотирующими и структурообразующими добавками, нанесенное на пористый корундовый носитель в виде шариков или колец.
Реакция
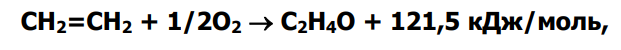
сопровождается полным окислением этилена 
При более высоких температурах проявляется реакция полного окисления окиси этилена
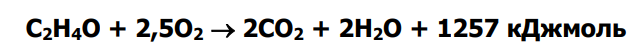
В целом можно говорить о некотором общем виде уравнения, описывающего скорость реакции окисления этилена

Большое значение для эффективного проведения процесса имеет температурный режим и степень конверсии этилена.

Зависимость селективности образования оксида этилена от температуры (а) и степени конверсии (б)
Это связано с последовательно-параллельным характером образования продуктов полного окисления
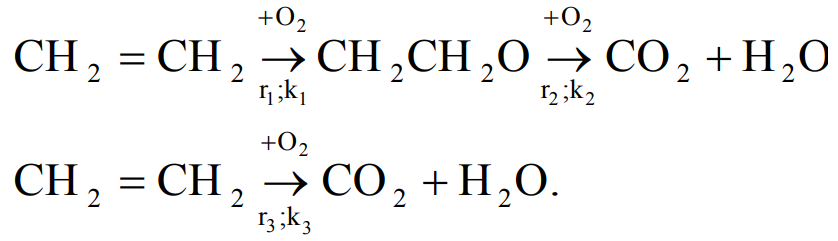
Выражение для дифференциальной селективности по оксиду олефина имеет вид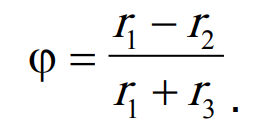
При допущении о равных порядках скоростей реакций парциального и полного окисления получим:
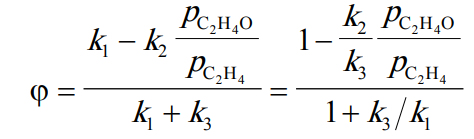
В промышленности процесс окисления этилена с получением окиси этилена проводят на серебряном катализаторе, промотированном, как правило, хлором, серой, цезием.
Окисление ведут в кожухотрубных реакторах со стационарным слоем катализатора, обеспечивая конверсию этилена за один проход 15—25% и концентрацию оксида этилена на выходе 0,7—1,5%. Температура 230—250 °С, давление 0,3—3,5 МПа.
62) Теоретические основы процесса получения оксида этилена прямым гетерогенно-каталитическим окислением.
Катализатор: Серебро с промотирующими и структурообразующими добавками, нанесенное на пористый корундовый носитель в виде шариков или колец.
Промоторами серебра являются хлор, сера, цезий.
Окисление ведут в кожухотрубных реакторах со стационарным слоем катализатора, обеспечивая конверсию этилена за один проход 15-25% и концентрацию оксида этилена на выходе 0,7-1,5%. Температура 230-250 0С, Давление 0,3-3,5 МПа.
Требования к исходному сырью: Свежий этилен, содержащий промотирующую добавку (С2Н4Cl), предварительно очищенную от ацетилена, сернистых соединений, высших непредельных углеводородов.
Реакция: СН2=СН2 + ½ О2 = С2Н4О (–Q) необратимая реакция
Сопровождается полным окислением: СН2=СН2 +3О2 = 2СО2 = 2Н2О (-Q) необратимая
При более высоких температурах: С2Н4О + 2,5 О2 = 2СО2 + 2Н2О (-Q) необратимая
Кинетика процесса: w = k’*Pn1C2H4*Pn2O2/(1+k”*PC2H4O),
где кажущиеся порядки для n1=0-0,45; n2=0,55-1.
С увеличением степени конверсии и температуры селективность процесса падает.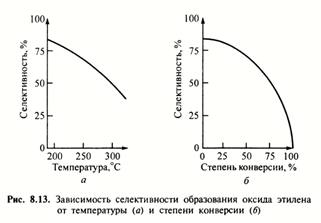
Связано это с последовательно-параллельным характером образования продуктов полного окисления

Дифференциальная селективность:

63) Обоснуйте необходимость низкой конверсии этилена в процессе получения оксида этилена прямым парциальным окислением.
При высоком значении конверсии протекают побочные реакции => селективность процесса уменьшается. => Прямое парциальное окисление нужно осуществлять при маленьких значениях конверсии.

64) Технология получения оксида этилена прямым гетерогенно-каталитическим окислением (окислитель – воздух)
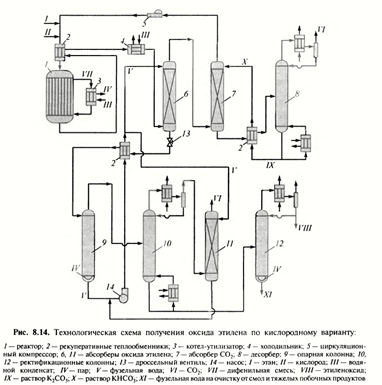
Свежий этилен, смешивается с циркуляционным потоком при 2 МПа, затем в парогазовую смесь вводят кислород. Смесь подогревается отходящими реакционными газами в теплообменнике 2. После эта смесь(С2Н4,СО2,О2, инертные газы) поступает в кожухотрубный реактор 1 при 210 0С. Данную темпеературу в реакторе поддерживает тепло циркулирующий в межтрубном пространстве высококипящий орг.теплоноситель.
Во внешнем котле-утилизаторе 3 за счет тепла дифинильной смеси вырабатывается пар с давлением 5,0 МПа.
Выходящий из реактора 1 поток (этилен, О2, оксид этилена 1,5%, СО2 и инертные газы) охлаждается исходной смесью в теплообменнике 2, а затем в водяном холодильнике 4. После этого смесь поступает в абсорбер 6. В качестве абсорбента используется фузельная вода из аппаратов 9 и 11. Раствор оксида этилена из абс.6 после дросселирования нагревается фузельной водой в тепообменнике 2 и поступает в отгонную колонну 9, обогреваемую острым паром. Далее смесь, состава: оксида этилена, СО2 и небольш. кол-ва паров воды поступает в ректификационную колонну 10. В ней происходит фракционирование смеси, т.к эффективность колонны 10 не может быть большой из-за трудности разделения СО2 и оксида этилена. В дистилляте выделяется СО2. В кубе – оксид этилена. Кубовый продукт поступает в ректификационную колонну 12, где в качестве дистиллята выделяют товарную окись этилена. Кубовый продукт составляет фузельную воду, загрязнённую смолообразующими продуктами, и отводится на очистку.
Парогазовый поток из абсорбера 6 направляется в карбонатную очистку от СО2 в абсорбере 7. Раствор гидрокарбоната подогревается в теплообменнике и направляется на десорбцию в аппарат 8 ( при давлении 2-3атм). Растов карбоната калия из куба десорбера охлаждают и возвращают насосом на стадию абсорбции в аппарат 7.
(реактор, трубопровод и арматура должна быть изготовлена из нержавеющей стали, т.к обычная сталь корродиует в среде влажного СО2).
65) Технология получения оксида этилена прямым гетерогенно-каталитическим окислением (окислитель – технический кислород).

Свежий этилен и воздух смешивают с рециркуляционными газами (0,3-3МПа). Смесь поступает в реактор 1. Выходящий парогазовый поток содержит окло 1,5% оксида этилена. Тепло реакции используют для подогрева рециркуляционного потока и исходного сырья в теплообменнике 2, а затем парогазовую смесь направляют в абсорбер 3, орошаемый охлажденной фузельной водой для отмывки оксида этилена от рециркуляционных газов. Постоянное накопление инертов в рецикле, охватывающем аппараты 1—3—2, делает необходимым отвод части газового потока. Поэтому часть газов из абсорбера 3 дожимают в компрессоре 5 до рабочего давления и направляют на вторую стадию окисления в реактор 4 после подогрева отходящими газами. В реакторе 4 процесс ведут при высоких конверсиях этилена, несмотря на то, что селективность по целевому продукту падает. Это связано с тем, что после окисления и отмывки оксида этилена в абсорбере 2 газы сбрасывают в атмосферу. При больших мощностях производства становятся выгодными даже установки с тремя ступенями окисления. Технологический прием многоступенчатого окисления дает возможность довести выход оксида этилена до 65 %.
66. Предложите условия проведения процесса получения оксида этилена прямым парциальным окислением воздухом и обоснуйте свой выбор.
|
|
|
 Скачать 4.33 Mb.
Скачать 4.33 Mb.