биотехнология ответы на экзамен. биотехнология экзамен. 1. Предмет и задачи биотехнологии. Объектами биотехнологии
 Скачать 264.41 Kb. Скачать 264.41 Kb.
|
50–60 °С на получившиеся одноцепочечные матрицы;Базовые штаммы. Во многих биотехнологических процессах используются GRAS-микроорганизмы (generally recognized as safe), которые обычно считаются безопасными. 1) Бактерии Bacillus subtilis, Bacillus amyloliquefaciens, другие виды бацилл и лактобацилл, виды Streptomyces. 2) грибы Aspergillus, Penicillium, Mucor, Rhizopus и дрожжей Saccharomyces и др. GRAS-микроорганизмы непатогенные, нетоксичные и в основном не образуют антибиотики, поэтому при разработке нового биотехнологического процесса следует ориентироваться на данные микроорганизмы, как базовые объекты биотехнологии 12.Требования к продуцентам, используемым в биотехнологическом производстве. Требования к штаммам-продуцентам ферментов: 1) желательно образование внеклеточных ферментов, так как их легче выделить; 2) высокий выход фермента за короткое время; 3) очистка фермента от культуральной жидкости должна быть легкой; 4) штаммы не должны продуцировать антибиотики, токсичные вещества и не должны быть родственны штаммам, образующим токсины. Критерии при выборе биотехнологического объекта: 1) Способен синтезировать целевой продукт. 2) Имеет высокую скорость роста; 3) Растет на доступных и недорогих питательных субстратах; 4) Устойчивость к заражению посторонней микрофлорой. 5) Непатогенный и не токсигенный для человека и животных, безопасный для окружающей среды. Требования к продуцентам в биотехнологии Штамм-продуцент должен характеризоваться следующими свойствами: 1) способностью расти в чистой культуре и генетической стабильностью; 2) отсутствием патогенности и токсичности; 3) высокой скоростью роста при промышленном культивировании и способностью синтезировать продукт в большом количестве и за короткий промежуток времени; 4) устойчивостью к контаминации (например, за счет изменения физико-химических условий среды, способности к росту при повышенных температурах или к синтезу антибиотиков); 5) способности расти на недорогих и доступных питательных средах 13.Выделение и селекция микроорганизмов – продуцентов биологически активных веществ. Получ-е ген рекомбинантов; у м.о. они получ путем слияния протопластов ( разрушкл стенки, соед-е 2х кл путем электрослияния, образ 2 генома в 1кл); дост-во этого метода сост в возм-тисовмещ в 1м геноме различн мутаций из разных родит штаммов,не прибегая к дополнит мутаген обраб и поиску нужной мутации у исходного штамма. Прим-е горизонт переноса генетического материала (коньюгация); Генетич инжененрия – введ-е чужер гена д/производ-тим.о. и оптимизации экспрессии гена (исп-е гормонов и Б-иммуномодуляторов) А) Ген рекомбинация перераспред гены/их части и позвобъед в одном геноме признаки 2х организмов и более. В рез-те образ гибридн/рекомбикл, сочетающие св-ва родит форм. В опыты по гибридизации берут генетически маркированные штаммы м.о. - чаще всего ауксотрофн мутанты и мутанты, уст к ингибиторам роста. Это позв выявлять колонии, совмещ признаки 2х родителей. Гибрид-я промышл штаммов дрожжей осложняется тем, что они часто полиплоидны:соднеск наборов хр-м, и у них редко набл слияние кл. Б) Важным комп-том бактерклявлкольц мол ДНК – плазмида,кот м находиться в автономном и в интегрированном сост по отн к хр-ме клетки- хозяина. Конъюгативнплазмидыспос к мобилизации хромосомных генов, что я исп д/получгенетичрекомбичантов у бактВпервыеконъюг перенос хромосомных генов был обнаружен у Е. соli.Для конъюгационногоскрещ-я культуры донора и реципиента смеш и инкубируют совместно в пит бульоне/ на пов-титвагаризованных сред. В этих услклсоед м-ду собой при помконъюгац мостика, ч/з кот в рецип клетку начиная с сайта ori Т плазмиды поступает хромосома донора. Почти кажд вид бактявл хозяином 1/ несквирулент/уме фагов, кот явлважн инструментом ген анализа и конструир-я штаммов бактерий с пом трансдукции и методов генетической инженерии. Трансдукция— перенос ген инф от клетки донора к клетке-реципиенту, кот осущ фагом. Оно основано на том, что в процразмн-я фагов в бакт иногда обр-ся частицы, кот наряду с фаговой ДНК или вместо нее сод фрагменты бактер ДНК. Такие ч-цыназтрансдуцирующими. Отбор рекомбинантов, кот назтрансдуктантами, проводят на селективных средах, где не могут расти исходные реципиентныеклетки.Гл этапом обр-я трансдуиирующих ч-ц явлпроцупак ДНК.У разн фагов специф-тьупакки меняется в широких пределах по виду пакуемой ДНК (фаговая/бактер) и по степени взаимод-я с различн участками на бактерДНК.Приобрспецифичтрансдуиирующих фагов в головку упак только фаговая ДНК и только с опредучастка.Если к ней присоед отрезок бактерДНК, прилеж к профагу, то они м быть упакованы вместе. При неспецифичтрансдукции фаговые оболочки могут начать упаковываться не только с фаговой, но и с бактерДНК в различных участках, специфичность кот м быть неодинак. Если упаковка началась с бактериальной ДНК, то головка фага полностью заполняется только ею, а избыток ДНК удаляется. 14.Использование мутагенеза для селекции штаммов. 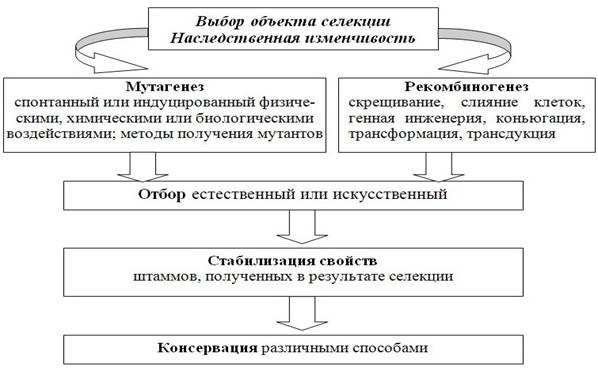 В качестве мутагенных воздействий применяются УФ, рентгеновское и гамма-излучения, определенные химические вещества и др. Недостатки: трудоемкость, отсутствие сведений о характере изменений, поскольку экспериментатор ведет отбор по конечному результату. 15.Отбор ауксотрофных мутантов и мутантов, устойчивых к антибиотикам как способ получения продуцентов биологически активных веществ. Уровень экспрессии структурных генов может быть изменен в результате мутаций. Целенаправленная селекция перспективных мутантов –основная задача биотехнологии,т.к дефекты в регуляции обмена вещест обеспечивают синтез целевых продуктов метаболизма.Мутации по участкам цистрона могут провести к изменениям в конформации белка, которые делают молекулу энзима нечувствительной к концентрации конечного продукта.Это обеспечивает возможность образовывания в клетке избыточного количества целевого продукта. Мутации в гене-регуляторе проводят таким образом,чтобы его продукт белок-репрессор утрачивал способность связываться с индуктором или оператором.Мутантные организмы у которых изменены нуклеотидные последовательности в зоне гена-оператора не могут связывать нормальноый репрессор и также обретают способность к конститутивной экспрессии структурных генов.Мутанты с ограниченной способностью к образовыванию конечных продуктов называются ауксотрофными.Благодаря отсутствию ингибитора-конечного продукта использование субстрата и рост м/о продолжаются лишь при условии добавления в среду в литмитирующих количествах вещества-продукта блокированной реакции.Для отбора ауксотрофных мутантов и регуляции обмена веществ испол. След методы селекции: 1.получение мутантов,устойчивых к структурным аналогам целевого продукта 2.выделене ревентрантов из ауксотрофных мутантов.Уних восстановлена способность к синтезу конечного продукта 16.Генетическая инженерия и технология рекомбинантных ДНК. Основные открытия, обосновавшие теоретически технологический подход к наследственной информации. Генетическая инженерия– технология получения новых комбинаций генетического материала путем проводимых in vitro манипуляций с молекулами нуклеиновых кислот (ДНК, РНК) и переноса созданных конструкций генов в реципиентный организм. По Э.С. Пирузян генетическая инженерия- система экспериментальных приемов, позволяющих конструировать лабораторным путем (в пробирке) искусственные генетические структуры в виде так называемых рекомбинантных или гибридных молекул ДНК. Генетическая инженерия возникла на стыке многих биологических дисциплин: молекулярной генетики, энзимологии, биохимии нуклеиновых кислот и др. Первая рекомбинантная ДНК получена в 1972 г. (П. Бергом с сотр.) и была составлена из фрагмента ДНК обезьяньего вируса ОВ40 и бактериофага X dvgal с галактозным опероном Е. coli. Формально 1972 г. следует считать датой рождения генетической инженерии. Цель генетической инженериизаключается в конструировании таких рекомбинантных молекул ДНК, которые при внедрении в генетический аппарат придавали бы организму свойства, полезные для человека. Например, получение «биологических реакторов» - микроорганизмов, растений и животных, продуцирующих фармакологически значимые для человека вещества, создание сортов растений и пород животных с определёнными ценными для человека признаками Возможность конструировать новые гибридные молекулы ДНК in vitro возникла благодаря сделанным в середине XX в. открытиям: 1) установление комплементарной структуры ДНК, 2) механизма ее репликации и репарации, 3) расшифровка генетического кода, 4) установление механизма переноса генетической информации в клетке, 5) механизмов работы и регуляция генов и др. Молекуларекомбинантной ДНКпредставляет собой соединенные вне живой клетки два компонента: 1) вектор, обеспечивающий механизм репликации и экспрессии, 2) фрагментклонируемой(«чужеродной») ДНК, содержащий интересующие исследователя генетические элементы. Технология рекомбинантных ДНК– совокупность экспериментальных процедур, позволяющих осуществлять перенос генетического материала из одного организма в другой. Технология рекомбинантных ДНК использует следующие методы: 1) специфическое расщепление ДНК ферментами- рестрицирующими нуклеазами, для выделения и манипуляции с отдельными генами; 2) секвенирование (определение последовательности) всех нуклеотидов в очищенном фрагменте ДНК, что позволяет определить границы гена и кодируемую им аминокислотную последовательность; 3) конструирование рекомбинантной ДНК; 4) гибридизация нуклеиновых кислот, позволяющая выявлять специфические последовательности РНК или ДНК с большей точностью и чувствительностью, основанную на их способности связывать комплементарные последовательности нуклеиновых кислот; 5) клонирование ДНК: амплификация in vitro с помощью цепной полимеразной реакции или введение фрагмента ДНК в бактериальную клетку, которая после такой трансформации воспроизводит этот фрагмент в миллионах копий; 6) введение рекомбинантной ДНКв клетки или организмы. 17.Инструменты генетической инженерии. Инструментами в технологии рекомбинантных ДНКявляются ферменты нуклеинового обмена и, прежде всего, эндонуклеазы рестрикции (рестриктазы). В природе рестриктазы являются компонентом системы рестрикции-модификации, которая служит защитным механизмом от чужеродной ДНК у микроорганизмов Все ферменты нуклеинового обменаусловно можно разделить на следующие группы: используемые для получения фрагментов ДНК (рестриктазы); синтезирующие фрагменты ДНК на матрице РНК (ДНК-полимеразы, обратные транскриптазы (ревертазы), фосфатазы, полинуклеотидкиназы ); соединяющие фрагменты ДНК (ДНК-лигазы); позволяющие осуществить изменение структуры концов фрагментов ДНК; применяемые для приготовления гибридизационных проб. .В эту систему входят два фермента, специфичных для каждого штамма: 1) ДНК модифицирующий (метилтрансфераза, или метилаза). Метилтрансфераза, метилируя определенный нуклеотид в пределах сайта узнавания, защищает внутриклеточную ДНК от действия рестриктазы. 2) ДНК расщепляющий (эндонуклеаза рестрикции), Рестриктаза расщепляет фосфодиэфирные связи двухцепочечной ДНК в определенном месте участка узнавания или рядом с ним при отсутствии специфической модификации Эндонуклеазы рестрикции (рестриктазы) II типаузнают определенные последовательности оснований в двухцепочечной молекуле ДНК и расщепляют обе цепи в определенном месте. 18.Метод полимеразной цепной реакции. Метод полимеразной цепной реакции (ПЦР)делает возможным быстрый синтез (амплификацию) в пробирке нужных последовательностей из считанных исходных копий. Для проведения амплификации нужны следующиекомпоненты: ДНК-матрица (ДНК или ее часть, содержащая искомый специфический фрагмент); Праймеры (синтетические олигонкулеотиды (20-30 нуклеотидных пар), комплементарные последовательностям ДНК на границах определяемого специфического фрагмента). Смесь дезоксинуклеотидтрифосфатов (дНТФ) (смесь четырех дНТФ, являющихся материалом для синтеза новых комплементарных цепей ДНК) Фермент Taq-полимераза (термостабильная ДНК-полимераза, катализирующая удлиннение цепей праймеров путем последовательного присоединения нуклеотидных оснований к растущей цепи синтезируемой ДНК) Буферный раствор (реакционная среда, содержащая ионы Mg2+, необходимые для поддержания активности фермента) . ПЦР представляет собой серию из трех циклически повторяющихся стадий реакции (15–30 циклов по 1–3 мин): 1) тепловая денатурация исходной ДНК при |
