Ответы к Колойдной химии экзамен, Мирэа тхт. Все лекции по колде. 1. Предмет коллоидной химии. Почему поверхностные явления и дисперсные системы изучают в рамках одной дисциплины коллоидной химии Значение коллоидной химии для технологии
 Скачать 2.71 Mb. Скачать 2.71 Mb.
|
(σЕ/в)1/2 в- размер молекулы.
(σЕ/l)1/2 Е-модуль Юнга, l-размер трещины РидРяды редкоземельный Ме: Mg2+ Влияние валентности ионов: адсорбционная способность сильно зависит от валентности иона. Зависимость прямая. K+ 38. Классификация ПАВ по химическому строению. В соответствии с характером диссоциации полярных групп ПАВ делятся на: 1) ионные 1,1) анионные ПАВ –органические соединения, молекулы которых диссоциируют в воде образуя поверхностно активный анион(СОО-, SO3-, OSO3-)- Жирные кислоты и их соли 1,2)катионные ПАВ –органические соединения, молекулы которых диссоциируют в воде образуя катионы(NH3+, -N(CH3)+)- Соли первичных, вторичных, третичных аминов 1,3) амфолитные ПАВ –содержат карбоксильные и аминогруппы(RNH(CH2)nCOOH) 2)Неионные ПАВ –продукты присоединения окиси этилена к веществам с развитым углеводородным радикалом(OH-, (CH2CH2O)H)- Блоксополимеры, оксиэтилированные спирты. КПАВ>АПАВ>НПАВ>АмПАВ. 39. Коллоидные поверхностно-активные вещества. Мицеллообразование, строение мицелл в водной и углеводородной среде. К  оллоидные ПАВ -способны к обратимым переходам от истинного раствора к гелю и золю. Особенности: способность к образованию мицелл и солюбилизация(растворение в мицеллах ПАВ веществ нерастворимых в данных растворителях. Состоит из ассиметричных молекул. Число агрегации- число молекул ПАВ входящих в мицеллу. оллоидные ПАВ -способны к обратимым переходам от истинного раствора к гелю и золю. Особенности: способность к образованию мицелл и солюбилизация(растворение в мицеллах ПАВ веществ нерастворимых в данных растворителях. Состоит из ассиметричных молекул. Число агрегации- число молекул ПАВ входящих в мицеллу.Строение мицелл в углеводородной в водной среде среде(числа агрегации (числа агрегации 30-10) 20-100) Мицеллообразование приводит к уменьшению межфазной энергии раствора ПАВ. Мицеллы образуют только ПАВ, обладающие оптимальным соотношением между гидрофобной и гидрофильной частями. 40. Две модели мицеллообразования. 1)Двухфазная(псевдофазная) модель. Мицеллообразование рассматривается как граница раздела фаз. 2)Химическое равновесие- Мицеллообразование рассматривается как обратимая химическая реакция m(ПАВ)<=>(ПАВ)m. время жизни (ПАВ)m=10-7сек. 41. Термодинамика образования прямых и обратных мицелл. Образование прямых мицелл 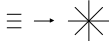 Сферическая мицелла Гартли, число агрегации 20-100 Сферическая мицелла Гартли, число агрегации 20-1000>ΔG=ΔH-TΔS-В водной среде, процесс самопроизвольный. ΔH- не велика и может быть положительной. Н  2О- структурированная жидкость, при введении в Н2О неполярных частиц происходит упорядочивание воды около этих неполярных частиц. Это явление термодинамически не выгодно, поэтому образованные водородные связи рвутся и возрастает ΔSН2О. Движущей силой мицеллообразования является положительная энтропия. ΔSсист=ΔSмиц↓+ ΔSН2О↑-энтропия системы. Образование обратных мицелл( числа агрегации 30-40) 2О- структурированная жидкость, при введении в Н2О неполярных частиц происходит упорядочивание воды около этих неполярных частиц. Это явление термодинамически не выгодно, поэтому образованные водородные связи рвутся и возрастает ΔSН2О. Движущей силой мицеллообразования является положительная энтропия. ΔSсист=ΔSмиц↓+ ΔSН2О↑-энтропия системы. Образование обратных мицелл( числа агрегации 30-40)образуются в неводных средах. Движущая сила- взаимодействие полярных групп между собой. TRlnKKM=A-Bn Число агрегации- число молекул ПАВ входящих в систему. 42. Критическая концентрация мицеллообразования (ККМ). Методы определения ККМ в полярных и неполярных средах. Влияние различных факторов на величину ККМ в полярных и неполярных средах. ККМ- концентрация при которой в растворе ПАВ образуются мицеллы. Влияние различных факторов на ККМ. 1)влияние длинны углеводородного радикала RTlnKKM=A-Bn;(KKM)n/(KKM)n+1= =gn+1/gn=3.2, где n-число групп СН2 при увеличении длинны R ККМ↓ в ряду гомологов. А-const характеризующая энергию взаимодействия полярной группы ККМ↓ для: 1) ионных ПАВ- I- > Br- > Cl- 2)катионных ПАВ- Cs+ > K+ > Na+ В-const характеризующая энергию растворения приходящуюся на 1 группу СН2. 2)влияние строения углеводородного радикала. ККМ↑ при равном количестве атомов «С» по сравнению с парафиновой цепью 2,1)циклизация цепи 2,2) введение в цепь полярных групп, гетерогенных атомов, кратных связей. 3)введение добавок электролита всегда ↓ККМ, электролит частично дегидрирует полярные группы ПАВ, приводит к увеличению гидрофобности. 4)влияние полярных групп органических веществ зависит от длинны углеводородного радикала; длинноцепочные спирты ↓ККМ, образовывая смешанные мицеллы. При вводе низкомолекулярных добавок ККМ↑, за счет хорошей растворимости. 43. Солюбилизация в растворах мицеллообразующих ПАВ. Механизмы солюбилизации в мицеллах ПАВ. Влияние различных факторов на солюбилизацию. Солюбилизация- растворение в мицеллах ПАВ веществ плохо растворимы в данном растворителе. В обратных мицеллах ПАВ солюбилизирует полярные вещества. Увеличение длинны углеводородного радикала ↑ солюбилизацию, а введение в углеводородный радикал ароматических циклов, кратных связей или гетероатомов ↓ солюбилизацию. Механизм солюбилизации в :  Жирах Длинноцепочных спиртов Жирах Длинноцепочных спиртов44. Влияние температуры на растворимость ионогенных ПАВ. Диаграммы состояния системы. Точка Крафта. Тачка Крафта. Растворимость ионогенных ПАВ в воде вначале медленно, а затем быстро увеличивается с увеличением температуры, их фазовое состояние определяется точкой Крафта. С повышение температуры растворимость медленно увеличивается, и при температуре Крафта достигает критической концентрации мицеллообразования.  С Скристалло мицелярный р-р ПАВ гидрат СККМ истинный раствор ткрафта Т 45. Влияние температуры на растворимость неионогенных ПАВ. Точка помутнения и точка высаливания. Изменяют физико-химические свойства при нагревании. Это связано с изменением их растворимости. Растворимость достигается за счет водородных связей. Растворимость неионогенных ПАВ ухудшается с увеличением температуры, тк рвутся водородные связи, это характеризуется точкой помутнения, при дальнейшем повышении температуры достигается точка высаливания. 46. Полиморфные превращения мицелл коллоидных ПАВ. Лиотропные жидкие кристаллы.  Сферич мицелла Сферич мицелла Пластичная мицелла МакБена Лиотропные жидкие кристаллы. 47. Количественные характеристики свойств ПАВ, Числа ГЛБ. Расчет чисел ГЛБ по методу Дэвиса. Одной из характеристик ПАВ является гидрофильно-лиофильный баланс. ГЛБ – электрическая оценка ПАВ, предложена Гриффитом. Эталон в системе ГЛБ –олеиновая кислота, для которой число равно 1. –СООК +2,1 -СООН +2,4 - СН2 -0,475 Уравнение Дэвиса. ГЛБПАВ=I +Σ(ГЛБ)ГИДРОФИЛЬНЫХ ЧАСТЕЙ+Σ(ГЛБ)ЛИОФИЛЬНЫХ ЧАСТЕЙ. При значении ГЛБ 1-4 ПАВ не растворимы в воде. Если 8-10- эмульсии, типа молока. Если больше 13- прозрачные растворы. Если ГЛБ3-6- эмульгаторы обратных эмульсий., 7-9- хорошие смачиватели, 13-15- моющие средства. Физический смысл ГЛБ: отношение работы адсорбции молекул ПАВ на границе из фазы масла, к работе адсорбции на той же границе из фазы вода. 48. Методы диспергирования. Уравнение Ребиндера для работы измельчения. 1) механическое диспергирование -основано на механических способах преодоления межмолекулярных сил, за счет производства внешней работы происходит накопление внешней энергии. ΔF>0. Диспергирование- измельчение тв или жидких тел в инертной среде. Диспергирование может идти в результате процессов: раздавливания, истирания, дробления. Для этого используются шаровые мельницы, коллоидные мельницы тд. При сухом помоле размер частим около 60мкм; при мокром- размер частиц сильно уменьшается и можно получить ультрадисперсные системы. Уравнение Ребиндера: Wдисп=Wдеформ+Wповерх=KV+σΔS 49. Адсорбционное понижение прочности(эффект Ребиндера). Прочность как поверхностное свойство материалов. С  вязь прочности и поверхностной энергии: в основе понижения механических свойств твердых тел под влиянием ПАВ лежит снижение поверхностной свободной энергии, и , как следствие, уменьшение работы, необходимой для образования новых поверхностей. Соотношение Гриффитса Р0 вязь прочности и поверхностной энергии: в основе понижения механических свойств твердых тел под влиянием ПАВ лежит снижение поверхностной свободной энергии, и , как следствие, уменьшение работы, необходимой для образования новых поверхностей. Соотношение Гриффитса Р0 |

 раевой угол (Θ)- равновесный угол между молекулами жидкости и жидкостьюи твердым телом, который образует капля жидкости.
раевой угол (Θ)- равновесный угол между молекулами жидкости и жидкостьюи твердым телом, который образует капля жидкости.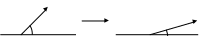 -ние Юнга: σтг = σжгcos Θ+ σтж cos Θ= (σтг- σтж)/ σжг=B-идеальный случай. В реальном случае термодинамическое равновесие не устанавливается из-за:1) условий формирования поверхности контакта 2)порядка соприкосновения жидкости и газа с тв телом 3)неоднородности поверхности тв тела и наличия пор.
-ние Юнга: σтг = σжгcos Θ+ σтж cos Θ= (σтг- σтж)/ σжг=B-идеальный случай. В реальном случае термодинамическое равновесие не устанавливается из-за:1) условий формирования поверхности контакта 2)порядка соприкосновения жидкости и газа с тв телом 3)неоднородности поверхности тв тела и наличия пор.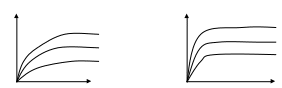 Вода-уголь Толуол-силикагель
Вода-уголь Толуол-силикагель В ЕА< ЕБ< ЕВ; ЕА>ЕБ>ЕВ σ↓ FS↓
В ЕА< ЕБ< ЕВ; ЕА>ЕБ>ЕВ σ↓ FS↓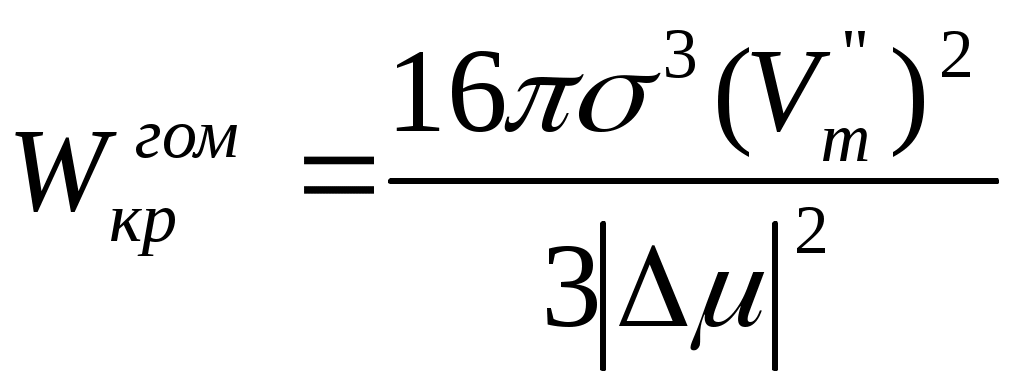 rкр>размера зародышей, то химический потенциал в нем выше химического потенциала в старой фазе -зародыш растворяется, rкр < размера зародыша, рост зародыша за счет перехода в него старой фазы.
rкр>размера зародышей, то химический потенциал в нем выше химического потенциала в старой фазе -зародыш растворяется, rкр < размера зародыша, рост зародыша за счет перехода в него старой фазы.