Ответы к Колойдной химии экзамен, Мирэа тхт. Все лекции по колде. 1. Предмет коллоидной химии. Почему поверхностные явления и дисперсные системы изучают в рамках одной дисциплины коллоидной химии Значение коллоидной химии для технологии
 Скачать 2.71 Mb. Скачать 2.71 Mb.
|
|
101. Размеры и форма макромолекул в растворе. Свойства гауссова клубка. М 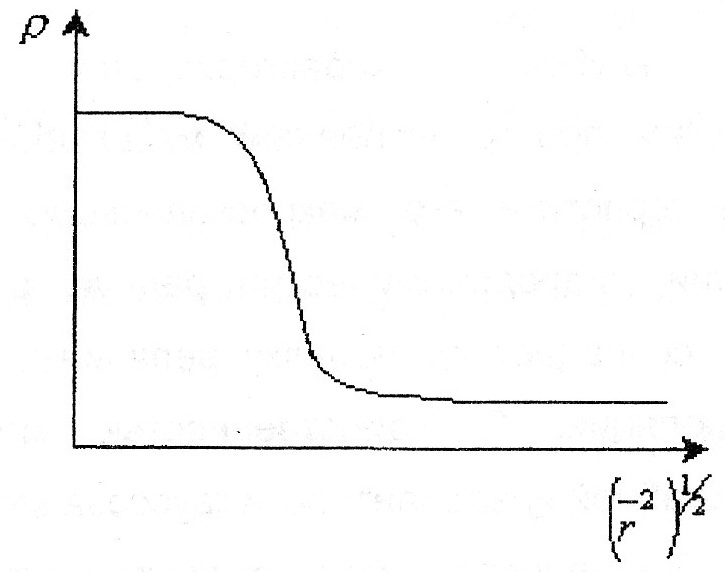 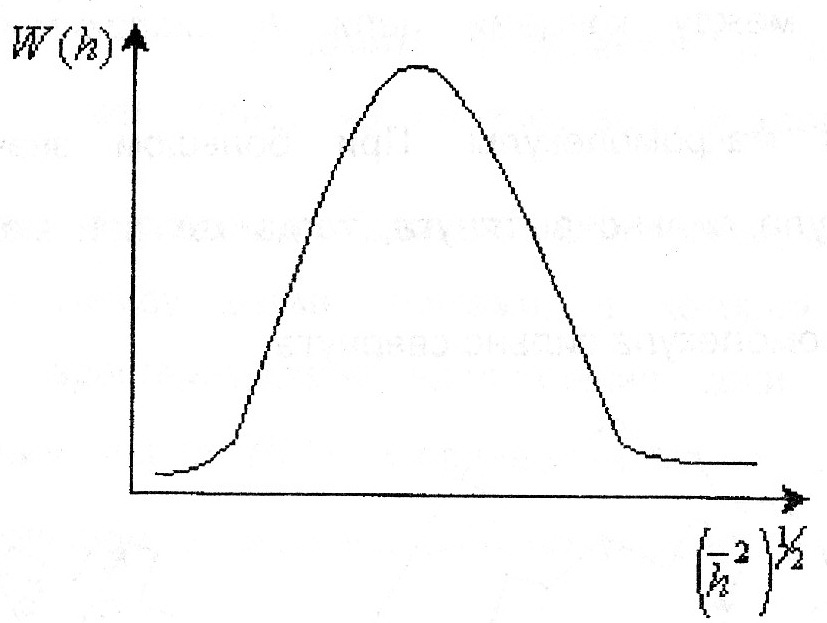 акромолекулы имеют размеры 1000 и более нм, те соизмеримы с размером ультрадисперсных систем. Свойства гауссова клубка. Набор конформаций характеризуется гауссовой функцией акромолекулы имеют размеры 1000 и более нм, те соизмеримы с размером ультрадисперсных систем. Свойства гауссова клубка. Набор конформаций характеризуется гауссовой функцией распределения расстояния между концами цепи. W(h)=f(h) W(h)- вероятность конформации с расстоянием h между концами цепи: W(h)=4/√π (3/(2NA2)3/2 *e^(3h2/2NA2l2) характеризуется плотностью сегмента. Гауссов клубок- облако сегментов распределяется вокруг центра сегментов по гауссовому закону. Плотность сегментов в клубке (ρ) максимальна к центре, убывает к периферии. 102. Термодинамическое сродство полимера к растворителю. Количественные критерии его характеризующие. -способность компонентов раствора взаимодействовать друг с другом. Количественные критерии термодинамического сродства: 1)изменение химического потенциала растворителя при переходя его в раствор:Δμ1=μ1-μ10=2,3RTlg(P1/P10)-растворение происходит в любом случае 2)коэффициент набухания α: 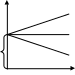 π/с хор. р-тель 3)величина 2-ого вириального коэффициента А2 для приведенного π/с хор. р-тель 3)величина 2-ого вириального коэффициента А2 для приведенного осмотического давления. ↑А2 лучше растворитель 4)константа Хагенса- идеал р-тель избыточная энергия межмолекулярного взаимодействия приходящаяся на 1 моль раствора(χ). Изменение свободной энергии RT/M2 необходимое для переноса молекулы растворителя из чистого плохой р-тель растворителя в полимерную фазу. А2=(ρ1/М1ρ22)(1/2-χ); А2=0 χ=0,5- идеальный растворитель; А2>0 χ=0,2-0,5-хороший растворитель. 103. Набухание как первая стадия растворения полимеров. Причины органического набухания полимеров. Н   абухание-проникновение молекул растворителя в полимер, сопровождающееся увеличением веса и объема полимера, ↓ ΔG. абухание-проникновение молекул растворителя в полимер, сопровождающееся увеличением веса и объема полимера, ↓ ΔG. ln(Qmax-Qτ) Различают процессы органического(1) и неорганического набухания(2). 2-е причины органического набухания: α 1)органическое сродство полимера и растворителя 2)наличие в полимере вулканизационной сетки(сшитый полимер) α=m-m0/m0- степень K=-tgα; K=tg(180-α) набухания dQ/dτ=K(Qmax-Qτ) τ 104. Термодинамика набухания и растворения. Процесс растворения полимеров происходит самопроизвольно. ΔG=ΔН-TΔS ΔG<0. 1)растворение полярных полимеров в полярных растворителях ΔН<0 Q+ 2)растворение полимера за счет роста энтропии(неполярные полимеры(гибкоцепные) в неполярных растворителях) ΔS>0 ΔSм=Sк-Sн=кlnWк-кlnWн ΔSк>ΔSн 105. Разбавленные растворы полимеров. Осмотическое давление растворов. 1)разбавленные растворы- концентрация полимера 0,1 доля %. В разбавленных растворах макромолекулы располагаются так, что их объемы не перекрываются. Объем в котором макромолекула вытесняет другие сегменты называется исключенным объемом сегмента или макромолекулы. Объем занимаемой макромолекулой называется координационной сферой. В разбавленных растворах координационной сферы не перекрываются- структурный критерий разделения полимеров на разбавленные и концентрированные. Осмотическое давление растворов полимеров- коллегативное свойство, зависит от числа частиц в объеме системы. P01>P1-упругость пара.  (а) Выравнивание химического потенциала (а) Выравнивание химического потенциала происходит через газовую фазу. (б) Выравнивание происходит через жидкую фазу. Мембрана значения не имеет. Осмотическое давление- сила приходящаяся на 1 площади мембраны которая заставляет растворитель проникать в раствор и является результатом взаимодействия между компонентами системы: 106. Межмолекулярные и внутримолекулярные взаимодействия в растворах полимеров. Температура Флори(θ). Внутримолекулярное и межмолекулярное взаимодействие. Внутримолекулярные- взаимодействия близко расположенных сегментов(близкодействующие) и взаимное удаление по цепи сегментов, но вследствие изгиба оказываются рядом- дальнодействующие. Межмолекулярное взаимодействие различных макромолекул между собой и взаимодействие полимера и растворителя. А2-свяpm с исключенным объемом и температурой. А2=V0Na/2V22; А2=ρ1(1-θ)Т/2Мρ22 если θ=Т, то А2=0-идеальный раствор, те как бы не существует взаимодействие между растворителем и полимером. При температуре Флори взаимодействия не устраняется, а лишь компенсируют друг друга, происходит компенсирование дальнодействия и взаимодействия с растворителем. 108. Термодинамическая равновесность растворов полимеров. Фазовая диаграмма раствора полимера. П  равило фаз: между числом степеней свободы, числом компонентов и числом фаз существует определенная зависимость F=K-Ф+2. в растворах полимеров- конденсированные системы и газовую фазу во внимание не принимают F=K-Ф+1 K=2 Ф=1. состояние системы определяется температурой и концентрацией. Диаграммы состояния раствора полимера. равило фаз: между числом степеней свободы, числом компонентов и числом фаз существует определенная зависимость F=K-Ф+2. в растворах полимеров- конденсированные системы и газовую фазу во внимание не принимают F=K-Ф+1 K=2 Ф=1. состояние системы определяется температурой и концентрацией. Диаграммы состояния раствора полимера.Тк Тк- критическая температура смешения, образуется гомогенный Тα раствор. Ниже Тк- в системе происходит расслоение(гетерогенная флуктуация). Диаграмма- термодинамический критерий деления растворов на разбавленные концентрированные. Левая часть- правая часть границ разбавленных растворов, а правая часть- левая граница разбавленных растворов. Бенадаль с верхней критической х’ хк х” φ2 температурой смешения характерен для растворения полярных полимеров в полярных растворах, с нижней- для неполярных растворов. |
