Ответы к Колойдной химии экзамен, Мирэа тхт. Все лекции по колде. 1. Предмет коллоидной химии. Почему поверхностные явления и дисперсные системы изучают в рамках одной дисциплины коллоидной химии Значение коллоидной химии для технологии
 Скачать 2.71 Mb. Скачать 2.71 Mb.
|
|
86. Факторы устойчивости коллоидных систем. Кинетическая устойчивость лиофобных дисперсных систем обеспечивается стабилизаторами( электролиты и ВМС). Факторы устойчивости: 1)термодинамический- обеспечивается при сохранении размера поверхности и поверхностного натяжения; снижается эффективность соударения между частицами и создаются потенциальные барьеры замедляющие или исключающие процесс коагуляции(слипания) 2)кинетический- снижает скорость коагуляции, связаны с гидродинамическими свойствами среды, связаны с замедлением сближения частиц, вытекание и разрушение прослоек среды. К термодинамическим фактору относятся: 1)электростатический фактор- уменьшение межфазного поверхностного натяжения при возникновении ДЭС на поверхности частиц в соответствии с уравнением Липмана( стабилизатор-электролит) 2)адсорбционно-сольватный- уменьшение межфазного поверхностного натяжения при взаимодействии частиц дисперсной фазы с дисперсионной средой благодаря адсорбции и сольватации 3)энтропийный- имеет две трактовки:-стремление частиц дисперсной фазы равномерно распределится по всему объему системы;- стабилизатор ВМС и неионогенный ПАВ. К кинетическому фактору относятся: 1)структурно-механический фактор(стабилизатор ВМС)- действие фактора обусловлено тем, что на поверхности частиц образуются пленки ВМС, обладающих упругостью и механической прочностью, разрушение которых требует затраты энергии 2)гидродинамический- снижает скорость коагуляции из-за изменения вязкости среды и плотности дисперсионной фазы и дисперсионной среды 3)смешанный – характерен для реальных дисперсных систем совокупность термодин и кинетич факторов 87. Устойчивость и коагуляция лиофобных дисперсных систем по теории ДЛФО. Природа сил притяжения и отталкивания между частицами. Изменение этих сил с расстоянием. Потенциальные кривые, энергетический барьер, ближняя и дальняя агрегация. В дисперсионной среде одновременно действуют силы притяжения и силы отталкивания. Силы притяжения имеют 1 природу, межмолекулярные Ван-дер-Вальсовы силы. Силы отталкивания зависят от природы стабилизатора. Теория ДЛФО- учитывает баланс сил притяжения и сил отталкивания. Рассматривает взаимодействие 2-х крупных частиц, для которых пренебрегаем тепловым движением, толщиной ДЭС. Общая энергия взаимодействия между 2-мя частицами: U=Uприт+Uотт/ силы притяжения действующие с дисперсной среде- дисперсионные силы притяжения, обусловлены квантовомеханическим эффектом. Особенностью дисперсионных сил является их дальнодействие обусловленное некоторыми причинами: 1)адитивностью 2)дисперсионные силы синхронны 3)характерен эффект электромагнитного запаздывания(электромагнитные волны>100нм не совпадают по фазе) Uпр(h)=-A/12πhn n=1-3 F 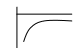 -const Гомакера, учитывает природу взаимодействия тел, выражается в 1 энергии А=f(n,h) -const Гомакера, учитывает природу взаимодействия тел, выражается в 1 энергии А=f(n,h)-для 2 пластин: Uприт(h)=А/12πh2; - для сферических частиц Uприт(h)=Аr/12h Силы отталкивания- учитывают электростатические факторы устойчивости h Происходит при перекрывании двух ДЭС. Ели расстояние между частицами велико, то φ падает до 0, если частицы перекрываются то φ не падает до 0 Uпр  Uотт Uотт(h)=Kφe-каппа h Uотт 1 преобладание силы притяжения Uотт Uотт(h)=Kφe-каппа h Uотт 1 преобладание силы притяжения1 2 быстрая коагуляция 2 3 3 медленная коагуляция h 88. Зависимость скорости коагуляции от концентрации электролита, быстрая и медленная коагуляция. Различают явную и скрытую коагуляцию. Быстрая коагуляция- коагуляция которая не зависит от электролитов. Медленная коагуляция- только наиболее вероятное слипание частиц приводит к коагуляции. Uк  Uотт 1- преобладают силы притяжения(10нм) h→0. быстрая Uотт 1- преобладают силы притяжения(10нм) h→0. быстрая 1 коагуляция(необратимая)образуется с контактом фаз 2 3 2-максимальные силы отталкивания h(10-100нм) 3 h>100нм, преобладают силы Uпр притяжения(обратимая коагуляция) См сб сэл-та 89. Кривые потенциальной энергии для систем с различной степенью агрегативной устойчивости. U 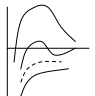 отт 1 Umax- вероятность слипания частиц отт 1 Umax- вероятность слипания частиц1) Umax>>KT KT-энергия теплового движения 2) Umax< ε=число слипаний/число столкновений=1 3 h 3) Umax≈KT -медленная коагуляция 4) Umax=Uприт -порог роагуляции 4 2 90. Кинетика коагуляции по Смолуховскому. Вывод уравнения для концентрации частиц через время коагуляции τ. Константы скорости быстрой и медленной коагуляции. - рассматривает кинетическую коагуляцию для дисперсного золя со сферическими частицами, сталкивающимися в результате броуновского движения. Критическое расстояние взаимодействия=∑ радиусов частиц/их непосредственный контакт. Коагуляция происходит только при взаимодействии 2-х частиц. Коагуляция происходит как бимолекулярная химическая реакция. -dυ∑/dτ=Kυ∑2; К=8ДπR интегрирует и разделим переменные 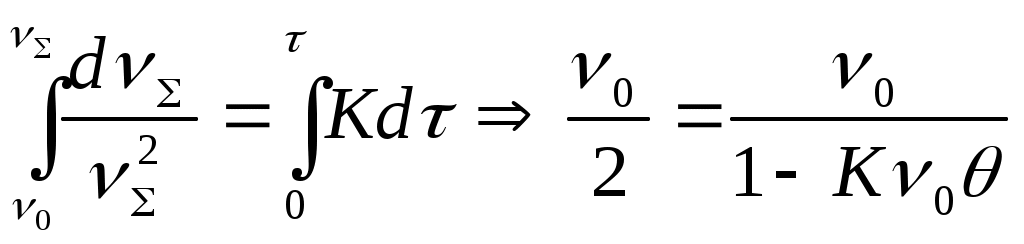 Θ  -время половинной коагуляции. -время половинной коагуляции. υ/ υ0 Кб-const быстрой коагуляции Кб=Кт=8πДR=8πКбТ2r/6πηr=8KбТ/3η. Для быстрой коагуляции ΔU=0 P=1. υ∑ Для медленной коагуляции ΔU≠0 Р≠0 Км=КбРexp(-ΔU/КбТ) 0,5 υ0 υ3 υ2 τ∕θ 91. Правила коагуляции электролитами с точки зрения строения ДЭС. 1)коагуляцию вызывают любые электролиты, даже избыток стабилизатора 2)наиболее сильным коагуляционным действием обладает ион, заряд которого одинаков с зарядом противоиона 3)коагуляция наступает не мгновенно, а при добавлении минимального количества электролита- порог коагуляции(8 моль/л) 4)порог коагуляции тем меньше чем больше валентность иона. Правило Шульце-Гарди: валентность 1,2,3 порог коагуляции 1,20,50. правило Дерягина-Ландау: γ=K/Zn n=6 1:64:729 1:2:3 5)порог коагуляции уменьшается с увеличением радиуса иона 6) коагуляция наступает при ζ=25 мВт 92. Концентрационная и нейтрализационная коагуляция. Нейтрализационная коагуляция характерна для систем с частицами, обладающими малым электрическим потенциалом. На нейтрализационной коагуляции особенно сказывается специфическая адсорбция ионов добавляемого электролита, имеющих заряд, одинаковый по знаку с зарядом противоионов двойного электрического слоя. Эти ионы находясь в адсорбционном слое, резко снижают потенциал φб- происходит нейтрализация φ0-потенциала уже в адсорбционном слое, так как при специфической адсорбции возможна перезарядка частиц, то для нейтрализационной коагуляции характерна область агрегативной неустойчивости между минимальной и максимальной концентрацией электролита. Приведении электролита в количестве, превышающем некоторое максимальное значение, дисперсная система может перейти во вторую область устойчивости, в которой частицы будут иметь заряд, противоположный заряду частиц в первой области устойчивости. Концентрационная коагуляция обусловлена сжатием ДЭС в результате увеличения ионной силы раствора. Этот вид коагуляции осуществляется при добавлении индеферентных электролитов, не способных к специфической адсорбции на поверхности коагулирующих частиц. Хотя при концентрационной коагуляции увеличивается количество противоионов в адсорбционном слое, однако эффект снижения потенциала в нем не является решающим. Преобладающее влияние ионной силы дисперсионной среды характерно для систем с высокозаряженными частицами. 93. Расклинивающее давление, его компоненты. -возникает при сильном уменьшении толщины пленки в результате перекрывания или взаимодействия поверхностных слоев. Пленка- тонкая часть системы находящаяся между 2 межфазными поверхностями. 1)Толстая пленка h=2δ=>P1=P0 h=поверхностный слой, Р0-давление в окр среде, Р1-межфазовае давление,δ- толщина слоя. π(h)=0- расклинивающее давление. 2) При сближении пластин до перекрывания поверхностных слоев образуется тонкая пленка h<2δ=> π(h )=P1-P0. Изменение dG если в системе есть расклинивающее давление: dG=-SdT(σ12+σ23)dS+∑μini+(дG/dh)dh; π(h)= P1-P0=-1/S(дG/dh)T, ni, S. π(h)- разность гидростатических давлений в пленке и окружающей пленку фазе, или приращение энергии Г. π(h)-является суммарным параметром, который учитывает как силы отталкивания, так и силы притяжения в дисперсионной среде. + силы отталкивания(молекулы втекают в прослойку); - силы притяжения(молекулы вытекают из прослойки). π(h) обусловлено различными компонентами: - Ван-дер-Вальсовы силы притяжения; + силы отталкивания(все факторы устойчивости) 94. Идеальные модели реологии. Модели Гука, Ньютона, Сен-Венана-Кулона. 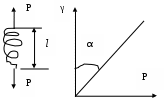 Идеально упругое тело Гука представляется Идеально упругое тело Гука представляетсяв виде пружины с модулем Е. Р=Еγ – деформация в пружине пропорциональна напряжению. Особенность: полная механическая и термодинамическая обратимость. tg α = Е – модуль упругости (Юнга) 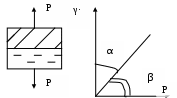 Идеально вязкое тело Ньютона: линейная зависимость между напряжением сдвига (Р) и скоростью деформации (γ). Перфорированный поршень в вязкой среде. Коэф-т пропорциональности называется вязкостью [Па · с] или [Н · с/м2]. Полностью механически и термодинамически необратимо. tg α = η – вязкость (сопротивление с-мы течению) β – текучесть с-мы (диссипативная система) 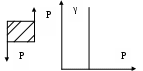 Идеально пластическое тело Сен-Венана-Кулона. Идеально пластическое тело Сен-Венана-Кулона. Отсутствует пропорциональность между воздействием и деформацией. Диссипативная с-ма, т.е. затраченная энергия переходит в теплоту. Р P>PT γ>0 γ>0 - деформация происходит беспредельно с любой скоростью. (РТ - предел текучести) 95. Принципы моделирования реологических свойств. Модель упругого тела Максвелла, Вывод уравнения, являющегося его математической моделью. При последовательном соединении элементов, напряжения (Р=Р1+Р2=…=Рn) будут равны, деформации и скорости деформации будут суммироваться. (γ= γ1+γ2+…+ γn ; γ= γ·1+ γ·2+…+ γ·n) При параллельном соединении элементов – напряжения будут суммироваться (Р=Р1+Р2+…+Рn), деформации и скорости деформации будут равны (γ= γ1=γ2=…= γn ; γ= γ·1= γ·2=…= γ·n) 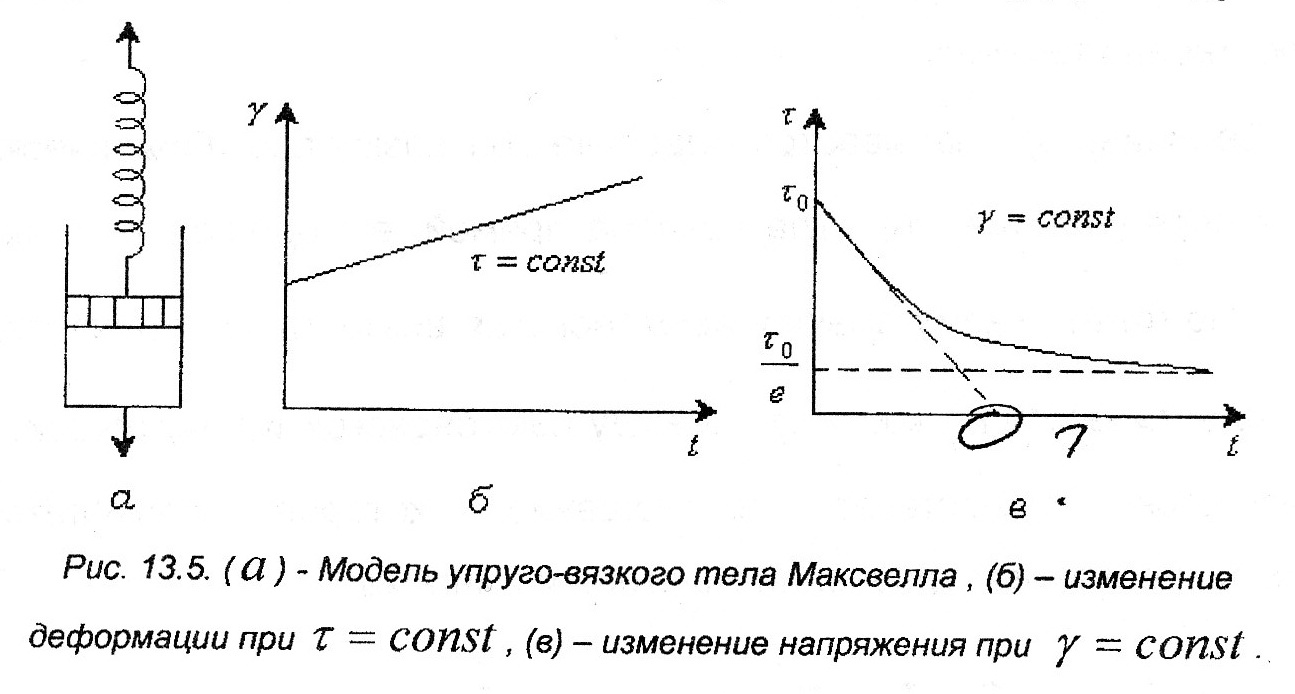 Модель упруго-вязкого тела Максвелла: Модель упруго-вязкого тела Максвелла:Жидкие и твердые тела – одинаковая сила сцепления. Максвеллом было дано представление, что механические свойства тел являются промежуточными между идеально жидкими и идеально твердыми телами. Последовательное соединение элементов Гука и Ньютона. Р=Рг=Рн γ= γг+ γн d γ/dτ = d γг/dτ = d γн/dτ γ = Р/Е + Рτ/η – деформация. Скорость деформации: d γ/dτ = 1/Е ·d l/dτ + Р/η 1/Е · dP/ dτ + Р/η = 0 dP/P=E/η · dτ; Интегрируем получаем: ln (P/P0)= – E/η · τ P=P0 · e-τ/λ – математическая модель Максвелла.,λ – время за которое напряжение в образце уменьшается в е раз. Характерна необратимая деформация тела.λ>>τ – релаксирует очень медленно (твердое тело), жидкое тело может вести себя как твердое.λ<<τ – тело ведет себя как жидкое, твердое тело может вести себя как жидкое. 96. Модель вязкопластического тела Бингама. Пластическая вязкость. Комбинация всех трех моделей реологии: 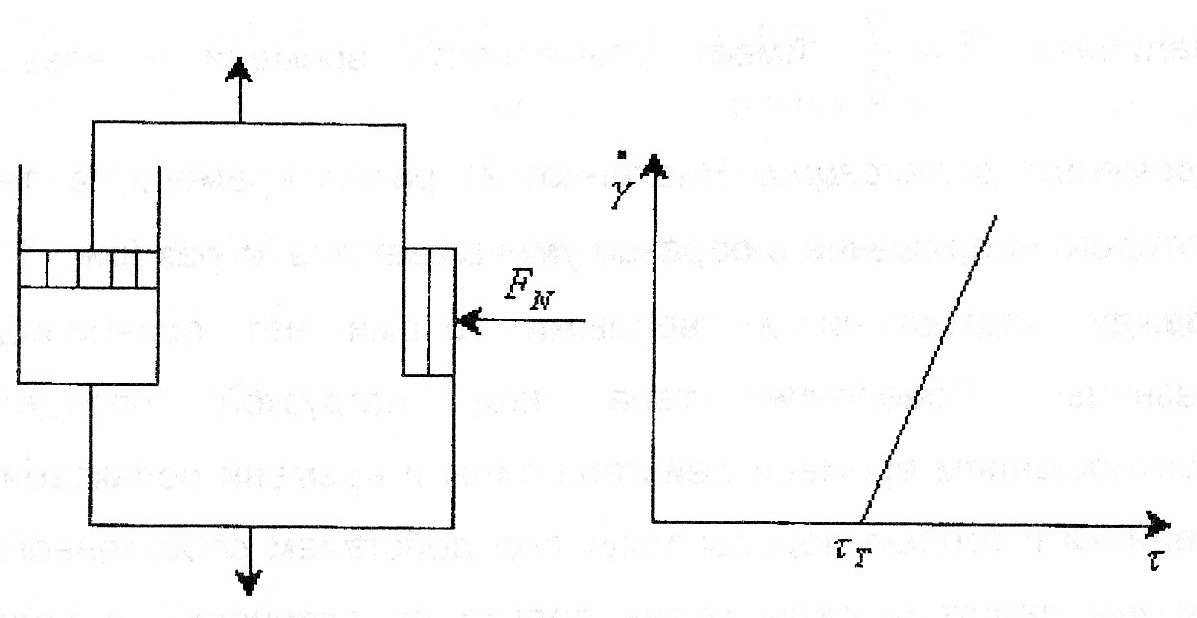 (напряжение) Р<РТ (предела текучести) – деформация не (напряжение) Р<РТ (предела текучести) – деформация не происходит в системе (теле) P>PT – течение в системе Р=РТ + η* · γ· – уравнение Бингама P P>PT γ↑ (скорость деформации) γ·↑ Р = η · γ· → η = Р/ γ·= (РТ + η* · γ·)/ γ· = η* + РТ/ γ· η – сопротивление течению всей системы; η*– течение и разрушение структуры 97. Причина неподчинения дисперсных систем закону Ньютона. Кривые течения реальных дисперсных систем. Уравнение Оствальда – Вейля. На основе реологических свойств, тела можно разделить на жидкообразные и твердообразные. Жидкообразные тела (РТ=0) можно разделить на: Ньютоновские – системы, вязкость которых не зависит от напряжения сдвига, являющегося константой. К Ньютоновским жидкостям относятся разбавленные системы с равноосными (симметричными) частицами. Неньютоновские – системы не подчиняющиеся закону Ньютона, вязкость зависит от напряжения сдвига; псевдопластические, дилантантные жидкости. Псевдопластические жидкости – суспензии, содержащие ассиметричные частицы, растворы полимеров. При увеличении напряжения сдвига, течение будет убыстряться. Дилантантные жидкости – дисперсные системы с большим содержанием твердой дисперсной фазы. При увеличении напряжения сдвига растет вязкость. Неньютоновские жидкости описываются уравнением Оствальда – Вейда: Р = k · γ· 1 – Ньютоновские жидкости 1 – бингамовское тело 2- псевдопластическое твердообразное тело 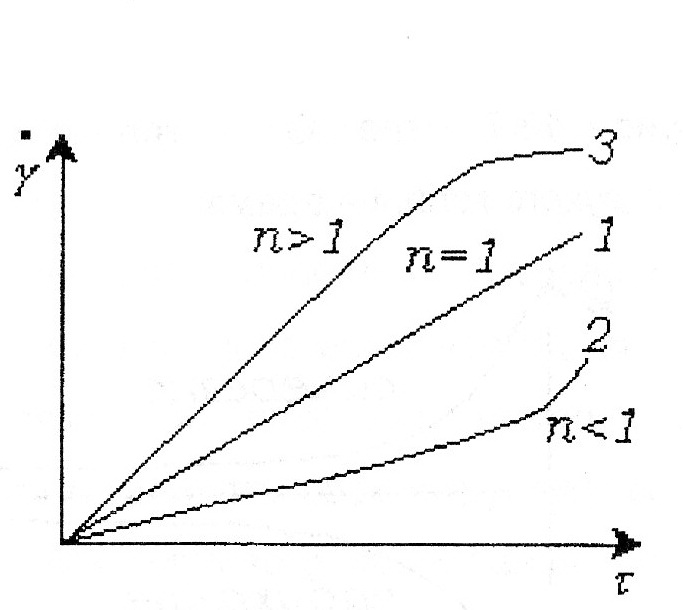 2 – Псевдопластические 2 – Псевдопластические 3 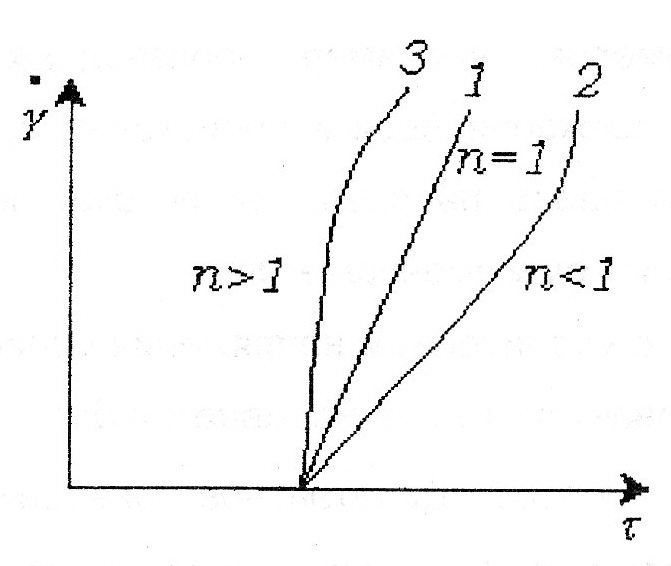 – пластическое дилантантное тело 3 – Дилантантные жидкости – пластическое дилантантное тело 3 – Дилантантные жидкости98. Вязкость жидкообразных агрегативно устойчивых дисперсных систем. Уравнение Эйнштейна. Причины неподчинения коллоидных систем уравнению Эйнштейна.  η Вязкость разбавленных систем описывается уравнением Эйнштейна: η = η0 (1+2,5φ) – для сферических частиц; η = η0 (1 – 2φ) – для несферических частиц, где η0 – вязкость растворителя, φ – объемная доля дисперсной фазы. Система не сжимаема. Отсутствует скольжение, отсутствует турбулентность, отсутствует взаимодействие между частицами ηотн = η / η0 = 1+2 φ; ηуд = ηотн – 1 = 2 φ 99. Зависимость вязкости дисперсных систем от напряжения сдвига. В  концентрированной суспензии, содержание дисперсной фазы в которой больше 7% имеется придел текучести. концентрированной суспензии, содержание дисперсной фазы в которой больше 7% имеется придел текучести.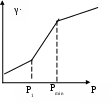 Pmin – минимальное напряжение η 1 – ηmax ньютоновская вязкость Pmin – минимальное напряжение η 1 – ηmax ньютоновская вязкостьтечения, полностью разрушается структура 2 – η* пластическая вязкость 3 – ηmin ньютоновская вязкость 100. Механизмы гибкости полимерной цепи: поворотно-изомерных и персистентный. Поворотно-изомерный механизм вытекает из возможности вращения вокруг простой связи.  При вращении атомов величина валентного угла = const=>C1-C2 При вращении атомов величина валентного угла = const=>C1-C2 связь может находится в пространстве независимо от Сn-Cn+1. Участок цепи который ведет себя как кинетическая отдельность и состоит из n атомов- статистический сегмент(сегмент Куна). Так же используется кинетический сегмент величина которого зависит от действия внешних сил. Термодинамический сегмент- сегмент размер которого равен р  азмеру молекулы растворителя. Персистентный механизм гибкости характерен для макромолекул состоящий из 2-х переплетенных цепей (ДНК). Форма изменяется только по средствам изменения валентного угла. Гибкость располагается равномерно, макромолекула упругая червеобразная нить- персистентная цепь. Количественные характеристики гибкости: 1)при поворотно-изомерном механизме- длинна сегмента А. если длинна сегмента = длине связи, то это свободносочлененная цепь 2)Сα=ħ2/hcc2. Геометрические характеристики гибкости: 1)среднеквадратичное расстояние между концами цепи азмеру молекулы растворителя. Персистентный механизм гибкости характерен для макромолекул состоящий из 2-х переплетенных цепей (ДНК). Форма изменяется только по средствам изменения валентного угла. Гибкость располагается равномерно, макромолекула упругая червеобразная нить- персистентная цепь. Количественные характеристики гибкости: 1)при поворотно-изомерном механизме- длинна сегмента А. если длинна сегмента = длине связи, то это свободносочлененная цепь 2)Сα=ħ2/hcc2. Геометрические характеристики гибкости: 1)среднеквадратичное расстояние между концами цепи 2)радиус инерции N- количество сегментов. При персистентном механизме гибкость характеризуется длинной цепи(l). Cosθ(S)=c-s/l |
