1. Предмет, задачи и основные разделы токсик химии. Токсикологическая химия
 Скачать 1.42 Mb. Скачать 1.42 Mb.
|
|
Токсикологическое значение: Стимулирует α- и β-адренорецепторы: сужение сосудов, повышение артериального давления, расширение бронхов, зрачков, торможение перистальтики кишечника. Применяют при бронхиальной астме, крапивнице, ринитах. Эфедрин быстро всасывается и накапливается в печени, почках, легких, мозге. Выводится с мочой через 24 часа около 80% введенной дозы. Главный путь метаболизма – N- деметилирование с образованием фенилпропаноламина. 55. Производные пиперидина (промедол). Токсик. значение, изолирование, анализ. Промедол 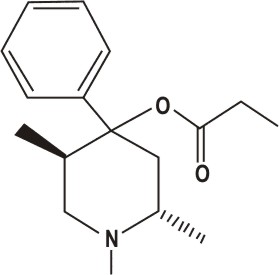 (рК вн + = 9) Изолирование из тканей органов проводят подкисленной водой или подкисленным спиртом, экстрагируют хлороформом из растворов с рН 7 – 9. Промедол частично экстрагируется хлороформом и из кислых растворов. Качественные реакции: 1). С общеалкалоидными реактивами; 2). С реактивом Марки (H2SO4 конц. с формалином): хлороформ. вытяжка из щелоч. среды выпаривают + реактив - пурпурно-красное окрашивание. 3). МКС – реакция с ализариновым красным (желтые игольчатые кристаллы). Токсикологическое значение: Сильный анальгетик, быстро всасывается. Действие наступает через 10 – 20 мин после подкожного введения, продолжается 3 – 4 часа. При длительном применении развивается болезненное пристрастие. Основные пути метаболизма: 1) N- деметилирование, образование N- глюкуронида; 2) разрушение эфирной связи и образование O-глюкуронида. 56. Производные фенотиазина (аминазин, дипразин, левомепромазин, тиоридазин). Токсикологическое значение, изолирование, анализ. Изолирование: Метод Стаса-Отто, модифицированный Соломатиным. Извлекатель – этанол, подкисленный щавелевой кислотой. Вытяжку упаривают. Очистка от белков – 96% этанолом, от липофильных в-в – экстракцией эфиром. Фильтруют. Упаривают. Растворяют в воде, + щавелев. к-ту до рН 2-3, + эфир. Далее + NaOH до рН 13, экстрагируют эфиром. Реэкстрагируют H2SO4. t – для удаления эфира. Аминазин (Хлорпромазин) 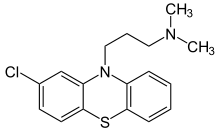 Качественные реакции: 1. С реактивом Марки (H2SO4 конц. с формалином): хлороформ. вытяжка из щелоч. среды выпаривают + реактив - бледно-пурпурное окрашивание. 2.С конц. HNO 3 - фиолетовое, переходящее в пурпурное и в красное окрашивание. 3.С 2% раствором FeCl3 - малиновое окрашивание. 4.Реакция Витали-Морена: р-р исслед. в-ва t, к сухому остатку + HNO3, t – желтый остаток + ацетон (с одной стороны) и 10% р-р NaOH в этаноле - пурпурное с фиолетовым оттенком окрашивание. 5. С реактивом Манделина (ванадат аммония и H2SO4 конц.) - темно-пурпурное, быстро исчезающее окрашивание. Дипразин (Пипольфен) 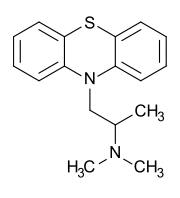 Качественные реакции: 1. С реактивом Марки; 2. С конц. HNO 3 - красно-желтое окрашивание; 3. С 2% раствором FeCl 3 - грязно-сиреневое окрашивание; 4. Реакция Витали-Морена; 5. С реактивом Манделина - темно-пурпурное окрашивание. Левомепромазин (Тизерцин) 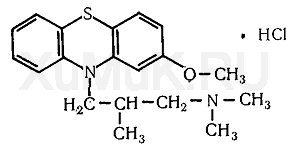 Качественные реакции: 1. С конц. H2SO4 - фиолетовое или розово-фиолетовое окрашивание; 2. С HClO 4 и NaNO 2 - фиолетовое окрашивание; 3. С H 2 PtCl 6 - ярко-зеленое окрашивание; 4. С 2% раствором FeCl 3 - розово-фиолетовое окрашивание; 5. С реактивом Марки - фиолетовое или розово-фиолетовое окрашивание; 6. Реакция Витали-Морена - красно-оранжевое. Тиоридазин (Сонапакс) 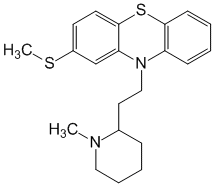 Качественные реакции: С конц. H2SO4 - голубое окрашивание; 2. С HClO4 и NaNO2 - зелено-голубое окрашивание; 3. С реактивом Марки - окрашивание цвета морской волны; 4. С H2PtCl6 бледно-сиреневое окрашивание; 5.С 2% раствором FeCl3 - голубовато-зеленое окрашивание; 6. Реакция Витали-Морена - пурпурное окрашивание; Токсикологическое значение: психотропные средства, проявляют токсическое действие. Введение в дозах, превышающих терапевтические приводит к летальным исходам. 60. Едкие щелочи, аммиак. Токсикологическое значение, изолирование, анализ. Определение рН проводят следующим образом: к водной вытяжке прибавляют несколько капель 5%-ного раствора хлорида бария и 2-3 капли спиртового раствора фенолфталеина. Если в вытяжке были карбонаты щелочных металлов, то выделяется белый осадок карбоната бария и исчезает розовая окраска раствора: если в вытяжке были только щелочи – то осадка нет, а розовая окраска сохраняется. При наличии щелочей и карбонатов – выпадает осадок и сохраняется розовая окраска. Изолирование щелочей: биоматериал измельчают, заливают дистиллированной водой и настаивают 2-3 часа, фильтруют. Если появляется розовая окраска при добавлении фенолфталеина, то проделывают реакции на ионы калия, натрия и аммония. Гидроксид калия. В качестве реактивов на катион калия применяют гидротартрат натрия NaHC4H4O6 и гексанитрокобальтат (III) натрия Na3Co(NO2)6. Реакции проводят в нейтральных или слабокислых растворах, поэтому водную щелочную вытяжку доводят до рН 3-4 раствором уксусной кислоты. K+ + HC4H4O6 - = KHC4H4O6↓бел. крист. мешают ионы NH4+ К+ + Na+ +[Co(NO2)6]3- = K2Na[Co(NO2)6]↓;желт. крист. Гидроксид натрия. 1. Гексагидроксоантимонат (V) калия, KSb(OH)6 Na+ + K[Sb(OH)6] = Na[Sb(OH)6]↓ 2. Цинкуранилацетат: Na+ + Zn(UO2)3(CH3COO)8 + CH3COOH + 9H2O = = NaZn(UO2)3(CH3COO)9 9H2O зел-жел осадок Аммиак При гниении органов трупов образуется аммиак, H2S.тПоэтому сначала исследуют на H2S. При обнаружении Н2S – исследование на аммиак не проводят. Обнаружение H2S: к вытяжке или диализату прибавляют HCl и закрывают пробкой, к которой прикреплена бумажка, смоченная раствором Pb(CH3СOO)2: Pb2+ + S2-= PbS↓(черн.) Обнаружение NH3: 1) закрывают пробирку с диализатом пробкой, к которой снизу прикреплены 2 бумажки (влажная лакмусовая и смоченная сульфатом меди). Нагревают, наблюдают посинение как первой, так и второй бумаг (образуется [Cu (NH3)4 ]SO4); 2) реактив Несслера: NH4++ 2[HgI4]2-+4OH-== [OНg2NH2]I +7I- + 3H2O 61. Фториды и кремнефториды. Изолирование, анализ, токсикологическое значение. Соли фтороводородной кислоты. NaF, CaF. Изолирование: объекты исследования подщелачивают едкой известью Ca(OH)2 или NaOH, высушивают, сжигают и прокаливают. Золу исслед. на наличие фтора. Обнаружение. 1. Образование летучего фтороводорода. К золе в тигле + H2SO4 конц и закрывают стеклом, нижняя поверхность которого покрыта воском. Часть воска удаляют, делая «надпись». Через сутки получают «выжженную» надпись на стекле. 2. К золе + песок и конц H2SO4. В отверстии пробирки держат стеклянную палочку с водой. При наличии фтора вода мутнеет. CaF2 + H2SO4= CaSO4 +2 HF 4 HF + SiO2 = SiF4↑ + 2 H2O 3SiF4+ 3 H2O = H2SiO3 + 2 H2SiF6 3. На бумагу, пропитанную цирконий-ализариновым лаком, несколько капель исслед. раствора – красная окраска меняется на желтую (высвобождается свободный ализарин). Токсикологическое значение: фториды – консерванты древесины, инсектициды, средства для дератизации. Могут смешиваться с хлоридом натрия – смертельный исход. Количественное определение. Фотометрическим методом по уменьшению оптической плотности роданида железа (III) с увеличением количества фторида. Кремнефториды. Токсическое значение – натриевая соль кремнефтороводородной к-ты (Na2SiF6) – для борьбы с домашними насекомыми. Сухие кремнефториды при нагревании разлагаются: Na2SiF6 → 2 NaF + SiF4 Обнаружение: основано на способности разлагаться до летучих продуктов с последующей их идентификацией: 1) при добавлении хлорида бария к раствору – кристаллический осадок BaCl2 + Na2SiF6 = BaSiF6↓ + 2NaCl 2) осадок BaSiF6 в платиновый тигель + конц H2SO4. Выделяется фтороводород – реакция травления стекла, - и тетрафторид кремния (помутнение капли воды). BaSiF6 + H2SO4 = 2 HF↑ + SiF4 + BaSO4↓. 62. Пестициды. Общая характеристика, классификация. Правила работы и техника безопасности. Пестициды - группа различных по химической природе веществ, предназначенных для уничтожения или предотвращения развития организмов, приносящих вред сельскохозяйственным культурам, домашним животным и человеку. Классификация по хим. структуре: пестициды делятся на неорганические и органические. К органическим отн. синтетические пиретроиды, ХОС, азотсодержащие соединения: гетероциклические и ациклические, ФОС, арилоксиалкил-карбоновые кислоты. К гетероциклическим отн. симм-триазины, триазолы, бензимидазолы. К ациклич. отн. карбаматы, производные мочевины и тиомочевины, производные анилина. К ФОС отн. производные фосфорной к-ты, производные тио- и дитиофосфорной к-ты, производные фосфоновой к-ты. х веществ, подлежащих судебно-химическому исследованию». Классификация по применению: 1. Зооциды – используются для уничтожения теплокровных вредителей; 2. Инсектициды – для уничтожения насекомых; 3. Акарициды – для уничтожения клещей; Гигиеническая классификация в основе которой положено значение LD50 Особотоксичные (LD50 - менее 50 мг/кг), высокотоксичные (50-200 мг/кг), среднетоксичные (200-1000 мг/кг), малотоксичные (более 1000 мг/кг). В основу другой токсикологической классификации положена летальная доза препарата (в расчете на 70 кг массы человека): нетоксичные ( LD более 1000 г), слаботоксичные (500-1000г), среднетоксичные (28-500 г), очень токсичные (4-28г), чрезвычайно токсичные (0,5-4 г), супертоксичные (менее 0,5 г) Основными объектами судебно-химического исследования при отравлении ядохимикатами являются биологические (биожидкости и органы трупа), технические жидкости, а также пищевые продукты, образцы почвы и воды, растительного материала. При острых отравлениях - это моча, кровь, рвотные массы, промывные воды желудка. Высокая липофильность некоторых групп пестицидов (ХОС, ПХБ и др.) обусловливает накопление данных веществ в жировой ткани, а также, что наиболее опасно, в грудном молоке кормящих женщин. Эти объекты могут быть исследованы при хронических отравлениях. Во время работы с пестицидами необходимо:1. защищать рот и нос респираторами 2. при работе с пестицидами не разрешается курить, есть и пить;3. после работы следует хорошо вымыть с мылом лицо и руки и прополоскать рот. Хранить препараты необходимо в шкафах или в помещениях, запирающихся на замок, в хорошо закрытой таре, с указанием названия. Нельзя использовать для других целей посуду и инвентарь, в которых готовят растворы и смеси пестицидов. Не допускается использование препаратов, не имеющих четкой заводской маркировки. 66. Производные карбаминовой кислоты (севин). Токсикологическое значение. Производное карбаминовой кислоты имеющее токсическое действие севин (карбарил). 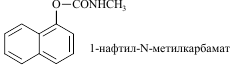 ; ;  Cевин – белое кристаллическое вещество, мало растворяется в воде, хорошо раств-ся в хлороформе, бензоле. В щелочной и кислой средах разлагается. Севин быстро всасывается из желудка и через 30 мин отмечается макс накопление в органах. Севин инактивирует ацетилхолинэстеразу. Изолирование севина и его основного метаболита (альфа-нафтол) из биоматериала проводят экстракцией бензолом, диэтиловым эфиром и др. орг растворителями. Способы качественного определения севина. 1. Холинэстеразная проба. 2. МКС–реакции: с пикриновой кислотой-желт кристаллы, с HgCl2-бесцв кристаллы. 3. Реакции окрашивания (после гидролиза севина до альфа - нафтола): с CuCl2 и NaBr – красно-фиолет окраш; с NaNo2 в слабокислой среде – желт окраш; с FeCl3 – роз окраска. 4. ТСХ (подвижная фаза - хлороформ, облучение пластинки УФ-светом, опрыскивание р-ом диазотированной сульфаниловой кислоты – красная окраска). Количественное определение севина проводят методом ГЖХ, фотометрическим методом, основанным на образовании окрашенных соединений с CuCl2 (II) и NaBr или получение азокрасителя. Метаболизм. Основные пути метаболизма – окисление, гидролиз, образование коньюгатов (глюкурониды, сульфаты). За сутки выводится с мочой около 80% севина в виде основного метаболита – глюкуронида альфа-нафтола. 68. ТСХ-скрининг лекарственных соединений: схема анализа веществ кислотного характера. При ТСХ-скрининг поэтапное исследование токсикологических соединений: на первом этапе скрининг в общих системах растворителей (принадлежность к классу соединений), при положительном результате – исследование элюатов в частной системе растворителей. Метод имеет отрицательное судебно-химическое значение. В общих с-мах. Подвижная фаза – ацетон: хлороформ (1:9). Неподвижная – силикагель. Пластину делим на 4 вертикальн. зоны (А,Б,В,Г). А – ра-ры метчиков (амидопирин, барабмил); Б – 1/25 кислотного извлечения (для качественного анализа); В – стандарт (циклобарбитал) для расчета Rf; Г – 1/10 кислотного извлечения (потом идет в частные с-мы). По значению Rf (путь, который прошло вещ-во на пластинке) делят на 3 горизонт. зоны: - Rf = 0-0,25 (амидопирин, кофеин); - Rf = 0,31-0,41 (фенобарбитал, барбитал, нитразепам, этаминалнатрий); - Rf = 0,41-0,64 (диазепам). Обнаружение – путем последоват. обработки слоя сорбента зон А,Б,В (при закрытом Г) реактивами: 1) 0,1% ра-р дифенилкарбазола в CHCl3 и 5% ра-р HgSO4 (произв. барбитуровой к-ты; красно-фиолетовые пятна); 2) 10% FeCl3 (антипирин – красно-оранжевое окрашивание; амидопирин – сине-фиолетовое); 3) реактив Драгендорфа по Мунье и 10% H2SO4 (антипирин, амидопирин – оранжевое; кофеин – оранжево-коричневое; нитрозепам, диазепам – оранжево-желтое). Слой сорбента из Г (распложен параллельно пятну в зоне Б) снимают и экстрагируют метанолом (зона ) или ацетоном (зона , ). Экстракты хроматографируют в частных с-мах растворителей). В частных с-мах. Пластину на 3 вертик. зоны: зоны А,Б – метчики (вещества, входящие в исследуемую зону) Один метчик – циклобарбитал. Зона В – элюат из зоны Г в общих с-мах. Соединения I зоны: подвижная фаза – ацетон: циклогексан (5:1), сорбент –окись алюминия, реагенты – 10% ра-р FeCl3 на антипирин и амидопирин, ра-р I2 и 25% ра-р НСl на кофеин (красно-коричневая окраска).Соединения II зоны: подвижная фаза – хлороформ: н-бутанол: 25% NН4ОН (70:40:5), сорбент – силикагель; реагенты – 0,1 % ра-р дифенилкарбазола и 5% ра-р HgSO4 – на барбитураты. Сединения III зоны: подвижная фаза – этилацетат: бензол: этанол: ра-р NН4ОН (95:15:5:2,5), сорбент – силикагель; реагент – реактив Драгендорфа. Рассчитывают Rf. 69. Схема анализа веществ основного характера с использованием ТСХ-скрининга. При ТСХ-скрининг поэтапное исследование токсикологических соединений: на первом этапе скрининг в общих системах растворителей (принадлежность к классу растворителей), при положительном результате – исследование элюатов в частной системе растворителей. Метод имеет отрицательное судебно-химическое значение. В общих системах. Подвижная фаза – хлороформ: диоксан: ацетон: аммиак (45:47,5: 5:2,5), неподвижная – силикагель. Пластинку делят на 4 вертик. зоны: зона А – метчики (атропин, кокаин), зона Б – 1/25 выделенного экстракта (исследуемого), зона В – стандарт (этаперазин); зона Г – 1/10 выделенного экстракта. По Rf (пути, пройденного на пластинке) делят на 4 горизонт. зоны: I зона – Rf = 0,12-0,36 (морфин, атропин, эфедрин); II – Rf= 0,5-0,58 (этаперазин, антипирин); III – Rf = 0,63-0,83 (аминазин, промедол, нитрозепам); IV – Rf= 0,87-0,98 ( папаверин, диазепам, кокаин). Реагенты (для А,Б,В): 10% FeCl3 (произв. пиразолона, фенотиазина); конц. HClO4 + 3-5% ра-р NaNO2 (фенотиазины); 10% ра-р H2SO4 + УФ (хинин); реактив Драгендорфа (соединения с третичным атомом N). Слой сорбента из Г снимают и экстрагируют смесью метанол – диэтиламин = 9:1 ( зона I), смесью метанол: 25% ра-р NH4OH=9:1 (для II-IV). Далее в частных с-мах. Пластину на 3 вертик. зоны: зоны А,Б – метчики (вещества, входящие в исследуемую зону) Зона В – элюат из зоны Г в общих с-мах. Сорбент для I зоны – силикагель, для II, III, IV – окись алюминия. Соединения I зоны: подвижная фаза – хлороформ:диэтиламин (9:1); реагенты – реактив Драгендорфа по Мунье (вещ-ва с третичным атомом азота), реактив Марки (производные фенантренизохиналина), 10% H2SO4+ УФ (хинин). Соединения II зоны: подвижная фаза – ацетон-хлороформ (1:5); реагенты – конц. HClO4+ NaNO2 (этапиразин; розовая окраска), 10% ра-р FeCl3 (антипирин; оранжево-коричневая окраска). Соединения III зоны: подвижная фаза – хлороформ-этанол (20:1); реагенты - 10% ра-р FeCl3 ( амидопирин; фиолетовая окраска), конц. HClO4 + 3-5% ра-р NaNO2 (дипразин, аминозин, розовое окрашивание), реактив Марки (промедол; розовое окрашивание). Соединения IV зоны: подвижная фаза – циклогексан-ацетон (5:1); реагенты - конц. HClO4 + 3-5% ра-р NaNO2 (левомепромозин ;фиолетовое окрашивание), реактив Марки (папаверин - розовое окрашивание), реактив Драгендорфа (диазепам - желто-оранжевое окрашивание; кокаин – коричневое). ТСХ-скрининг плохо подходит для исследования гнилостного материала, т.к. экстрагируется много эндогенных амидов, пептидов и др. |
