1. Предмет, задачи и основные разделы токсик химии. Токсикологическая химия
 Скачать 1.42 Mb. Скачать 1.42 Mb.
|
|
31. Систематический метод анализа минерализата. Систематический метод основан на разделении катионов металлов на 5 аналитических групп (сульфидная классификация): 2 группа - Ba2+ (реагент карбонат аммония, рН 8-9); 3 группа - Mn2+, Cr3+, Zn2+ (реагент сульфид аммония, рН 8-9); 4 и 5 группы - Cu2+, Cd2+, Ag+, Bi3+, Hg2+, Pb2+, Hg22+, As3+, Sb3+, Sn2+ (реагент сероводород). Осадок сульфидов катионов 4 и 5 групп обрабатывают полисульфидом аммония, при этом осадки сульфидов As3+, Sb3+, Sn2+ растворяются с образованием тиосолей. Метод имеет недостатки: а) длительный; б) применяется ядовитый се-роводород; в) невозможно совместить качественный и количественный анализ. В наст. время этот метод не прим-ся и рассм-ся как предшественник современных методов анализа минерализата. 32. Дробный метод анализа минерализата. Дробный метод анализа, разработанный А.Н.Крыловой проводится по определенной схеме и с применением маскирующих в-в. Дробный анализ на катионы можно проводить в любой последовательности, но необходимо учитывать специфичность отдельных реакций. Схема: 1. Минерализат фильтруют по итогу получая осадок (BaSO4; PbSO4; СaSO4) и фильтрат (As3+, Bi3+, Zn2+, Cr3+, Mn2+, Ag+, Cu2+,Sb3+ , Tl3+) 2. Осадок обрабатывают горячим р-ром СН3СООNH4, подкисленной уксусной кислоты. Если у нас осадок BaSO4 , то: 1) реакция перекристаллизации из H2SO4 конц.; 2) BaSO4→BaS→Ba2+ и далее рекация с КIO3. Если р-р Pb2+, то существует 2 варианта: - если осадка растворилось мало: 1)реакция с дитизоном и далее реэкстракция ионов Pb раствором HNO3; 2) реакция с KNO2 b Cu(OAc)2 ; 3) реакция с СsCl и KI; - если осадка растворилось много: 1) р-ция с дитизоном; 2) р-ция K2Cr2O7; 3) р-ция c H2SO4 3. Фильтрат: - Mn2+ : 1) KIO4; 2) (NH4)2S2O8; - Cr3+: окисление до Cr6+, а после 1) дифенилкарбазид; 2) образование надхромовых кислот. - Ag+ : 1) дитизон (чтобы отличить дитизонат Ag от дитизоната Hg хлороформный слой обрабатывают 0,5 М HCl. При положительной результате Ag+ удаляют из минерализата в виде AgCl; 2) AgCl растворяют в р-ре NH3 и проводят р-ции с тиомочевиной и пикриновой к-той. - Sb3+: 1) малахитовый зеленый !!!/ Sb3+ окисляют до Sb5+/; 2) тиосульфат Na - As3+ : 1) р-ция Зангер-Блека; 2) р-ция Марша Дробный анализ на катионы можно проводить в любой послед-ти, но необходимо учит-ть специфичность отдельных реакций. Н-р, чувств-ть р-ций на Cr и Mn↓ при большом кол-ве хлоридов. Поэтому иссл-ние на Mn и Cr ведется раньше, чем на Ag, для выделения кот. используется HCl. Р-ции перекристаллизации BaSO4 мешает PbSO4. Поэтому вначале ведут исследование на наличие катионов Pb, а затем определяют катионы Ba. Обнаружение сурьмы по реакции образования Sb2S3 или Sb2S5 (оранжевая окраска) мешает наличие Cu2+, ибо CuS имеет черную окраску, которая маскирует оранжевую Sb2S3. Поэтому вначале определяют Cu2+. Sb, в свою очередь, мешает открытию As, т.к. она дает летучий SbH3, мешающий открытию AsH3. Затем определяют As, Bi, Zn, Cd. Дробный метод анализа проводят с использованием специфических р-ций. Если нет специфических р-ций, то тогда маскируют посторонние ионы. 33. Применение органических реагентов для обнаружения и количественного определения «металлических» ядов. Дитизон: 1. Ртуть: с дитизоном - желто-оранжевое окрашивание, для маскировки других катионов применяют аскорбиновую кислоту, гидроксиламин – качеств. и количеств. опр-ние. 2. Серебро: реакция образования дитизоната серебра 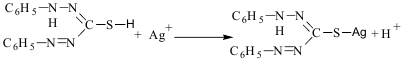 Фотометрия дитизоната серебра. 3. Цинк: с дитизоном (образуется красный комплекс). 4. Таллий: с дитизоном при рН 11-12. Набл-ся розовая окраска хлороформного слоя. В щелоч. среде в присут. KCN р-ция явл-ся специфичной. 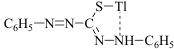
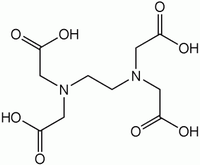
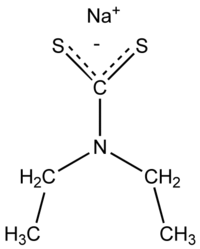
Трилон Б: 1. Ртуть: комплексон. определение: трилон Б, индикатор - эриохром черный. 2. Барий: титриметр. метод. Исп-ся обратное комплексон. титрование избытка трилона Б р-ром хлорида цинка в присут. эриохрома черного Т. 3. Висмут: титрование трилоном Б в присутствии тиомочевины. 4. Цинк: количеств.: выделяют с ДДТК при рН=8, реэкстракция в водный слой и титрование трилоном Б (индикатор - эриохром черный). Дифенилкарбазид: 1. Хром: качеств. дихромат-ионы взаим-т с дифенилкарбазидом. ДФК окисляется до дифенилкарбазона, затем – дифенилкарбадиазон. Количеств. опред.: фотометрия окраш. соединения с дифенилкарбазидом. Диэтилдитиокарбаминат свинца 1. Медь: качеств. фильтрат, нейтр-т его аммиаком до рН 3 по универс. индикатору и встрях-т с 5 мл хлороформного р-ра диэтилдитиокарбамината (ДДТК) свинца. Окраска хлороформного слоя изменяется от желтого до коричневого цвета. 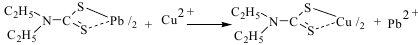 Количеств.в виде Cu(ДДТК)2 и др. окрашенных соединений. 2. Серебро: с диэтилдитиокарбаминатом серебра в пиридине наблюдается красно-фиолетовая окраска, при наличии сурьмы - оранжево-красная. 3. Сурьма: при наличии сурьмы - оранжево-красная. Пиридин-роданидный реактив: 1. Медь: с пиридин-роданидным реактивом → изумрудно-зеленый (в хлороформе) [Cu(SCN)4]2-+PyH+→[Cu(SCN)4]2-(PyH+)2 Малахитовый зеленый 1. Сурьма: ассоциат металлогалогенидного комплекса и красителя окрашен в голубой или синий цвет и хорошо экстрагируется толуолом, бензолом.  Количеств. определение: основано на фотометрическом определении c малахитовым или бриллиантовым зеленым. 2. Таллий: с малахитовым (бриллиантовым) зеленым, слой толуола приобретает голубую или синюю окраску. 8-оксихинолин
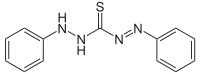
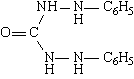
Тиомочевина
34. Методы изолирования, обнаружения и количесвенного определения ртути, этилмеркурхлорида, свинца, бария, хрома, марганца, серебра, меди, сурьмы, мышьяка, висмута, кадмия, цинка, таллия, ТЭС. Токсикологическое значение препаратов. Ртуть.Минерализацию проводят частными методами. Для уменьшения потери Hg проводят частичное разрушение органических веществ (деструкция): 100°, водяная баня, время - 10-15 минут. Биоматериал нагревают со смесью серной и азотной кислот до разрушения форменных элементов органов и тканей, добавляют этиловый спирт (катализатор). В деструктате ртуть определяют: 1). С дитизоном - желто-оранжевое окрашивание, для маскировки других катионов применяют аскорбиновую кислоту, гидроксиламин. 2). Со взвесью иодида меди (I): Hg2+ + 4CuI → Cu2[HgI4]↓ +2Cu. красный Эта реакция может применяться для колич. фотометрического определения Hg. Более точный метод - экстракционно-фотометрический метод определения Hg с дитизоном. Токсикологическое значение: Hg применяется в производстве люминесцентных, кварцевых ламп; в медицине - Hg2Cl2, HgCl2, HgO и др. При отравлении - металлический привкус во рту, боли в желудке, рвота. Как противоядие - унитиол. Ртуть откладывается в печени и почках. Выводится с мочой и калом. Свинец. После минерализации смесью серной и азотной кислот осадок (BaSO4 и PbSO4) обрабатывают горячим раствором ацетата аммония (PbSO4 растворяется). Затем ход анализа зависит от величины осадков. Исследование больших количеств PbSO4: Проводят реакции : 1) с KI (PbI 2 - желтый осадок, растворяется при нагревании, а затем опять выпадает); 2) с K 2 CrO 4 (оранжево-желтый осадок PbCrO 4 ); 3) с сероводородной водой (черный осадок PbS); 4) с H 2 SO 4 (белый осадок PbSO 4 ). Исследование малых количеств PbSO4:К раствору ацетата свинца прибавляют хлороформный раствор ДФТК, наблюдается появление оранжево-красной окраски дитизоната свинца. Дитизон взаимодействует с катионами через атом серы, т.к. метилдитизон не взаимодействует с катионами металлов. Дитизонат свинца разлагают HNO3 и в водной фазе определяют ионы Pb следующими реакциями: 1) с CsCl и KI: CsCl + KI + Pb 2+ → Сs[PbI 3 ]-;желто-зеленые игольчатые кристаллы; 2) микрокристаллоскопия после реакции с ацетатом меди и нитритом калия, образуются черные кубики K 2 Pb[Cu(NO 2 ) 6 ]; 3) с KI; 4) с K2CrO4 ; 5) с H2S; 6) с H2SO4 . Токсичность соединений свинца: PbCl2 , Pb(NO3) 2 , PbCrO4 , Pb(СH3COO)2 , PbCO3 (входит в белила), PbO (в состав красок). Ионы Pb взаимодействуют с ферментами, тормозят синтез порфирина, нарушается функция центральной и периферической нервной системы. Выводится с калом, меньше с желчью и мочой. Соединения Pb откладываются (частично) в костной ткани в виде трехзамещенного фосфата. Количественное определение: 1.Дитизонатный метод. 2.Хромато-иодометрический метод. При значительных количествах свинца в объекте исследования используют объемный метод определения: осаждение Pb2+ титрованным раствором K 2 Cr 2 O 7 в виде PbCrO 4 c последующим иодометрическим определением избытка K 2 Cr 2 O 7 . 3. Комплексонометрическое определение: трилон Б, индикатор - эриохром черный. Барий. Осадок, оставшийся на фильтре после обработки его горячим раствором ацетата аммония, исследуют на наличие BaSO4: 1) реакция перекристаллизации BaSO4 (часть остатка переносят на предметное стекло и прибавляют 1-2 капли H2SO4(конц.), нагревают на пламени горелки до появления белых паров. При охлаждении образуются кристаллы в виде пластинок и сростков из них в виде косых крестов); 2) реакция восстановления BaSO4 (крупинку BaSO4 нагревают на платиновой проволоке в пламени горелки. При этом BaSO4 восстанавливается до BaS. Смачивают осадок в капле HCl на предметном стекле и снова нагревают (так 2-3 раза). К полученному на предметном стекле раствору BaCl2 прибавляют каплю йодата калия. Образуется характерный кристаллический осадок Ba(IO3)2); 3) при наличии бария пламя горелки окрашивается в желто-зеленый цвет. Анализ растворимых соединений бария: 1.с K2CrO4 образуется желтый BaCrO4; 2.с H2SO4 выделяется белый осадок;3.с родизонатом натрия наблюдают красно-коричневое окрашивание. Количественное определение: 1. Гравиметрический метод. Результаты завышены из-за соосаждения Ca2+ и Fe3+, содержащихся в органах человека в значительных количествах. 2.Титриметрический метод. Используется обратное комплексонометрическое титрование избытка трилона Б раствором хлорида цинка в присутствии эриохрома черного Т. Токсикологическое значение имеют следующие соединения бария: Ba(OH)2, BaCl2, Ba(NO3)2, BaCO3. Выводится через ЖКТ (в желудке образуются нерастворимые сульфаты и выводятся). Соединения бария широко применяются: BaSO4 - в медицине, BaCl2 и BaСO3 - в сельском хозяйстве и химических лабораториях. Отравления чаще встречаются из-зи применения BaSO4 в качестве контрастного вещества в рентгеноскопии. При этом используется до 100 и более грамм бария сульфата, который по своему способу получения может содержать BaСO3, переходящий в BaCl2 за счет HCl желудка. Токсическая доза BaСO3 - 0,2-0,5 г, смертельная около 1,0. Смерть наступает при полном сознании от паралича сердца. Марганец. MnO2 – при переработке этого оксида образуется пыль, KMnO4 - дезинфицирующее средство. Соединения Mn - сильные протоплазматические яды. Поражают почки, легкие, органы пищеварения. Накапливаются в печени, выделяются через ЖКТ, с мочой. Обнаружение Mn основано на реакциях окисления Mn2+ до MnO4-. В качестве окислителей используют периодат калия (KIO4) и персульфат аммония ((NH4)2S2O8). Для маскировки железа используют NaH2PO4. 2 Mn(NO3)2 + 5 KIO4 +3 H2O → 2 HMnO4 + 5 KIO3 + 4 HNO3 2Mn(NO3)2+5(NH4)2S2O8+8H2O→2HMnO4+5(NH4)2SO4+5H2SO4+4HNO3 Появление розовой окраски в первом случае (KIO4) - наличие в пробе естественно содержащегося Mn. Окраска в обоих случаях - основание для количественного определения Mn. Реакция окисления Mn2+ с KIO4 является качественно-количественной. Калибровочный график строят по растворам KMnO4. Хром. Не применяются в медицине (в виду токсичности). Применяются в кожевенной, текстильной промышленности, хромировании металлических изделий, производстве спичек, красок. Наиболее ядовиты дихроматы и хроматы. Накапливаются в печени, почках. Выводятся через почки. При отравлениях соединениями хрома - понос, кровавая рвота. Реакции качественного обнаружения основаны на окислении Cr3+ до Cr6+, а затем реакция с ДФК, образование надхромовых кислот. 1. Дихромат-ионы взаимодействуют с дифенилкарбазидом. ДФК окисляется до дифенилкарбазона, затем – дифенилкарбадиазон. 2. Образование надхромовых кислот:Ионы Cr3+ окисляют до Cr6+ персульфатом аммония в присутствии AgNO3, затем прибавляем H2O2 и органический растворитель (эфир, амиловый спирт). Наблюдается сине-голубое окрашивание. Cr2O72- + 4H2O2 + 2 H+ → 2H2CrO6 + 3H2O Если есть MnO4 -, то добавляют азид натрия (NaN3). Колич. определение: фотометрия окрашенного соединения с дифенилкарбазидом. Серебро.AgNO3 применяется как дезинфицирующее и прижигающее средство, в химическом анализе - реактив. Соединения серебра взаимодействуют в желудке с HCl, при этом образуется AgCl. Выделяется через ЖКТ. Качественное обнаружение: 1) реакция образования дитизоната серебра: К 5 мл минерализата прибавляют 5 мл хлороформа и по каплям 0,01% раствор дитизона в хлороформе. Появляется золотисто-желтое окрашивание. Если слой CHCl3 зеленый, его промывают 0,1% раствором аммиака для удаления избытка дитизона. При встряхивании хлороформного слоя с 5 мл 0,5 н HCl при наличии Ag+ золотисто-желтая окраска переходит в зеленую (разрушается комплекс). Чувствительность реакции 0,04 мкг серебра в 1 мл. Оптимальные условия: избыток дитизона и кислая среда. Реакции мешают катионы Hg и Au. Hg дает комплекс оранжево-желтого цвета Hg(HDz)2. В отличие от AgHDz комплекс не разрушается в 0,5 н растворе HCl. Если есть Ag, то его отделяют. Ко всему минерализату прибавляют 0,5 г NaCl, нагревают до кипения. Осадок после выпадения отделяют, промывают водой и растворяют в 2,5 мл 25% раствора аммиака. AgCl + 2NH4OH → Ag(NH3)Cl + 2H2O Полученный р-р исследуют на наличие Ag+: 1) при добавлении HNO3 выпадает осадок AgCl; 2) при взаимодействии с KI выпадает желтый осадок AgI; 3)2-3 капли аммиачного раствора Ag(NH3)2Cl упаривают на воздухе на предметном стекле до удаления NH3. На сухой остаток наносят каплю насыщенного раствора тиомочевины, каплю пикриновой кислоты: желтые игольчатые кристаллы. Количественное определение: 1)Титрование роданидом аммония в присутствии железоаммонийных квасцов. 2) Фотометрия дитизоната серебра. Токсикологическое значение имеет AgNO3. При длительной работе с серебром и его солями может возникнуть аргирия (отложение металлического серебра в тканях). |