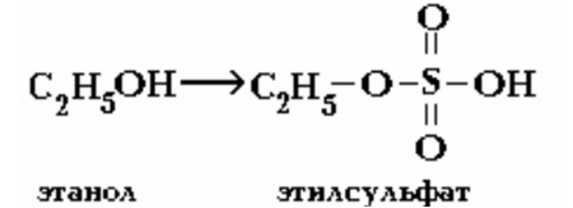1. Предмет, задачи и основные разделы токсик химии. Токсикологическая химия
 Скачать 1.42 Mb. Скачать 1.42 Mb.
|
|
8. Методы токсикологической химии. Методы изолирования: 1. Перегонка с водяным паром 2. Метод минерализации 3. Изолирование полярными растворителями 4. Экстракция органическими растворителями 5. Настаивание с водой 6. Особые методы изолирования. Методы очистки: 1. Дистилляция 2. Перекристаллизация 3. Экстракция 4. Реэкстракция 5. Диализ 6. Электродиализ 7. Хроматографические методы. Методы качественного обнаружения: 1. Химические (образ. осадков, окраш-х соед-й, МКС) методы 2. Физико-химические методы (СФМ, ГЖХ и др.) 3. Фармакологические пробы. 4. Иммуноферментный анализ. Методы количественного определения: 1. Химические (титриметрия) 2. Физико-химические (СФМ, флуориметрия, хроматография). 9. Методы изолирования ядовитых и сильнодействующих веществ из биологического материала. Методы изолирования: 1. Перегонка с водяным паром (летучие яды) 2. Метод минерализации (металлические яды) 3. Изолирование полярными растворителями (лекатсрвенные вещества) 4. Экстракция органическими растворителями (барбитураты, ксантины) 5. Настаивание с водой (минеральные кислоты и щелочи) 6. Особые методы изолирования. 10. Классификация метаболических превращений. Основные места метаболизма чужеродных соединений Классификация в зависимости от ферментов и типов реакций: Окисление микросомальными ферментами: гидроксилирование ациклических и ароматических соединений, эпоксидирование, N-гидроксилирование, N- и S-окисление, дезалкилирование, дезаминирование, десульфирование. Восстановление микросомальными ферментами: восстановление нитро- и азосоединений; 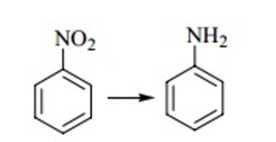 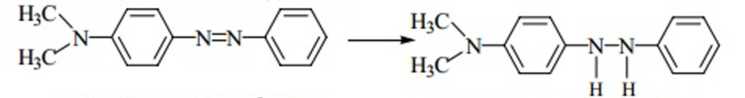 Немикросомальное окисление: дезаминирование  , , окисление спиртов (этанол — уксусный альдегид, вторичные спирты окисляются в кетоны) и альдегидов (бензальдегид − бензойная кислота), ароматизация ациклических соединений; Немикросомальное восстановление: восстановление альдегидов до спиртов (формальдегид - метанол)и кетонов до вторичных спиртов; Гидролиз: гидролиз сложных эфиров и амидов с участием микросомальных и немикросомальных ферментов: RCOOR1 + Н2О → RCOOH + ROH; RCONH2 + Н2О → RCOOH + NH3. Прочие реакции: дегидроксилирование катехолов и гидроксамовых кислот, дегалогенирование, восстановление дисульфидов в тиолы. Продукты метаболических превращений могут подвергаться: а) выделению без дальнейших изменений; б) конъюгации с последующим выделением. Основные места метаболизма: Печень. Кровь. Слизистые ЖКТ. Пищеварительные соки. Другие ткани организма. 11. Токсичность метаболитов. Фазы метаболизма Метаболизм − процесс превращения поступающих в организм веществ. Образующиеся продукты − метаболиты. Метаболизм чужеродных соединений (ЧС) происходит под влиянием ферментов. В основном метаболизм происходит в печени. В большинстве случаев метаболиты менее токсичны (но! метаболит уротропина − формальдегид − более токсичен; формальдегид более токсичен, чем метанол; из кодеина может образоваться более токсичный морфин, из тетрахлорметана в печени образуется свободный радикал •ССl3, вызывающий некроз печени, из амидопирина − канцерогенное вещество диметилнитрозамин). Более токсичными, чем исходные вещества, являются продукты летального синтеза. При летальном синтезе из более простых ЧС образуются более сложные соединения, обладающие токсическим действием (нетоксичная фторуксусная кислота в организме подвергается синтезу, в результате которого образуется фторлимонная кислота). В общем случае метаболизм можно рассматривать как один из путей дезактивирования ЧС в организме. Метаболизм ЧС проходит в две фазы: в 1-ой − превращение ЧС в метаболиты (фаза модификации или несинтетическая), во 2-ой фазе метаболиты взаимодействуют с веществами, находящимися в организме, с образованием конъюгатов (фаза синтетическая или конъюгация). В первой фазе ЧС подвергаются окислению, восстановлению, гидролизу, дезаминированию, дезалкилированию, десульфированию и другим превращениям. При конъюгации образуются менее токсичные соединения. Они более полярны, лучше растворяются в воде, быстрее выводятся из организма. Неполярные соединения выделяются с трудом, накапливаются в жировых тканях (гексахлорбензол, хлорированные инсектициды). Некоторые ЧС (диэтиловый эфир, фталевая кислота) выделяются неизмененными и рассматриваются как биохимически инертные. Но метаболическая инертность относительна, применение более чувствительных методов анализа обнаруживает, что метаболизм происходит (в незначительной степени). 12. Основные пути метаболизма чужеродных соединений 1. Окисление: а) микросомальное – алифатичекое или ароматическое гидроксилирование, – эпоксидирование, – N-гидроксилирование, – N, S-окисление, – дезалкилирование, – дезаминирование, – десульфирование; б) немикросомальное – окислительное дезаминирование, – окисление спиртов, альдегидов, – ароматизация алициклических соединений. 2. Восстановление: а) восстановление нитросоединений, азотсоединений микросомальными ферментами; б) микросомальное восстановительное галогенирование; в) немикросоальное восстановление. 3. Гидролиз с участием микросомальных и немикросомальных ферментов. 4. Синтез (реакции коньюгирования): а) образование коньюгатов с глюкуроновой кислотой; б) образование сложных эфиров с серной и фосфорной кислотами; в) метилирование; г) ацетилирование; д) пептидная коньюгация. 13. Реакции биосинтеза (конъюгации) При конъюгации образуются менее токсичные соединения. Они более полярны, лучше растворяются в воде, быстрее выводятся из организма. Неполярные соединения выделяются с трудом, накапливаются в жировых тканях (гексахлорбензол, хлорированные инсектициды). Конъюгация с глюкуроновой кислотой: спирты, фенолы, карбоновые кислоты, тиолы, амины. Продукты взаимодействия − глюкурониды. 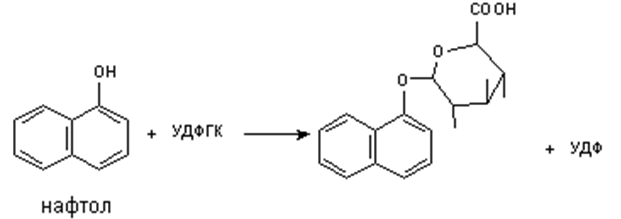 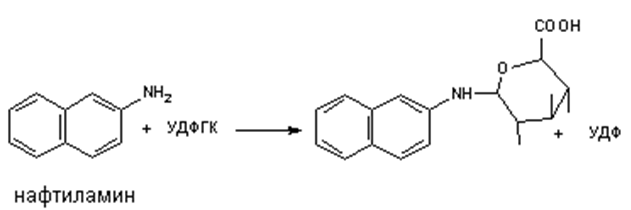 Метилирование: амины, фенолы, тиолы подвергаются в организме метилированию, это тоже реакции конъюгации или биосинтеза. Образуются N-,О-,S-метильные конъюгаты. N-метилирование: Пример: метилирование норадреналина до адреналина (переносчиком метильных групп является кофермент 5-аденозилметионин).
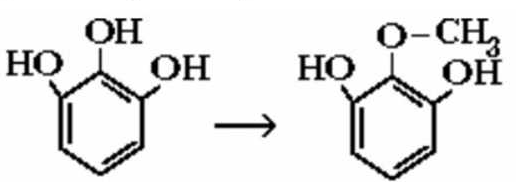
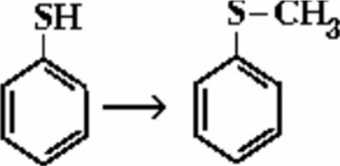
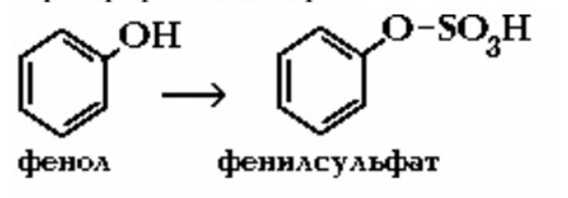
Ацетилнрование (ароматические амины, сульфаниламиды) − присоединение ацетильной группы 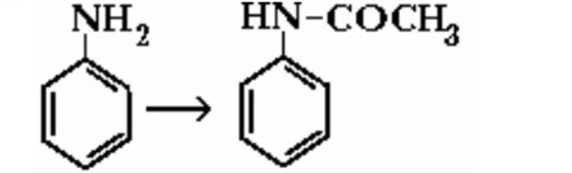 анилин ацетанилид Конъюгация с глицином H2N-CH2COOH Ароматические карбоновые кислоты с глицином образуют гиппуровые кислоты. Алифатические карбоновые кислоты с глицином не взаимодействуют. 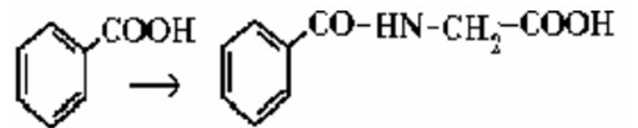 Конъюгация с сульфатами. Пример: фенолы и спирты
14. Группа ядовитых и сильнодействующих веществ, изолируемых перегонкой с водяным паром. 1. В-ва кислотного характера: синильная кислота; карбоновые кислоты алифатического ряда; фенолы и фенолокислоты (фенол, салициловая кислота). Эти в-ва перегоняют при подкислении биоматериала. 2. В-ва основного характера: алкалоиды и синтетич. ЛВ основного характера: никотин, анабазин, эфедрин, анилин, пиридин. Перегоняют при подщелачивании биоматериала. 3. В-ва нейтрального характера: УВ; ароматические УВ (бензол, толуол) и их нитро- и аминопроизводные (нитробензол, анилин); галогенпроизв. УВ (хлороформ, хлоралгидрат, тетрахлорметан); спирты алифатического ряда (метанол, этанол); эфиры простые и сложные (диэтиловый); альдегиды и кетоны (формальдегид, ацетон); элементоорг. соединения (ТЭС). Выбор объекта исследования на «летучие» яды.
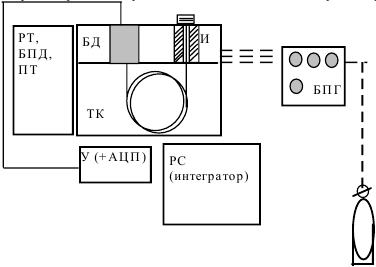
Методика перегонки с водяным паром. Подкисление проводят щавелевой или винной кислотами. 100г внутр. органов измельчают, смешивают с Н2О до кашицеобразной массы и помещают в круглодонную колбу. Подкисляют до рН 2-2,5 щавелевой к-той. Присоед-т парообр-ль к колбе с биоматериалом. Первую порцию дистиллята собирают в колбу, содержащую 2-5% р-р NaOH и иссл-т на наличие HCN. Второй и третий дистилляты соб-т в приемник без щелочи в кол-ве по 25 мл. В-ва основного и нейтр. характера перегоняют из подщелоч. биоматериала. Дистиллят собирают в 0,1 М р-р НСl. По окончании перегонки разъединить парообр-ль и колбу для перегонки, прекратить нагревать. HCN: подкисление щавелевой или винной к-тами, дистиллят соб-т в NaOH. CH3COOH: подкисл. H2SO4 или H3PO4, дистиллят соб-т в р-р NaOH. Этиленгликоль: в колбу с биоматериалом добавляют бензол (переносчик) и перегонку проводят в аппарате с насадкой. CH3OH: приемник охлаждают, чтобы избежать потерь метанола. ТЭС: из внутр. органов изолируют перегонкой с водяным паром и соб-т в спирт. р-р иода; из раст. обьектов экстраг-т хлороформом и экстракт смешивают с кристаллическим иодом. 15. Схема исследования дистиллята на наличие «летучих» ядов. Способы концентрирования и очистки дистиллята. 1. Экстракция орг. р-лями (диэтиловый эфир, СНСl3). Так конц-т изоамиловый спирт, анилин, фенол, крезолы. Экстрагируя изоамиловый спирт эфиром, одновр-но проводят и очистку его от воды, т.к. р-цию на изоамиловый спирт проводят в отсутствии воды. Этиленгликоль из крови и мочи извлекают ацетоном, который затем испаряют. Такой способ позволяет увеличить конц-цию этиленгликоля по сравнению с исх-й при исследовании крови в 5-10 раз, мочи – 25-50 раз. 2. Фракционная (дробная) перегонка проводится в колбах с дефлегма-торами. Получаются фракции с близкими Ткип. 3. При изолировании этиленгликоля в колбу с биоматериалом приб-т бензол в качестве переносчика. Прибор имеет специальную насадку. Схема исследования дистиллята химическим методом. Первый дистиллят иссл-т на наличие цианид-ионов. Наиболее доказательной явл-ся реакция образования берлинской лазури. Это высокочувствительная и избирательная р-ция, др. р-ции имеют вспомогат. значение. Со вторым дистиллятом проводят исследование на: 1. Формальдегид – р-ция с фуксинсернистой или хромотроп. к-тами, при положит. рез-те р-ции – р-ция с реакт. Фелинга и р-ция восстан-ния Ag+. 2. Метанол – при отсутствии HCOH метанол окисляют до формальдегида (р-р K2Cr2O7 в H+), а затем проводят перечисл. р-ции на формальдегид. При обнаруж. формальдегида на метанол проводят только р-цию обр-ния метилсалицилата или опред-т метанол методом ГЖХ. 3. Алкилгалогениды: выполн-ся р-ция отщепления органич. связ. хлора (пров-ся после гидролиза этанольным р-ром NaOH). При положит. р-ции на Cl- проводят внутригруп. идент-цию алкилгалогенидов: р-ция обр-ния изонитрила; р-ция с резорцином; р-ция с реакт. Фелинга. При положит. р-ции отщепления органически связ. хлора и отриц-х р-циях (а, б, в) проводят спец. иссл-вание на дихлорэтан: р-ция переведения ДХЭ в этиленгликоль с послед. окислением его до формальдегида, на кот. проводят р-ции с фуксинсернистой или хромотроповой кислотами; вторая характерная р-ция на ДХЭ – образование ацетиленида меди, имеющего красную окраску. Остаток второго дистиллята смеш-т с третьим и проводят р-ции на алкилгалогениды, т.е. при положит. предварит. р-циях проводится внутригруп. идентификация алкилгалог-дов. При анализе дистиллята на фенолы и изоамиловый спирт дистиллят подщелачивают р-ром NaHCO3 и извлекают эфиром. Эфирные экстракты соед-т, фильтруют, удаляют эфир и проводят исследование на фенолы и изоамиловый спирт. На фенолы проводят предварит. р-цию обр-ния трибромфенола. Эта р-кция более чувств-на, чем р-ция с FeCl3, и имеет отрицат. судебно-хим. значение. Если эта р-ция положит., то на фенолы проводят доп. р-ции (с хлоридом железа, образование индофенола). 25. Газохроматографический анализ «летучих» ядов. Газовая хроматография - это хроматографическое разделение веществ в системе газ - твердое тело или газ – жидкость. Исп. для анализа газов и летучих соед-ний.
торов (БПД) служит для подачи электр. сигнала на детектор. Для работы в режиме программирования температуры служит программатор температуры (ПТ). Газовые системы предст. блоком подготовки газов (БПГ). Газ-носитель обычно подается из баллона редуктором, кот. снижает это давление. Получаемый сигнал с детектора передается на блок усилителя (У), откуда передается либо непоср-но на аналоговый цифровой преобр-ль (АЦП) и далее на компьютер (РС). Детектор – устр-во, реаг. на изменение опред-х св-в смеси «разделяемый компонент + газ-носитель». Требования: чувств-ть, селект-ть; динамич-й диапазон. В газовых хромат-фах наиболее широко исп-ся такие детекторы: ДТП (детектор по теплопроводности) – принцип: электрическое сопротивление проводников изм-ся в зав-ти от теплопроводности газов (а она при изменении состава газа). ДЭЗ (детектор электронного захвата) в камере ДЭЗ есть источник радиоактивного излучения. Молекулы газа-носителя (азот, аргон и др.) иониз-ся с освоб-м электрона. Молекулы, в состав кот. входят атомы P, S, N, Hal, захв-т эти электроны. Образ-ся ионы менее подвижны и ток детектора уменьш-ся. ПИД (пламенно-ионизационный) в камеру детектора подаются водород в смеси с газом-носителем и воздух для поддержания пламени. В пламени чистого водорода нет ионов и фоновый ток детектора миним-й. При поступлении в пламя анализ. в-в они иониз-ся, число ионов увелич-ся, и сила тока возр-т. ТИД (термоионный) работа основана на ионизации в пламени водорода паров соли щелочного металла (н., CsBr) и ее увеличении при попадании в пламя фосфорорг-х и азотсод-х (н-р, акилнитриты) соед-й. Сила тока зависит от кол-ва ионов, образ-ся в пламени. |