1. Предмет, задачи и основные разделы токсик химии. Токсикологическая химия
 Скачать 1.42 Mb. Скачать 1.42 Mb.
|
|
Медь. «Парижская зелень» - смесь, состоящая из ацетата и арсенита Cu, ранее применялась для борьбы с вредителями сельского хозяйства. CuSO4- для пропитки древесины, как вяжущее и прижигающее средство. Соли Сu, поступившие в желудок, вызывают рвоту. Вызывают поражение печени, почек. Для качественного обнаружения меди берут 5 мл фильтрата (после отделения AgCl), нейтрализуют его аммиаком до рН 3 по универсальной индикатору и встряхивают с 5 мл хлороформного раствора диэтилдитиокарбамината (ДДТК) свинца. Окраска хлороформного слоя изменяется от желтого до коричневого. Для ДДТК ряд Тананаева при рН 5 выглядит так: Hg >Ag> Cu> Ni> Co> Pb >Bi >Cd> Tl >Sb> Zn> Mn >Fe. В соответствии с этим правилом каждый предшествующий металл, находящийся в водном растворе, вытесняет последующий из его карбамината, растворенного в хлороформе. Cu2+ + (ДДТК)2Pb → Pb2+ +(ДДТК)2 Cu (ДДТК)2Pb - специфичный реактив на медь, т.к. вытеснить Pb из его ДДТК могли бы только Hg2+, Ag+ . ДДТК Ag и Hg бесцветны в слое органич. растворителя. Только Cu2+ в этих условиях дает (ДДТК)2Cu, окрашенный в слое органич. растворителя. Чувствительность реакции 0,5 мкг/мл. Для качест. обнаружения Сu хлороформный слой с (ДДТК)2Cu промывают 6 н HCl для разложения избытка (ДДТК)2Pb, а затем водой. После этого хлороформный слой взбалтывают с 1% раствором HgCl2 до обесцвечивания хлороформного слоя. Прибавляют 1 мл воды, встряхивают, водный слой отделяют. Поводят следующие реакции: 1) с тетрароданомеркуратом аммония образуется желто-зеленый осадок Cu[Hg(SCN)4], в присутствии цинка - розово-лиловый осадок CuZn[Hg(SCN)4]2; 2)с K4[Fe(CN)6] - красно-бурый осадок Cu2[Fe(CN)6]; 3)с пиридин-роданидным реактивом [Cu(SCN)4]2-+PyH+→[Cu(SCN)4]2-(PyH+)2 изумрудно-зеленый (в хлороформе). Количественное определение: В виде Cu(ДДТК)2 и других окрашенных соединений. Сурьма. Соединения Sb3+ более токсичны, чем соединения Sb5+. Сурьма используется для приготовления стекла, красок, резиновых изделий. В медицине применяют органические соединения сурьмы (менее токсичны неорганических). Выводятся через почки. Обнаружение и определение сурьмы: реакция с малахитовым зеленым: Ассоциат металлогалогенидного комплекса и красителя окрашен в голубой или синий цвет и хорошо экстрагируется толуолом, бензолом. В 1 мл минерализата прибавляют 1 мл конц. H2SO4, 3 мл 5 н HCl , 2 капли 5% раствора NaNO2 (для окисления Sb3+ до Sb5+), 1 мл насыщенного раствора мочевины, 7 капель 0,5% раствора малахитового зеленого, 2 г безводного Na2SO4 и 5 мл толуола. Смесь встряхивают, слой толуола приобретает голубой или синий цвет. Слой органического растворителя отделяют, прибавляют 3 мл 35% раствора H2SO4, встряхивают: если окраска обусловлена наличием Sb, голубая окраска толуола сохраняется. Обнаруживается 0,2 мг сурьмы в 100 г биоматериала. Комплексы с малахитовым зеленым дают Fe(III), Tl(III) и Au(III). Комплекс FeCl4 - с малахитовым зеленым разрушается в 35-40%. H2SO4, Au и Tl редко встречается при анализе внутренних органов трупа. Для подтверждения наличия Sb проводят реакцию образования сульфида сурьмы: к 5 мл минерализата прибавляют 5 капель насыщенного раствора тиосульфата натрия и кипятят 1-2 минуты. Выпадает осадок оранжевого цвета. Sb2(SO4)3 + 3Na2S2O3 → Sb2(S2O3)3 + 3Na2SO4 Sb2(S2O3)3 + 3H2O → Sb2S3↓ +3H2SO4 Колич. определение: фотометрич. Опред. c малахитовым или бриллиантовым зеленым. Мышьяк. Основной метод обнаружения - восстановление до AsH3 и определение AsH3. Предварительная реакция: Зангер-Блека. В исследуемый раствор прибавляют 20% раствор H2SO4, металлический Zn, колбу закрывают тампоном, пропитанным Pb(CH3COO)2, и фильтровальной бумагой, пропитанной HgBr2 (HgCl2). Через 1 час отмечают окраску бумаги и пятно (обрабатывают раствором KI), т.е. HgBr2 + KI → HgI2 → K2 [HgI4](растворимый в воде) и остается пятно As2Hg3 темно-коричневого цвета. Мешает реакции Sb. Если реакция положительная - проводят реакцию Марша. FeCl2, SnCl2 восстанавливает AsO43- в AsO33-, т.к. арсениты восстанавливаются водородом легче, чем арсенаты. Это важно для количественного определения мышьяка. Вторая реакция тоже указывает на наличие Sb: с диэтилдитиокарбаминатом серебра в пиридине наблюдается красно-фиолетовая окраска, при наличии Sb - оранжево-красная. Определение мышьяка по методу Марша: Аппарат Марша: коническая колба, капельная воронка, стеклянная трубка, хлоркальциевая трубка, восстановительная трубка (трубка Марша). Определение: а) исследуют пламя у конца восстановительной трубки (если присутствует AsH3, то у пламя синеватый цвет); запах чеснока так же свидетельствует о наличии AsH3; б)вытянутый конец трубки опускают в пробирку с р-ром AgNO3(потемнение раствора); в)появление серо-бурого налета As с металлическим блеском в охлаждаемой части восстановительной трубки; г)при появлении плотного налета - место налета нагревают: 4As + 3O2 → 2As2O3 - белый налет. Кристаллы мышьяковистого ангидрида под микроскопом - в виде октаэдров (Sb2O3 - аморфный); д) если мало получается металлического As или As2O3 - налет растворяют в HNO3, переносят на предметное стекло. Проводят реакцию с CsCl и KI, в результате выпадает осадок Cs2AsI5∗2,5H2O. Достоинства метода Марша: 1. При пропускании H2S через восстановительную трубку образуется Sb2S3- красного, As2S3 - желтого цвета. Если к сульфидам прибавить HCl(конц.), то Sb2S3 растворяется, а цвет As2S3 не изменяется. 2. Налет мышьяка растворяется в гипохлорите натрия, сурьмы - не растворяется: 2As + 5NaOCl + 3H2O → 2H3AsO4 + 5NaCl. Количественное определение: восстановление As до AsH3, определение одним из методов: 1. Титриметрическое определение (избыток AgNO3 оттитровывают NH4CNS). 2. Колориметрия по методу Зангер-Блека (окраш. пятно As2Hg3 сравнивают со шкалой). Токсиколог. значение: As2O3 - инсектицид, консервант, применяется в зубоврачебной практике; Na2AsO3(арсенит натрия) - инсектицид; Сa(AsO2)2 - в борьбе с мышами, сусликами; в медицине препараты миарсенол, новарсенол, осарсол. При хроническом отравлении мышьяк накапливается в костях и волосах, ногтях. Обнаруживается в биоматериале через несколько лет. Соединения As5+ превращаются в организме в более токсичные соединения. Выводится мышьяк через ЖКТ, почки, потовые железы. Висмут. Токсичность соединений висмута. Основной нитрат висмута и салицилат висмута применяются в медицине. Выводится через почки, ЖКТ, потовые железы. Качеств. обнаружение. Предварительные реакции с тиомочевиной и 8-оксихинолином: 1) при реакции с 8-оксихинолином прибавляют аскорбиновую кислоту, т.к. окислители (Fe3+) мешают (окисляют I- до I2). Затем прибавляют KI и 8-оксихинолин - оранжево-желтый осадок. Чувствительность реакции выше, если прибавить смесь ацетон:амилацетат =1:1. 2)с тиомочевиной образуется Bi[SC(NH2)2]2,3,9 лимонно-желтого цвета. При положительных реакциях на Bi3+ его выделяют из минерализата двумя путями: 1. В виде диэтилдитиокарбамината Bi: проводят экстракцию хлороформом при рН=12 в присутствии трилона Б (маскировка других ионов). Затем реэкстракция HNO3, с водным р-ром проводят реакции: а) с бруцином и KBr образуются желто-зеленые кристаллы; б) с CsCl и KI образуются оранжево-красные кристаллы Cs[BiI4]. 2.К минерализату прибавляют Zn металлич., в осадок выделяется металлич. Bi. Его растворяют при t в конц. HNO3.После прибавления тиомочевины наблюдают лимонно-желтое окрашивание. Колич. определение: 1) в основе лежит реакция образования окрашенного соединения с тиомочевиной; измерение проводят при 470 нм; 2) титрование трилоном Б в присутствии тиомочевины. Токсиколог. значение: применение в медицине (как противосифилитическое средство, рвотное), фотографии, косметике. Цинк. ZnO- входит в состав цинковых белил, в состав мазей, паст; ZnCl2 - пайка, ZnSO4 - глазные капли. Соединения Zn поступают в организм через ЖКТ, органы дыхания, Накапливаются в печени, поджелудочной железе. Качеств. обнаружение: Реакцие с дитизоном. Если реакция отрицательна, то дальше реакции на Zn не проводят. Если положительна, то Zn выделяют с помощью диэтилдитиокарбамината. Экстракт обрабатывают HCl, в водной фазе определяют цинк: 1) с дитизоном (образуется красный комплекс). Экстракция CHCl3 при рН=5 2) с ДДТК экстрагируются и другие катионы, для маскировки прибавляют тиомочевину, тиосульфат натрия, лимонную кислоту и др. 3) в водной фазе Zn определяют:a) 2K4[Fe(CN)6] + 3ZnCl2 → K2Zn3[Fe(CN)6]2 ↓ + 6KCl b) c Na2S выпадает белый осадок ZnS; c) с тетрароданомеркуратом (II) аммония (NH4)2[Hg(CNS)4] образуется Zn[Hg(CNS)4] - дендриты под микроскопом. Количеств. определение: выделяют с ДДТК при рН=8, реэкстракция в водный слой и титрование трилоном Б (индикатор - эриохром черный). Токсикологическое значение: ZnCl2 входит в состав паяльной жидкости; ZnSO4 - как прижигающее и дезинфицирующее средство. Цинк накапливается в печени и поджелудочной железе. Выводится через ЖКТ, мало выводится с мочой. Таллий. При минерализации окисляется до Tl3+(если минерализация проводилась смесью кислот HNO3 и H2SO4). Далее проводят реакции: 1) с дитизоном при рН 11-12. Наблюдается розовая окраска хлороформного слоя. В щелочной среде в присутствии KCN реакция является специфичной (не мешают Cu2+,Zn2+,Cd2+,Сo2+,Ni2+). Прибавляют гидроксиламин, кот. переводит Tl3+ в Tl+. 2) с малахитовым (бриллиантовым) зеленым, слой толуола приобретает голубую или синюю окраску; Токсикологическое значение: применяется в стекольной промышленности, в медицине - при кожных заболеваниях для удаления волос (ацетат таллия). По действию сходен с препаратами мышьяка и свинца. При отравлении - выпадение волос, расстройство функций ЖКТ, рвота, боли в суставах, воспаление почек. Могут быть судороги, паралич. Этилмеркурхлорид - C2H5HgCl, (в смеси с тальком и минеральным маслом). Меркуран - 2% этилмеркурхлорида и 12% гексахлорциклогексана. Меркургексан - смесь этилмеркурхлорида и гексахлорбензола. Изолирование из биоматериала - экстракция CHCl3, 3-9 н HCl. Качественное и количественное определение в виде этилмеркурдитизоната (желтая окраска). Токсикологическое значение: органические соединения ртути более токсичны. В медицине применяют как диуретики, для стерилизации инструментов, в качестве противораковых средств. Диагноз отравлений затруднен, т.к. картина отравления напоминает желудочно-кишечные заболевания. Тетраэтилсвинец (ТЭС) - Pb(C2H5)4. Бесцветная маслянистая жидкость. Хорошо растворима в органических растворителях, нерастворима в воде. Летуча. Испаряется при температуре даже ниже 0°С. ТЭС является антидетонатором моторного топлива, т.е. устраняет детонационные свойства бензина (добавление ТЭС к горючему резко снижает износ двигателей внутреннего сгорания). В чистом виде как детонатор не используется, а идет на приготовление этиловой жидкости с содержанием его до 54-58%, остальные компоненты - органические растворители и красители. В судебно-медицинские лаборатории в качестве вещественных доказательств направляются: этилированный бензин, одежда, пищевые продукты, внутренние органы трупов людей и животных. Изолирование ТЭС из внутренних органов трупа проводится дистилляцией с водяным паром. Собирают дистиллят в приемник, содержащий насыщенный спиртовой раствор иода (I2). Приемник соединяют с уловителем, также содержащим спиртовой раствор I2. Содержимое уловителя и дистиллят объединяют и оставляют на 30 минут при комнатной температуре, упаривают на водяной бане досуха, обрабатывают HNO3 (1:2) и вновь упаривают. Кристаллический остаток растворяют в воде и исследуют качественно и количественно. Изолирование из растительных объектов. Если исследуют мясо, котлеты, то ТЭС изолируют по вышеописанному способу (как биоматериал). Если объектом являются продукты растительного происхождения (мука, крупа, хлеб), то изолирование ТЭС лучше проводить органическим растворителем: 100 г объекта заливают CHCl3 и оставляют при комнатной температуре на 2 часа в колбе с притертой пробкой. Хлороформную вытяжку отфильтровывают в стакан, на дне которого находится 1 г кристаллического йода. Объект на фильтре дважды промывают CHCl3 и тоже помещают в стакан. Содержимое стакана перемешивают до растворения йода. Через 20-30 минут содержимое стакана переносят в фарфоровую чашку, упаривают на бане досуха. Изолирование ТЭС из бензинов: исследуемый бензин смешивают с 4% спиртовым раствором йода. Через некоторое время упаривают и в остатке определяют Pb. 35. Методы изолирования подкисленным спиртом. Основаны на различной растворимости веществ в воде и органических растворителях. Метод Стаса-Отто. Метод используют при выделении токисч. вещ-в из биоматериала. 1. Биоматериал несколько раз настаивают с этиловым спиртом, подкисленным щавелевой к-той. 2. Кислые спиртовые вытяжки сливают, фильтруют и взбалтывают с диэтиловым эфиром ( в него переходят примеси). 3. Эфирный слой отделяют, а водную вытяжку обрабатывают Na2CO3 или NH4OH и взбалтывают с эфиром (в эфир переходит алкалоид). Эфирные вытяжки выпаривают. Теперь экстрагент – хлороформ. Удобство применения хлороформа: хорошо растворяет большинство токсикологических вещ-в. Экстрагированием хлороформом из кислой, а потом из щелочной среды достигается разделение группы вещ-в, изолируемых подкисленным спиртом, на 2 группы: 1) экстрагируемые из кислого раствора: - кислоты и их производные; - многоатомные фенолы (гидрохинолон, пирогаллон); - нек. вещ-ва нейтрального характера ( производные анилина); - слабые основания. 2) экстрагируемые из щелочного раствора. «+» - спирт свертывает и переводит в нерастворимое состояние белок. «-» - длительность, много операций, возможность потери малых кол-в алкалоидов. Метод Саламатина на производные фенотиазина. Используют спирт, подкисленный щавелевой кислотой. Упаривают. Осаждают белки и фильтруют. Экстрагируют примеси эфиром. 36. Методы изолирования подкисленной водой. Метод Драгендорфа. Из оранов трупа извлечение. 1.ЛВ извлекают 2-3раза водой, содержащей H2SO4. 2. Водные вытяжки упаривают и настаивают с 3-4-х кратным объемом 96% спирта сутки. Фильтруют. 3. Из кислого фильтрата извлекают токсические вещ-ва петролейным эфиром (салициловая, бензойная к-ты), бензолом (кофеин, фенол), хлороформом (папаверин, теобромин). 4. Фильтрат подщелачивают ра-ром аммиака и экстрагируют алкалоиды петролейным эфиром (стрихнин, никотин), бензолом (атропин, кокаин, стрихнин), хлороформ (папаверин), амиловым спиртом(морфин). «-» - при упаривании гидролиз некот. вещ-в; наблюдаются потери вещ-в. Метод Швайковой-Васильевой. 1. Свежий трупный материал заливают дистилированой водой, подкисленной 10% ра-ром щавелевой к-ты и оставляют на 2 часа при частом взбалтывании. 2. Вытяжку процеживают, остаток промывают водой. Вытяжку и промывные воды объединяют и извлекают токсические вещ-ва хлороформом(сейчас эфиром) из кислого, затем подщелоченного раствора. «+» - быстро, не тратится спирт; «-» - стойкая эмульсия при извлечении хлороформом. Общий по Крамаренко. Извлечение проводят при рН 2,5 – при этом рН разрушаются комплексы алкалоид-белок. Алкалоиды экстрагируют из водных растворов органическими растворителями: из кислой среды – некот. слабоосновные (кофеин), из щелочной – алкалоиды с большой константой диссоциации (кодеин) Водное извлечение (материал + вода+ Н2SO4 (рН 2,5-3)) процеживают, центрифугируют. Очищают, добавляют (NH4)2SO4 до насыщения. Центрифугируют. Добавляют 20 % NH4OH (рН 4,5). Экстракция хлороформом слабоосновных алколоидов. Для экстракции основных вещ-в перед добавлением хлороформа прибавляют 20% NaOH. (рН 9). Частные методы изолирования барбитуратов. Метод Швайковой. Метод изолирования водой, подкисленной щавелевой к-той до рН 2. Центрифугируют, создают рН 2 и экстрагируют хлороформом. Метод Поповой. Изолирование водой, подкисленной серной кислотой. Процеживают и центрифугируют. Очищают методом гель-хроматографии. Экстрагируют хлороформом, который потом отгоняют при 70 Со, затем выпаривают при комнатной температуре. Метод Валова. Метод изолирования подщелоченной водой. Центрифугируют, к центрифугату +10 % NaWO4 + Н2SO4 (осаждение примесей), нагревают, центрифугируют, процеживают. Экстрагируют эфиром, реэкстрагируют 10% гидроксидом натрия, подкисляют серной к-той до рН 2 и экстрагируют эфиром. 38. Характеристика веществ, экстрагируемых органическими растворителями из кислого раствора В-ва, экстрагир. из кислой среды: орг кислоты и их производные (барбитураты, сульфаниламидные ЛС, каннабиноиды), нейтральные соединения (фенацетин, сердечные гликозиды), в-ва слабоосн. характера (производные ксантина, пиразолона, 1,4-бензодиазепина) Состояние в-в кислотного характера зависит от рН р-ров. В щелочной среде в-ва кислотного характера нах-ся в виде ионов (анионов) и хорошо раств-ся в воде. При подкислении р-ров ионизация слабых кислот понижается и в р-рах доминируют молекулярные формы в-в кислотного характера, кот. лучше раств-ся в орг раств-лях. Поэтому извлечение в-в кислотного характера лучше проводить из щелочной среды (метод Валова). К лек в-вам кислотного характера отн-ся салициловая, ацетилсалициловая кислоты, барбитураты и др. Барбитураты занимают значительное место в судебно-хим. практике. Исследование на наличие их явл-ся обяз-м при анализе внутр. органов трупов людей, рвотных масс, мочи и др объектов. Токсик. значение имеют 5,5- замещенные барбитуровой кислоты (барбитал, барбамил, бутобарбитал, фенобарбитал, этаминал и др.), а так же 1,5,5-замещенные этой кислоты (бензонал, гексенал и др.). Для производных барбитуровой кислоты возможна имино-имидольная (лактим-лактамная) таутомерия, так как водородные атомы замещены радикалами. 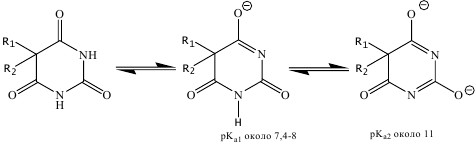 По кислым свойствам барбитуровая кислота в 5-6 раз сильнее уксусной. Поэтому барбитал и фенобарбитал имеют слабокислую реакцию в водных растворах и дают со щелочами соли. Барбитураты -твердые,кристаллич вещества, без запаха, горького вкуса. Хорошо растворяются в щелочах, растворяются в конц серной кислоте, при разбавлении сернокислых растворов водой барбитураты выпадают в осадок. Форма кристаллов специфична. Большинство барбитуратов хорошо растворимы в эфире, хуже в хлороформе, этиловом и метиловом спиртах. При кипячении или сплавлении со щелочами барбитураты разлагаются с выделением NH3. Очистка кислого хлороформного извлечения от сопутствующих веществ может быть осуществлена путем реэкстракции и хроматографического разделения в тонком слое силикагеля. |
