1. Предмет, задачи и основные разделы токсик химии. Токсикологическая химия
 Скачать 1.42 Mb. Скачать 1.42 Mb.
|
|
46. Алкалоиды(А) группы пиридина и пиперидина. Пахикарпин. Токсикологическое значение,изолирование,обнаружение,количественное определение. Из в-в, экстрагируемых орг. раств-лем из щелочного р-ра, наибольшее токсикологическое значение имеют алкалоиды. А - органические азотистые основания сложного состава, встречающиеся в растениях (реже в животных организмах) и обладающие сильным фармакологическим действием. Пахикарпин отноистся к производным пиридина и пиперидина.  а) моноциклические (конин, ареколин) б)бициклические (анабазин, никотин) в) полициклические (пахикарпин). Пахикарпин-алкалоид,содержащийся в растении софора толстоплодная. С медицинской целью применяется пахикарпина гидрохлорид при спазмах периферических сосудов; для усиления родовой деятельности.Не кумулируется в организме,выводится с мочой. Признаки отравления появляютя через 0.5-3 часа : тошнота, рвота,затруднение дыхания,помрачение сознания. Основание пахикарпина-б-цв.ж-ть, хорошо раст-ся в воде, хлороформе, эфире.Перегоняется водяным паром. Обнаружение: 1.Общеалкалоидные реактивы. 2.М-кристаллоскопические р-ции с родадонидом кобальта, пикриновой к-той, 3.ТСХ, ГЖХ. Химико-токсикологическое исследование на алкалоиды складывается из ряда этапов: 1. Изолирование алкалоидов из биологического объекта. 2. Очистка полученного извлечения от сопутствующих (балластных) веществ. 3. Идентификация алкалоидов.4. Количественное определение. Изолирование А из био. материала можно проводить общими методами для группы «нелетучих» ядов - подкисленным спиртом, водой, подкисленной щавелевой кислотой, либо частным методом -водой, подкисленной серной кислотой, по В.Ф. Крамаренко. Для жидких А, основания кот. летучи с водяным паром, в качестве метода изолирования может быть применена перегонка с водяным паром. Для некоторых алкалоидов, например, для пахикарпина, разработан метод электродиализа. Общеалкалоидные осадительные реактивы делят на 2 большие группы: 1. Реактивы, дающие с алкалоидами простые соли: 1. Раствор таннина, пикриновая, пикролоновая и некоторые другие органические кислоты. 2. Реактивы, дающие с алкалоидами комплексные соединения, которые делятся на 2 подгруппы: а) реактивы, содержащие в своем составе металлоиды: 1) I2/КI - реактив Бушарда-Вагнера, Н3РО4 .12МоО3 - фосфорномолибденовая кислота (реактив Зонненшейна), 3) Н3РО4 . 12WО3 . 2Н2О- фосфорновольфрамовая кислота (реактив Шейблера). б) реактивы, содержащие в своем составе металлы: 1)ВI3/КI-реактив Драгендорфа (К[ВiI4]), 2) CdI3/KI - реактив Марме (K2[CdI4]), 3) HgI2/KI - реактив Несслера (К2[НgI4]), 4) H2[PtCl4] - платинохлористоводородная кислота, 5) Н[АuCl4] - золотохлористоводородная кислота.4. Колич. опр-е А:Фотометрические методы анализа позволяют определять очень малые (несколько микрограммов) количества алкалоидов, но требуют высокой степени чистоты выделенного вещества, поэтому сочетаются с ТСХ- очисткой полученных извлечений. Фотометрическим и спектрофотометрическим методами (в видимой и УФ-областях спектра). 47.Никотин, анабазин. Токсикологическое значение, изолирование, анализ.  никотин никотин  Анабазин. Анабазин. Никотин относится к бициклическим производным с неконденсированными ядрами пиридина и пирролидина, содержится в различных видах табака и др.раст-ний. В медицине никотин не применяется, явл-ся источником получения никотиновой к-ты. В организм никотин может пост-ть ч-з кожу, слиз-е обол-ки рта, вдыхании воздуха с табачной пылью, проникает ч-з плаценту. При остром отравлении набл-ся головокружение, рвота, понос,тахикардия,сужение зрачков, судороги. Никотин-б-цв. Маслянистая ж-ть,хорошо раст-ся в воде и орг.раст-лях,перегоняется с водяным паром без разложения, обл-ет слабооснов-ми св-ми,экстрагируется хлороформом из щелочных р-ров,из кислых р-ров- в меньших кол-вах. Для выдел-я Н.из биоматериала могут использовать метод перегонки с водяным паром. Обнаружение. 1.Микрокристаллоскопические р-ции с р-вами Драгендорфа, солью Рейнеке; 2.Р-ция с формальдегидом и конц.азотной к-той( красная окраска); 3.Р-я с n-диметиламинобензальдегидом(розов. Окраска, перех-щая в фиолетовую. Относится к бициклическим производным, содержажим ядра пиридина и пиперидина, содержится в ежовнике безлистном. В медицине не прим-ют ,т.к. очень токсичен. При отравлении- понос, желтуха, выпадение волос. Анабазин –б-цв. Маслянистая ж-ть, растворяется в воде и орг. Раст-лях, перегоняется водяным паром. Экстрагируется хлороформом из щелоч.р-ров и в меньшей степени-из кислых. Обнаружение. 1.Общеалкалоидные реактивы: р-в Драгендорфа (оранж-красные игольчатые кристаллы), р-в Бушарда, пикриновая кислота. 2.Р-ция с солью Рейнеке 3.Красное окрашивание с пероксидом водорода и конц. Серной к-той. 4.Р-ц 48. Алкалоиды группы тропана (атропин, скополамин, кокаин). Токсикологическое значение, изолирование, качественное обнаружение. В основе лежит ядро тропана (бициклическая система, образованная пирролидином (А) и пиперидином (В)):
Атропин рКВН+=9,8
2. Реакция Витали-Морена. При нагревании атропина с азотной кислотой он разлагается на тропин и троповую кислоту. Троповая кислота с азотной кислотой образует тринитропроизводное, имеющее желтую окраску:.
3. С солью Рейнеке (NH4)[Cr(SCN)4(NH3)2] образуются сростки кристаллов сиреневого цвета с ромбовидными концами. 4. С пикриновой кислотой образуется светло-желтый кристаллический осадок. 5. С п-диметиламино-бензальдегидом в конц. H2SO4 и последующим нагреванием на водяной бане. Переход окраски: красная → вишнево-красная → фиолетовая. Токсикология Применяется как средство, расширяющее зрачок, спазмолитическое при бронхиальной астме, спастических колитах. При отравлении − сильное возбуждение, галлюцинации, беготня, смех. Смертельная доза 0,1 г. Выводится с мочой (около 50% в неизмененном виде). Разлагается на тропин и троповую кислоту. Скополамин рКВН+=7,6
Качественное обнаружение: 1. С общеалкалоидными реактивами. 2. Реакция Витали-Морена. 3. С солью Рейнеке. 4. С золотобромистоводородной кислотой (отличие от атропина). 5. УФ-спектр имеет максимум при 251, 257, 263 нм. Токсикология: применяется в качестве успокаивающего и снотворного средства при частой бессонице и в психиатрической практике. Входит в состав таблеток «Аэрон» − противорвотное и успокаивающее средство при морской и воздушной болезнях. Смертельная доза 0,1 г. Разрушается в печени, выводится с мочой. Кокаин рКВН+=8,6.
2. Образование бензойно-этилового эфира. 3. С KMnO4 (красно-фиолетовые пластинки). 4. С Na2PbCu (NO2)6 (кристаллы в виде трехгранных призм изумрудно-зеленого цвета). 5. С платинохлористоводородной кислотой (H2PtCl6) − светло-желтые кристаллы. Токсикология: местноанестезирующее средство. Недостаток − привыкание. Токсичен. Смертельная доза − 0,1-0,3 г. Быстро разрушается в организме, поэтому в моче трудно обнаружить. Основные метаболиты − бензоилэкгонин (около 50% выделяется с мочой) метиловый эфир экгонина, экгонин, норкокаин (фармакологически активный). Кокаин обнаруживается в трупе только через непродолжительное время после наступления смерти. Максимальные сроки обнаружения не превышают 3-х недель. 49. Алкалоиды, производные хинолина (хинин). Токсикологическое значение, обнаружение в объектах биологического происхождения.
Основание хинина хорошо растворяется в хлороформе, эфире, этаноле, слабо растворяется в воде (1:1560). Гидрохлорид хинина растворяется в этаноле (1:1), слабо растворяется в эфире. Сульфат хинина растворяется в этаноле (1:95), слабо растворяется в воде (1:810), хлороформе и эфире. Хинин обладает основными свойствами: pK1BH+ = 8,5 и pK2BH+ = 4,1. Оптимальные условия экстракции хлороформом – рН 9 – 10. Качественное обнаружение: 1. С общеалкалоидными реактивами – хинин дает осадки с реактивами Бушарда, Драгендорфа, Майера, Зонненшейна. 2. Флуоресценция сернокислых растворов хинина. Часть иссл. хлороформного р-ра помещают в пробирку, хлороформ испаряют, + воду очищен. и разв. серную к-ту. Появляется голубая флуоресценция. При рН =9 − фиолетовая флуоресценция. Если к раствору хинина, подкисленному серной кислотой, + бромную воду и 25 % р-р аммония гидроксида до щелочной реакции, то появляется жёлто–зелёная флуоресценция. 3. Талейохинная проба:
4. Эритрохинная реакция: появление розовой окраски при обработке пробы серной (уксусной) кислотой, бромной водой, раствором гексацианоферрата (III) калия и аммиаком. Несколько капель иссл. раствора выпаривают досуха. К сухому остатку + воду, 1% р-р серной кислоты, бромную воду и 10 % р-р калия гексациано(III)феррата. + аммиак до щелочной реакции, появляется розовая или красно–фиолетовая окраска. Токсик. значение Обл. противомалярийной активностью. Прим-ся в акушерстве для возбуждения и усиления родовой деят-ти. Побочное общетоксическое действие хинина как ЛС: сильная головная боль, шум в ушах, понос, кожная сыпь, расстройство зрения и слуха. 50. Алкалоиды, производные изохинолина (папаверин). Токсикологическое значение, изолирование, анализ.
Качественное обнаружение: 1. Общеалкалоидные реактивы. 2. Цветные реакции: с реактивами Марки – с реактивом Марки реакцию можно проводить двумя способами: 1) сухой остаток папаверина с реактивом Марки на холоду даёт розовую окраску при нагревании переходящую в фиолетово–красную или пурпурно–красную; 2) от прибавления реактива Марки к сухому остатку папаверина появляется розовая окраска. Если к раствору прибавить кристаллик калия перманганата, то окраска переходит в голубую.·С реактивом Эрдмана − красное окрашивание; с реактивом Фреде − зелёное окрашивание;·с реактивом Манделина − сине– фиолетовое окрашивание. 3. Реакция с хлоридом кадмия (тонкие кристаллы, имеющие форму куба): На предметное стекло наносят несколько капель исследуемого раствора и выпаривают досуха. К сухому остатку + 0,1 н. р-р HCl. Рядом наносят каплю 10 %-го р-ра хлорида кадмия, а соединяют эти растворы. 4. УФ- спектр (250, 284, 310 нм). Действие на организм. Cосудорасширяющее и спазмолитическое действие. В больших дозах проявляет седативный эффект. В медицине применяется при спазмах кровеносных сосудов, гладкой мускулатуры органов брюшной полости, при бронхиальной астме. Связывается с белками на 90%, период полувыведения 4–15 часов. Метаболизм происходит путем О-деметилирование и образование глюкуронидов и сульфатов. При этом образуются фенольные соединения, которые выделяются с мочой. Отравление папаверином: угнетение сознания, брадикардия (АВ-, синоатриальные блокады), нарушение ритма сердца. 54. Ациклические алкалоиды (эфедрин). Токсикологическое значение, изолирование, анализ. Эфедрин.  рК вн + = 9,6 Методы изолирования: Объект исследования – моча. Изолирование проводят жидкость-жидкостной экстракцией хлороформом (рН 12). Качественные реакции: С реактивом Драгендорфа (кислотный р-р KBiI4). Сух. остаток + 0,1М НСI + реактив - характерные кристаллы. 2. С солями меди и сероуглеродом: исслед. р-р, подкисленный уксусной к-той + 5% р-р CuSO4 + NaOH до щелоч. реакции + смесь CS2 и бензола - бензольный слой имеет коричневую окраску:  Реакция с 2,4- динитрохлорбензолом: эфирный р-р исслед. в-ва + NaOH + спирт. р-р 2,4-динитрохлорбензола, t – желто-корич. окраска + хлороформ + уксусная к-та – хлороформ. слой желтеет. 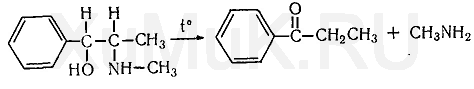  В химико-токсикологическом анализе эфедрина и других фенилалкиламинов (эфедрон, фенилпропаноламин, амфетамин) применяется ВЭЖХ. |