ТОКСИКОЛОГИЯ – ПРЕДМЕТ И ЗАДАЧИ, ОСОБЕННОСТИ ХИМИКО-ТОКС АНАЛИЗА. 1. токсикология предмет и задачи, особенности химикотокс анализа токсическая химия
 Скачать 1.06 Mb. Скачать 1.06 Mb.
|
SbИзолирование: смесью двух кислот. Идентификация: образование ионных ассоциатов с малахитовым или бриллиантовым зеленым. Sb2(SO4)3 + 2NaNO2 + 16HCl 2HSbCl6 + 4NH4Cl + 3H2SO4 + 4H2O + 4NO 2NaNO3 + 2HCl + O=C(NH2)2 2N2 + CO2 + 2NaCl + 2H2O Добавляют толуол и бриллиантовый (малахитовый) зеленый.  Толуоловый слой окрашивается в синий цвет. Такой же эффект дает таллий, поэтому чтобы их различить, проводят реакцию с тиосульфатом Na. Выпадает оранжево-желтый осадок. Sb2(SO4)3 + 3Na2S2O3 + 3H2O Sb2S3↓ + 2Na2SO4 + 3H2SO4 Количественное определение: ФЭК, СФМ по реакции образования ассоциата. TlИзолирование: смесью двух кислот. Идентификация: 1. С бриллиантовым или малахитовым зеленым.  Толуольный слой окрашивается в голубой или синий цвет. Аналогичную реакцию дает сурьма. 2. С дитизоном. Сперва необходимо перевести Tl из Tl3+ и Tl1+ 3Tl2(SO4)3 + 4NH2OH + 12NH4OH 3Tl2SO4 + 4NO + 6(NH4)2SO4 + 12H2O  Хлороформный слой окрашивается в красный цвет. Количественное определение: 1. ФЭК, СФМ по обеим цветным реакциям. 2. Комплексонометрия. МЫШЬЯК, РТУТЬ AsИ  золирование: золирование:1. Целенаправленное исследование – сплавление. 2. Смесью двух кислот. Идентификация: 1. Предварительные пробы а) Изучение фарфоровидных крупинок (их находят в желудке) б) Проба Рейнша (с мочой). в) Проба Зангер-Блека. Все они имеют отрицательное судебно-химическое значение. 2. Метод Марша - проводят в специальном приборе. Метод многодоказательный и позволяет отделить мышьяк от сурьмы. Конец трубки Марша поместить в раствор AgNO3 выпадет осадок серебра. AgNO3 + AsH3 Ag3As + 3HNO3 Ag3As + 3AgNO3 Ag3As•3AgNO3 Ag3As•3AgNO3 + 3H2O 3HNO3 + 6Ag + H3AsO3 Используют при КО. HgИдентификация: 1. С дитизоном.  Хлороформный слой окрашивается в золотисто-желтый цвет. Аналогично реагирует серебро, чтобы их отличить, хлороформ отделяют и добавляют HCl, комплекс ртути разлагается, а серебра – нет. Количественное определение: ФЭК по реакции Рубцова-Полежаевой; ФЭК, СФМ в видимой области по реакции с дитизоном. 15. ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА. Общие методы изолирования. Факторы, влияющие на эффективность: а) Характер биоматериала (паренхимный орган, кости). Свежесть биоматерила. б) Способ настаивания. Температура, перемешивание (режим), повышенное осмотическое давление (высаливание), применение приборов. в) Физико-химические свойства растворителя г) Физико-химические свойства ТВ. Гидро-/липофильность, способность образовывать комплексы с белками, прочность комплексов. Степень растворимости ТВ в растворителе. д) рН растворителя. Общие методы изолирования. Метод Стаса-Отто50,0-100,0 биоматериала измельчают и заливают абсолютным этанолом, подкисляя щавелевой или винно-каменной кислотой до рН=2-3. Перемешиваем и проверяем значение рН, настаиваем при комнатной температуре в течение суток при периодическом перемешивании и проверяем значение рН. Жидкую фазу сливаем, операцию повторяем 2-3 раза (в течение 2-3 суток), затем биоматериал помещаем на фильтр и промываем спиртом; спиртовые вытяжки объединяют и упаривают на водяной бане при 40-50°С до густоты сиропа. Сиропообразную жидкость обрабатывают этанолом до прекращения выпадения осадка, жидкость фильтруют, снова упаривают до густоты сиропа и вновь осаждают белки. Остаток обрабатывают 20-25 мл воды, осадок отфильтровывают, проводят экстракцию хлороформа (203 порции), получают кислое хлороформное извлечение. Водную фазу подщелачивают 25% раствором NH4OH до рН=9-10, извлекают хлороформом (2-3) порции, получают щелочное хлороформное извлечение. Метод Васильевой. 50-100,0 биоматериала измельчают и заливают водой, подкисляя щавелевой или винно-каменной кислотой и настаивают при комнатной температуре в течение 1 часа, перемешивают, проверяют значение рН, вытяжку фильтруют, центрифугируют и экстрагируют хлороформом (трижды) – осторожно, во избежание эмульгирования с водой. Водную фазу подщелачивают 20% NaOH и трижды экстрагируют хлороформом. Достоинства: 1. Быстро (в течение 1 рабочего дня). 2. Дешево. 3. Почти отсутствуют потери ТВ из-за многократной очистки вытяжки. Недостатки: 1. Вода является не универсальным растворителем. Извлечение содержит большое количество балластных веществ, возможно образование эмульсии на этапе экстракции. Нельзя использовать с несвежим биоматериалом. Частные методы изолирования: Применяют при целенаправленно исследовании биоматериала. На производные барбитуровой кислоты – метод Валова. Биоматериал измельчают (50-100,0) и заливают 80 мл воды + 20 мл 10%NaOH, настаивают 0,5 часа при периодическом перемешивании. Извлечение сливают, центрифугируют, к центрифугату добавляют 120 мл 10% раствора вольфрамата натрия и 1М H2SO4 до рН=2 (образуется вольфрамовая кислота, осаждает белки). Нагревают и кипятят 20 минут, центрифугируют, центрифугат переносят в делительную воронку и проводят извлечение эфиром. К эфирному слою добавляют 50 мл 10%NaOH, водную фазу отделяют, добавляют 25%H2SO4 до рН=2 и вновь извлекают эфиром (метод реэкстракции). Настаивание производят в щелочной воде, т.к. барбитураты образуют соли. Метод Поповой. 50-100,0 биоматериала измельчают, прибавляют 80 мл 0,01М H2SO4 до рН=2-3, перемешивают, проверяют рН, настаивают 2 часа, водную вытяжку сливают, процедуру повторяют 2 раза, водные вытяжки объединяют и центрифугируют, очищают от примесей гель-хроматографией. Колонка «Сефадекс», «Д25». Элюат – концентрируют хлороформом. На алкалоид – метод Кроморенко. 50-100,0 биоматериала измельчают и заливают 0,02М раствором H2SO4 до рН=2,5 (гидролиз алкалоидов не происходит, а извлечение лучше), настаивают 2 часа при периодическом перемешивании, проверяют рН,, водный слой процеживают. Операцию проводят 2 раза. Водную вытяжку объединяют, центрифугируют, добавляют сульфат аммония до насыщения (высаливание α-белков), центрифугируют, и извлекают эфиром 2-3 раза. К водной фазе прибавляют небольшими порциями раствор NaOH 20% (водная фаза содержит (NH4)2SO4 + NaOH NH4OH, которым и происходит подщелачивание) до рН=9-10 и экстрагируют эфиром или хлороформом. 16. ТСХ 17. БАРБИТУРАТЫ. ПРОИЗВОДНЫЕ ПИРАЗОЛОНА. АЛКАЛОИДЫ ТРОПАНА 1. кобальтовая проба – общ-я р-я – роз-фиол-е окр-е. 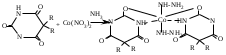 2. микрокристаллическиее реакции Фенобарбитал Барбитал Барбамил   3. СФМ Метод основан на лактим-тактамной таутомерии барбитурата.  На графиках D от λ происходит сдвиг максимумов (батохромный сдвиг) На 1 графике гипербола, на втором – дуга с максимумом 240нм, на третьем дуга 250 нм. Методика: чпсть кислого хлороформного извлечения выпаривают досуха, сухой остаток растворяют в воде и + несколько капелль NH4OH (или растворяют в боратном буфере до рН=10). Снимают спектр полученного раствора (220нм-280нм). Р-р сравнения – растворитель. Затем в обе кюветы + 1-2 капли насыщенного NH4OH до рН=13,0 и вновь снимают спектр. Далее строят график (2 и 3 на одном графике) где спектры поглощения пересекаются в 3-х изобестических точках. ПРОИЗВОДНЫЕ ПИРАЗОЛОНА – 5. Антипирин, анальгин 1. с р-ром FeCl3: антипирин – красное окр-е, амидопирин – фиол-е, исчезающее при избытке р-ва, анальгин – синее крас исчез. 2. с азотистой к-той: антипирин – зеленое окр-е. 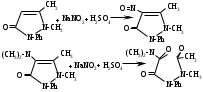 3. Анальгин + резорцин – при нагревании – роз-е окр-е. (Ауриновый краситель) 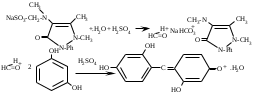 1,4-бензодиазепины Сибазон - Sibazonum (Диазепам, Седуксен, Валиум) 7-хлор-5-фенил-1-метил-1,2-дигидро-3Н-1,4-бенздиазепин-2-он. ЛФ - табл., растворы  Нитразепам - Nitrazepamum 7-нитро-5-фенил-3Н-1,4-бенздиазпин-2-он Соединение окрашено - за счет нитрогруппы.  Оксазепам - Oxazepamum (Тазепам, Назепам) 7-хлор-5-фенил-3-гидрокси-1,2-дигидро-3Н-1,4-бенздиазепин-2-он. ЛФ - табл.  Феназепам - Phenazepamum 7-бром-5-(о-хлорфенил)-3Н-1,2-дигидро-1,4-бенздиазепин-2-он.  ЛФ - табл., 0,1% р-р для инъекций. ЛФ - табл., 0,1% р-р для инъекций. В большинстве препаратов присутствует амидная связь кислотные свойства. Наличие азометиновой связи в положении 4 - 5. Фенильный радикал - азометиновая связь ковалентно связанный галоген или нитрогруппа в 7 положении. Tox знач-е: транквилизаторы, снотворные, д/леч-я алкоголизма, пр/судорожные. Отравление: передозировка, суицид, в соч-ии с наркотиками. Стадии отр-я: 1. сонливость, слюнотеч-е, 2. ум-е сухожильных рефлексов, 3. глубокая кома, шок, 4. посткоматозное сост-е, различн осложнения. ПДП: форсированный диурез, гемодиализ, в/в ССС. Изолирование: Стаса-Отто или Васильевой. М.б. в кислом и щелочном CHCl3 извл-ях. Анализ: 1. по продуктам метаболизма: а) б/м настаивают с подкисленной водой или спиртом, экстрагируют CHCl3, к водному слою доб-т NH4OH до pH=9-10, снова экстр-т CHCl3. CHCl3 объед-т, выпаривают досуха, сух-й ост-к подвергают гидролизу H2SO4 или HCl. б) б/ж + HCl или H2SO4 (г-з) до бензофенонов. Идентификация: 1. ТСХ по продуктам метаболизма (см выше) или по нативной мол-ле: детекция р-вом Драгендорфа. Система: толуол:ацетон:аммиак 1. сух остаток + 1-3 кап HClк – желтое окрашивание  Возможно получение азокрасителя (р-я Братона-Маршала): Применяется как реакция подлинности. СФМ в виде области спектра (азокраситель). К.О.: 1. после ТСХ с пластинки элюируют ацетонитрилом, испаряют, к сух-у ост-ку гептан и иссл-т м-дом ГЖХ и кач-но и кол-но. 2. ВЖХ – УФ детекция. 3. УФ спектроскопия в EtOH. 4. ФКМ по р-ии Братона-Маршала. 5. Анализ по нативной мол-ле: изол-е общее (Стас-Отто, Васильева), экстр-т CHCl3, pH=10, очистка м-м ТСХ, элюируют с пластинки и вновь наносят на пластинку со свидетелями. Обр-т HClр, в термостат, + р-р NaNO3 в HCl, удал-м изб NaNO2 cульфонатом аммония, обр-м α-нафтилэтиленамином – в местах локализации – окраш-е Производные пурина. Coffeinum 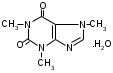 Theophyllinum 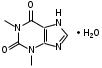 Theobrominum 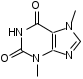 Теофиллин и теобромин за счет незамещенного водорода при N проявляют свойства кислот – амфотерные соединения. М.б. в кислом и щелочном CHCl3 извл-ии. 1. Групповая реакция – мурексидная проба – к сух ост-ку в фарф ч доб Br2 aq, нагреваем досуха, обр-м парами аммиака – пурп-фиол-е окр-е.  Кофеин: Р-р в CHCl3 – испаряем – кр-лы в виде % Теофиллин: В фарф ч-ке к сух ост-ку 30% NaOH, нагреваем, охл-м, доб 1 мл воды (р-р А). в др фарф ч стрептоцид + HCl + NaNO2 (р-р Б). р-р Б приливают к р-ру А – красное окр-е. теобромин: 1. Кобальтовые соли. Препарат + 0,1M NaOH, отфильтровывают, добавляют CoCl3 (Co(NO3)3). Теофиллин белый с розовым оттенком Теобромин фиолетовый раствор серо-голубой Теофиллин в присутствии NH4OH + CoCl3 фиолетовый раствор. Теобромин не взаимодействует. 2. Серебряные соли. Препарат растворяют в смеси H2O и NaOH, добавляют раствор NH4OH и AgNO3. Теобромин: образуется густая, желатинообразная масса, которая разжижается при нагревании и густеет при охлаждении. Теофиллин: белый осадок. 3. ИК спектр Теофиллин – НеГФ: 1. Азокраситель (см. выше). 2. Со щелочным раствором нитропруссида натрия зеленое окрашивание. Применение: Кофеин – стимулятор ЦНС, кардиотонический. Теофиллин и теобромин – сосудорасширяющее, бронхорасширяющее, диуретическое, спазмолитик. ПАПАВЕРИН. ДИМЕДРОЛ ХИНИН  Tox знч-е: спазмолитик, оказ-т сосудорасшир-е д-е. Исп при бронх-й астме и с др ЛП. Мет-м: ____________________________. Изол-е: част-й – Кромаренко, общ – Стас-Отто и Васильевой. Слаб-е основание – м.б как в кислом, так и в щелочном извл-ии. Идент-я: 1. ТСХ (х/ф:ацетон:диэтиламин), детекция – р-в Марки или Драгендорфа 2. УФ спектроскопия 3. цв р-ии с р-вами Марки, Фреде, Драгендорфа. 4. с общеAlk р-вами 5. микрокрист-я р-я с CdCl2 – кр-лы в форме квадратов, наложенных др на др. К.О. Экстр-я ФКМ с люб Ind, дающим ионные ассоциаты. ГЖХ, ВЖХ. ДИМЕДРОЛ 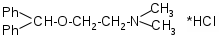 β-диметил-аминоэтилового эфира tox значение – п/гист-й преп-т д/леч-я крапивницы, разл-х форм аллергии, как снотворное и седативное – в форме табл, пор, амп-л. Отравление: сухость во рту, головкр-е, сонл-ть, зрачки расширены, тахикардия, ↓АД, при больших дозах возбужд-е, галлюц-я, судороги, кома. П/помощь: пром-е жел-ка, форсир диурез, гемосорбция, при возб-ии – аминазин в/м, судороги – диазепам в/м. Метаболизм: роисх-т в печени, всас-ся в кровь быстро, метабол-т до бензгидрола и N-диметила аминоэтанола. Объекты иссл-я: печень, гол мозг, сод-е жел-ка, кровь, моча. Изол-е: б/м – м-д Стаса-Отто, рН = 10; моча, кровь – прямая экстр-я х/ф рН=10. х/ф слой отд-т + р-р HCl (димедрол в виде соли в водный слой). х/ф отбр-т. К водному слою + р-р NaOH до рН = 10 и вновь х/ф. Идент-я: 1. ТСХ – идент-я и очистка. х/ф:ацетон:NH3. Детекция: кH2SO4 – желтое пятно димедрола и бензгидрола (метаболит) или коричн – обраб-м парами J2 или р-вом Драгендорфа. 2. с общеАlk р-вами: р-в Драгендорфа, Майера (желт), Вагнера (кр-коричн). 3. р-в Марки (желт со временем перех-й в шоколадн); с кH2SO4 (лимонно-желт, исчез при доб воды); р-в Фреде (ярко-желт, перех в кр-оранж); 4. Микрокрист-е р-ии 5. УФ-спектроскопия этанол:HCl в ВО 6. ГЖХ - ДИП 7. ВЖХ – по абсолют и относит расстоянию и времени удерж-я. 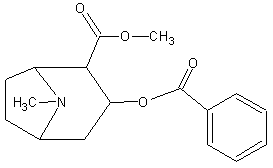 К.О.: 1. УФ-спектроскопия с РСО 2. По р-ии с H2SO4, далее по калибровочному гр-ку 3. ВЖХ. К.О.: 1. УФ-спектроскопия с РСО 2. По р-ии с H2SO4, далее по калибровочному гр-ку 3. ВЖХ.ХИНИН талейохинная проба – в лекциях  2. микрокрист-я р-я – (с роданидом аммония)  |
