ТОКСИКОЛОГИЯ – ПРЕДМЕТ И ЗАДАЧИ, ОСОБЕННОСТИ ХИМИКО-ТОКС АНАЛИЗА. 1. токсикология предмет и задачи, особенности химикотокс анализа токсическая химия
 Скачать 1.06 Mb. Скачать 1.06 Mb.
|
Папаверин1. с р-вом Марки – вишнево-кр 2. с к.HNO3 – желт-оранж 3. H2SO4 – сине-фиол 4. микрокрист-я – см рисунки. АЛКАЛОИДЫ ПРОИЗВОДНЫЕ ТРОПАНА  Токсическое значение: при язвенной болезни, бронх.астме, в глазной практике, скополамин как противорвотное и успокоительное. Отравление: возбуждение, галлюцинации, ↓АД, судороги. Первая помощь: промывание желудка марганцовкой, активированный уголь, форсированный диурез, гемосорбция, седуксен (в/в). Метаболизм: 50% выводится с мочой в неизменном виде, 2% в моче составляет тропановая кислота. Т ½ = 40-70’, N-диметилирование. Изолирование: общие методы, частный метод Кромаренко. (б/м рН=9-12, б/ж экстракция CHCl3 при этих же рН) Идентификация: 1) ТСХ 2) УФ- ИК-спектр 3)ГЖХ, ВЭЖХ. 4) с р-вом Витали-Морена.  5) с n-диметиламидомбензальдегидом в присутствии серной кислоты: красное вишневое фиолетовое 6) микрокристаллическая реакция с солью Рейнека – кристаллы ромбовидной формы. Кокаин рКВН+=8,6. Качественное обнаружение. 1.С общеалкалоидными реактивами (Бушарда, Майера, Драгендорфа). 2.Образование бензойно-этилового эфира. 3.С KMnO4 (красно-фиолетовые пластинки). 4.С Na2PbCu (NO2)6 (кристаллы в виде трехгранных призм изумрудно-зеленого цвета). 5.С платинохлористоводородной кислотой (H2PtCl6) − светло-желтые кристаллы. Токсикология: местно анестезирующее средство. Недостаток − привыкание. Токсичен. Смертельная доза − 0,1-0,3 г. Быстро разрушается в организме, поэтому в моче трудно обнаружить. Основные метаболиты − бензоилэкгонин (около 50% выделяется с мочой) метиловый эфир экгонина, экгонин, норкокаин (фармакологически активный). Кокаин обнаруживается в трупе только через непродолжительное время после наступления смерти. Максимальные сроки обнаружения не превышают 3-х недель. Ациклические алкалоиды (эфедрин). Токсикологическое значение, изолирование, анализ.Эфедрин.  рК вн + = 9,6 Методы изолирования: Объект исследования – моча. Изолирование проводят жидкость-жидкостной экстракцией хлороформом (рН 12). Качественные реакции: С реактивом Драгендорфа (кислотный р-р KBiI4). Сух. остаток + 0,1М НСI+ реактив - характерные кристаллы. 2. С солями меди и сероуглеродом: исслед. р-р, подкисленный уксусной к-той + 5% р-р CuSO4 +NaOHдо щелоч. реакции + смесьCS2 и бензола - бензольный слой имеет коричневую окраску: 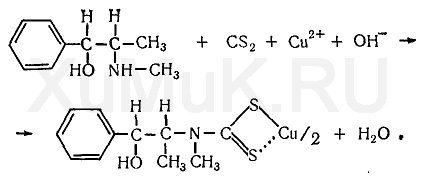 Реакция с 2,4- динитрохлорбензолом: эфирный р-р исслед. в-ва + NaOH+ спирт. р-р 2,4-динитрохлорбензола,t– желто-корич. окраска + хлороформ + уксусная к-та – хлороформ. слой желтеет. 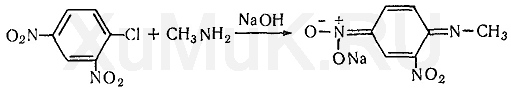 В химико-токсикологическом анализе эфедрина и других фенилалкиламинов (эфедрон, фенилпропаноламин, амфетамин) применяется ВЭЖХ. Токсикологическое значение:Стимулируетα- иβ-адренорецепторы: сужение сосудов, повышение артериального давления, расширение бронхов, зрачков, торможение перистальтики кишечника. Применяют при бронхиальной астме, крапивнице, ринитах. Эфедрин быстро всасывается и накапливается в печени, почках, легких, мозге. Выводится с мочой через 24 часа около 80% введенной дозы. Главный путь метаболизма – N- деметилирование с образованием фенилпропаноламина. 18. ВЕЩЕСТВА, ИЗОЛИРУЕМЫЕ ИЗ ИССЛЕДУЕМЫХ ОБЪЕКТОВ НАСТАИВАНИЕМ С ВОДОЙ С ПОСЛЕДУЮЩИМ ДИАЛИЗОМ. Соляная кислота, Серная кислота, Азотная кислота. Уксусная кислота, Щавелевая. Щелочи: едкие и карбонатные Мин.соли: нитриты, нитраты, гипохлораты, хлораты. Определяют рН водной вытяжки: если сильно кислая проводят исследования на кислоты, если щелочная определяют едкие и карбонатные щелочи, нитриты, нитраты. Изолирование: Настаивание с водой Объект измельчают, заливают водой до кашеобразного состояния и настаивают 1-2 часа. Фильтруют с помощью водоструйного насоса, центрифугируют. Для более полного освобождения водной вытяжки от белков проводят диализ. Диализ выполняют 2-3 раза в течение 4-6 часов, диализаты объединяют и упаривают Обнаружение кислот: СЕРНАЯ КИСЛОТА Изолирование – диализ. Идентификация: 1) с хлоридом бария 2) с ацетатом свинца белый осадок 3) с родизонатом натрия обесцвечивание. 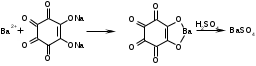 Количественное определение: 1) титрование р-ром NaOH гравиметрия по BaSO4 АЗОТНАЯ КИСЛОТА Изолирование: диализат подвергается перегонке досуха в присутствии Cu опилок: 2HNO3 + 3Cu 2NO + 3CuO + H2O 6HNO3 + 3CuO 3 Cu(NO3)2 + 3 H2O 2NO + O2 2 NO2 (оранжевые пары) 2 NO2 + H2O HNO3 + HNO2 Идентификация: 1) с дифениламином в серной кислоте синее окрашивание. 2) ксанто-протеиновый реактив: диализат выпаривают с шерстяными нитками желтое окр-е оранж окрашивание(при добавлении аммиака) 3)с бруцином в серной кислоте красное окрашивание ХЛОРИСТОВОДОРОДНАЯ КИСЛОТА Диализат перегоняют досуха. Идентификация: 1) С нитратом серебра 2) 6HCl + KClO3 3 Cl2 + KCl + 3 H2O Cl2 + KJ J2 + 3 KCl Посинение J-крахмальной бумажки. ОБНАРУЖЕНИЕ ЩЕЛОЧЕЙ КОН 1) Диализат нейтрализуют уксусной кислотой до слабо кислой среды, проводят реакцию с гидротартратом Na белый крист ↓, растворимый в горячей воде. 2) С гексанитрокобальтитом 2KOH + Na3[Co(NO2)6] K2Na[Co(NO2)6]↓ + 2 NaOH NaOH 1) гидролизат нейтрализуют уксусной кислотой + гидроксистиьбиат К KH2SbO4 + NaOH NaH2SbO4↓ белые кристаллы, растворимые в горячей воде. 2) с цинкуранилацетатом в уксуснокислой среде(белый осадок): NaOH + Zn[(UO2)3(CH3COO)8] +CH3COOH NaZn[(UO2)3(CH3COOH)9] NH4OH Перед тем как исследовать на аммиак, проверяют свежесть б/м. Затем проводят реакцию с р-вом Несслера оранж-коричн ↓. ОПРЕДЕЛЕНИЕ НИТРАТОВ И НИТРИТОВ Изолирование проводят диализом. Не перегоняют соли данных соединений. Идентификация: 1) С помощью J-крахмальной бумажки: +1кап.HCl 1% + 3-4 кап.нейтраль.диализата посинение бумажки. 2) С реак-вом Грисса (1% сульфоновая к-та в 30% укс. к-те, 0,1% α-нафтиламина в 30% УК). 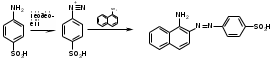 20.ОПРЕДЕЛЕНИЕ КАРБОКСИГЕМОГЛОБИНА В КРОВИ СО не требует специальных методов изолирования, работают с мышечной тканью в случае пожара (нет крови) или с кровью. Образуется при неполном сгорании древесины, м.б. обнаружен в выхлопных газах машин (13%), в табачном дыму (1%). CO является кровяным ядом, проникает через дыхательные пути и связывается с Hb крови, образуя довольно прочные соединения. Сродство СО к Hb в 300 раз выше, чем у кислорода. В крови лиц, отравленных СО содержится дезоксигемоглобин, оксигемоглобин, карбоксигемоглобин, а также может содержаться некоторое количество метгемоглобина, который при отравлениях СО не связывается с оксидом углерода. В тканях мышц лиц с подозрением на отравление СО содержится дезоксимиоHb (МHb), оксимиоHb (ОМHb), карбоксимиоHb (COMHb), Смертельная концентрация СО в крови >60%. Идентификация: 1. Химические методы. Берется ярко-красная кровь или мышечная ткань.
а) При помощи спектроскопа (прибор для визуальной спектроскопической диагностики). Исследуемую кровь разводят водой до светло-розовой окраски и смотрят ее спектр. При этом спектр крови, содержащей дезоксиHb имеет одну широкую полосу при 550 нм. Спектр оксигемоглабина содержит две полосы при 557-589 нм и при 536-556 нм. б) Основной метод – СФМ. 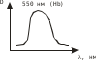 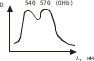 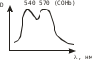 Берут исследуемую кровь и смотрят – 2 пика. Добавляют дитионит Na. Если сохраняются 2 пика, то отравление было (COHb не восстанавливается), а если они сливаются в один, то отравления угарным газом не было (OHb восстанавливается). Количественное определение: Газохроматографическое определение. В пенициллиновый флакон помещают 2,5 мл крови + 0,5 мл к.H2SO4 и 1,0 феррацианида калия. Закрывают резиновой пробкой, фиксируют (под обкатку), встряхивают 30 секунд, отбирают газовую фазу и вводят в хроматограф. На хроматограмме 2 пика – воздуха и CO. Определяют по времени удерживания. ПЕСТИЦИДЫ Ядохимикаты (пестициды) – химические вещества различной природы, применяемые в народном хозяйстве для защиты растений и животных от вредителей и болезней Классификация По хим природе: соединения неорг природы (серы, соли меди, As, Hg, Se, производные фтористых и кремнефтористых кислот) Соединения органической природы (хлорорганика, ФОС, пр.карбаминовой кислоты (севин), пр.фенола, орг.соединения.ртути). По назначению: Акалициды (борьба с клещами) Альгициды (водоросли, вод.растения) Антисептики (обработка древесины) Арборициды (учитожение нежелат.древесн. и кустар. растений) Инсектициды (насекомые) Гербициды (сорные травянистые растения) Фунгициды (грибковые организмы) По пути поступления ядов в организм насекомых: контактного действия кишечного действия системного действия фумиганты По действию на организм растения: Гербициды контактного действия Системного действия Через корневую систему или проросшие семена. По токсичности: Высокотоксичные Среднетоксичные Малотоксичные ФОСФОРОРГАНИЧЕСКИЕ ЯДОХИМИКАТЫ Могут вызывать хронические отравления. Нарушения ф-ции печени, ССС. Пути поступления: ингаляционный, пероральный, ч/з кожу. Производные алкилфосфорной кислоты ХЛОРОФОС 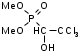 Производные фосфорной кислоты ДИХЛОФОС 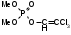 Производные тиофосфорной кислоты МЕТАФОС 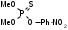 ТРИХЛОРМЕТАФОС  Производные дитиофосфорной кислоты КАРБОФОС 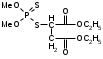 Токсическое действие на организм: Основные симптомы из-за нарушения действия АХЭ: Беспокойство, мышечные подергивания, затрудненное дыхание, судороги, саливация, бронхоспазмы. Первая помощь: промывание желудка, солевое слабительное, форсированный диурез, подкожно атропин до сухости во рту, переливание крови. Предварительные испытания: Холинэстеразная проба: [(CH3)3-N-CH2-CH2O-C(O)-CH3]OH + ХЭ [(CH3)3-N-CH2-CH2OН]OH + CH3COOH  Фермент ХЭ инактивируется и АХ накапливается в организме. ХЭ-проба с использованием индикаторной смеси: берут 2 пробирки или фарфоровые чашки. 1 пробирка – исследуемая кровь или жидкость из б/м; 2 – контроль. В 1-ую помещают плазму исследуемой крови, индикатор – буферная смесь (БТС ил БФС), во 2-ую помещают лошадиную сыворотку (или сам фермент ХЭ) + инд.буф.смесь. В обе пробирки добавляют АХ и термост. В теч 30’ при t = 37ºС. Сравнивают окраски. В контроле : красная желтая, в опыте: первоначальная окраска сохраняется. Общие исследования на ФОС 1) ТСХ-скрининг ФОС Изолирование: б/м измельчают и заливают смесью ацетон : этанол : вода (2:2:1). Подкисляют щавелевой кислотой до рН=4,5. Настаивают в течение 4 часов при перемешивании. Извлечение сливают, фильтруют. От жиров освобождаются вымораживанием. Затем экстрагируем х/формом, предварительно водяную фазу насыщают 25% р-ром NaCl. Экстрагируют дважды, обесцвечивают извлечение активированным углем. Обнаружение фосфора в извлечении: Извлечение подвергают минерализации смесью 2-х кислот или смесью Na2CO3 и пероксида Na. Минерализат исследуют на Р. Р-ции (см. фосфид цинка). Газохроматографическое исследование ФОС: Используют высокополярные жидкие фазы (силикон ХЕ-60, хроматон). Детектор: селективный термоионный. Частные методы обнаружения ФОС: Хлорофос и дихлофос. Метаболитом хлорофоса явл дихлофос (гидролиз в кислой или щелочной среде). Дихлофос метаболизируется до диалкилфосфорной к-ты и дихлоруксусного альдегида. 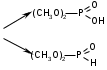 Изолирование: б/м измельчают и заливают водой, подкисляют серной кислотой до рН=2-3. Процеживают. Процесс повторяют 2 раза. Вытяжку объединяют, центрифугируют и извлекают CHCl3. Из б/ж проводят прямую экстракцию при рН=2-3. Качественный анализ: На хлорорганику а) Р-ция Фудживаро: при t со спиртовым р-ром NaOH в присутствии пиридина появляется красн окрашивание. б) р-ция с резорцином в щелочной среде. в) образование изонитрила г) отщепление орг связанного хлора. 2) На альдегид а) р-ция с ацетоном: к извлечению + ацетон и NaOH спиртовой. В течение 5-15’ наблюдаем розовое оранж окрашивание. б) р-ция с 2,4-динитрофенилгидразином: к сухому остатку + 2к NaOH. Выдерживают 20’ + р-р 2,4-ДНФГ в HCl и t на вод бане 30’ + 1к NaOH. Синее или сине-фиолетовое окрашивание. 3) На всю молекулу ФОС. а) с ортотолидином: к сухому остатку + р-р ортотолидина в ацетоне + 1мл Н2О2 + 1мл NaOH желтое окрашивание. б) ТСХ Система: гексан : ацетон (1:1) Проявитель : резорцин в щелочной среде (красный) К.О. 1) ФЭК по р-ции с 2,4-ДНФГ Метафос Оказывает действие на ХЭ, но также характерно образование MetHb. 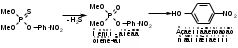 Изолирование: Б/м измельчают + 50мл гексана в присутствии б/в Na2SO4. Настаивают 12ч. при перемешивании. Жидкость сливают, фильтруют. Настаивают дважды. Извлечения объединяют, упаривают. Подвергают очистке: реэкстракция диметилформамидом, насыщенным гексаном. ТСХ-ая очистка: Пластинка для ТСХ. В одну точку помещается метка к-либо вещества и затем наносят извлечение. Хроматографируют в системе. Зона с меткой проявляется. Затем счищается пятно исследуемого вещества. Этот сорбент обрабатывают р-ром гексан : ацетон (1:1), фильтруют, растворитель упаривают, сухой остаток подвергают исследованию. Качественный анализ: 1) Р-ция с PdCl2 желто-коричн окраш-е при t. 2) со спиртовым раствором NaOH (р-ция на п-нитрофенол) желтое окрашивание. 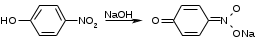 3) ТСХ Система: бензол Проявитель: PdCl2 при t, NaOH спиртовой. Карбофос Инсектицид и арборецид Угнетает АХЭ, но возможно активность проявляют продукты метаболизма. Метаболизируются до кислородных производных:  малооксон малооксонИзолирование: б/м измельчают и заливают 50мл воды и 100мл CHCl3. Смесь взбалтывают и настаивают в течение 2-4ч. при перемешивании. Сливают, повторяют 2 раза, вытяжки объединяют и упаривают. Реакции идентификации: 1) К сух остатку + неск капель р-ва Марки – оранж темно-коричн окрашивание. 2)Сух остаток + NaOH сп, t на вод бане. Подкисляем H2SO4 до рН=4-5, CHCl3 b CuSO4. Встряхивают и наблюдают зел-желт окрашивание х/формного слоя. 3)Р_ция диазотирования сульфаниловой кислотой. В щелочной среде – вишнево-красное. 4)С PdCl2 – желто-коричн окрашивание. 5) ТСХ Растворители: гексан 6 ацетон (2:1) Гексан : диэтиловый эфир (1:2) Проявители: PdCl2; БФС и AgNO3. t в течение 20’ при 60ºС + р-р лимонной или уксусной кислоты. Наблюдаем лиловые пятна на желтом фоне. К.О. После минерализации по H3PO4. |
