2. Строение и функции белков
 Скачать 0.73 Mb. Скачать 0.73 Mb.
|
|
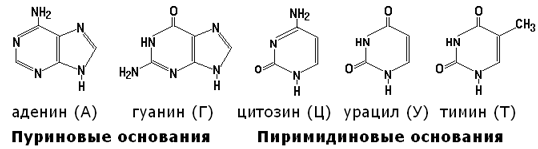
Источники витамина Е для человека - растительные масла, салат, капуста, семена злаков, сливочное масло, яичный желток. Биологическая роль. По механизму действия токоферол является биологическим антиоксидантом. Он ингибирует свободнорадикальные реакции в клетках и таким образом препятствует развитию цепных реакций перекисного окисления ненасыщенных жирных кислот в липидах биологических мембран и других молекул, например ДНК . Токоферол повышает биологическую активность витамина А, защищая от окисления ненасыщенную боковую цепь. Клинические проявления недостаточности витамина Е у человека до конца не изучены. Известно положительное влияние витамина Е при лечении нарушения процесса оплодотворения, при повторяющихся непроизвольных абортах, некоторых форм мышечной слабости и дистрофии. Показано применение витамина Е для недоношенных детей и детей, находящихся на искусственном вскармливании, так как в коровьем молоке в 10 раз меньше витамина Е, чем в женском. Дефицит витамина Е проявляется развитием гемолитической анемии, возможно из-за разрушения мембран эритроцитов в результате ПОЛ. Витамины К (нафтохиноны) Витамин К существует в нескольких формах в растениях как филлохинон (К1), в клетках кишечной флоры как менахинон (К2). Источники витамина К - растительные (капуста, шпинат, корнеплоды и фрукты) и животные (печень) продукты. Кроме того, он синтезируется микрофлорой кишечника. Обычно авитаминоз К развивается вследствие 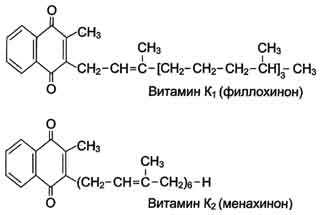 нарушения всасывания витамина К в кишечнике, а не в результате его отсутствия в пище. Суточная потребность в витамине взрослого составляет 1-2 мг. Биологическая функция витамина К связана с его участием в процессе свёртывания крови . Он участвует в активации факторов свёртывания крови: протромбина (фактор II), проконвертина (фактор VII), фактора Кристмаса (фактор IX) и фактора Стюарта (фактор X). Эти белковые факторы синтезируются как неактивные предшественники. Один из этапов активации - их карбокси-лирование по остаткам глутаминовой кислоты с образованием у-карбоксиглутамино-вой кислоты, необходимой для связывания ионов кальция . Витамин К участвует в реакциях карбоксилирования в качестве кофермента. Для лечения и предупреждения гиповитаминоза К используют синтетические производные нафтохинона: менадион, викасол, синкавит. Основное проявление авитаминоза К - сильное кровотечение, часто приводящее к шоку и гибели организма. 24.Ферменты, строение, биологическая роль. Отличия от биологических. Ферменты или энзимы – это вещества белковой природы, участвующие в разнообразных химических превращениях.По строению ферменты могут быть простыми (протеины) и сложными (протеиды). Отличие от белков!Молекулы простых ферментов при гидролизе расщепляются до аминокислот. По химическим свойствам простые ферменты относятся к альбуминам (эстераза печени), глобулинам (трипсин и уреаза). Простыми ферментами являются также многие гидролазы пищеварительного тракта, РНК-аза, ДНК- аза и другие. Большинство ферментов являются сложными белками.  «Белковая часть» – Апофермент  Фермент Холефермент  «Простетическая группа», «Кофермент» – Коэнзим (прочно связана) (непрочно связан) Различия между ферментами и неорганическими катализаторами. Различия: Ферменты действуют при определенных t, pH среды, давлении, а неорганические катализаторы действуют при высоких t, pH среды и давлении; В отличие от неорганических катализаторов проявляют высокую специфичность (абсолютная, относительная, стереохимическая); Биологические катализаторы в организме образуются в виде проферментов (пепсин, трипсин и т.д.). 25. Свойства ферментов: термолабильность, влияние рН среды. Термолабильность – связана с белковой природой ферментов. Оптимум действия ферментов лежит в интервале t тела (37-40°). Высокая температура действует на ферменты разрушающе, низкая замедляет ферментативный процесс (лабораторная работа). Высокая чувствительность к рH среды. Оптимум активности для многих ферментов наблюдается в изоточке. Только пепсин при рН 1,5 – 2 и амилаза поджелудочного сока – рН 8. 26.Активность ферментов. Влияние различных факторов на активность ферментов. 1. Биологические: вид (животное), если человек, то учитывается пол и возраст, физиологическое состояние организма, условия питания, окружающая среда и эмоциональные факторы. 2. Физико-химические: концентрация фермента и, главным образом, субстрата, температуры, рН и ингибиторы. Наибольший клинический интерес представляет температура, рН и ингибиторы. 1). Концентрация субстрата При низкой концентрации субстрата и последующем её увеличении зависимость между [субстрата] и V прямо пропорциональна. Дальнейшее увеличение концентрации субстрата приводит к снижению скорости, и наконец, наступает такое значение концентрации субстрата, после которой скорость ферментативной реакции остаётся неизменной. Это называется эффектом насыщения фермента субстратом. Для характеристики кинетики в ферментативных реакциях была вычислена константа Михаэлиса - Ментен, которая выражается: Km= (E)*(S)-(ES)/(ES) По сути дела Km составляет l/2Vmax . Для того, чтобы определить скорость реакции можно пользоваться уравнением: V=Vmax*(S)/(S)+Km Концентрация фермента не оказывает влияния на процесс. Ферменты имеют белковую природу и являются термолабильными. В некотором ограническом интервале температур (от 0°до 25° С) скорость ферментативной реакции повышается, с ростом температуры (на 10°С) скорость повышается примерно в 2 раза. При дальнейшем повышении температуры скорость реакции постепенно понижается, высокие температуры приводят к денатурации фермента - белка и необратимой утрате ферментативной активности. Для большинства ферментов оптимум температурный приближается к нормальной температуре тела. В первые часы повышенной температуры вырабатывается фермент интерферон, выполняющий защитные функции. Пониженные температуры используют в трансплантации, искусственном оплодотворении. Растительные ферменты менее чувствительны к температуре. 3). Влияние рН на активность ферментов. а) значение рН, которое соответствует максимальной активности фермента, необязательно совпадает со значением рН, характерным для нормального внутри - и внеклеточного окружения этого фермента; б) всё-таки большинство ферментов имеют оптимум рН, близкий к рН окружающей среды; в) у многих ферментов оптимум рН приближается к ИЭТ; г) для каждого фермента существует своё значение рН, при котором он проявляет максимальную активность; д) «Значение рН внутри клетки является, возможно, одним из самых важных элементов регуляции клеточного метаболизма». Активирование или ингибирование различных ферментов веществами эндогенного и экзогенного происхождения является значимым фактором регуляции обмена веществ. Ингибиторы подразделяются на обратимые и необратимые. В свою очередь обратимое ингибирование бывает 3-ёх видов: аллостерическое, конкурентное и неконкурентное. Примером необратимого ингибирования может быть действие высоких температур, резкое изменение рН, приводящее к денатурации фермента или действие тяжёлых металлов, соединений мышьяка, которые связываются с ферментом или с фермент-субстратным комплексом в АЦ или блокируют функциональные группы молекул фермента, удаленных от АЦ. В наибольшей степени ингибирующему действию тяжелых металлов подвергаются тиоловые ферменты. Специфичность ферментов. Каждый фермент действует на вполне определенный субстрат или же определенный тип связи в молекуле. Специфичность бывает: Абсолютная специфичность фермента – это, когда данный фермент действует только строго на определенный субстрат. NH2 – CО – NH2 Уреаза 2NH3 + CO2  Есть ферменты и более широкого спектра действия (пепсин, трипсин, липаза). Относительная специфичность – это, когда фермент действует на группу сходных по своей структуре веществ или определенный тип связи. Стереохимическая специфичность – это, когда фермент действует либо на D или L аминокислоты или на транс- или цис-изомеры. Так фумараза действует только на транс-форму фумаровой кислоты и не действует на цис-форму. 28. Изоферменты. Иммобилизованные ферменты. Изоферменты – это множественные формы одного фермента, катализирующие одну и ту же реакцию, но отличающие по физическим и химическим свойствам (сродству к субстрату, максимальной скорости катализируемой реакции, электрофоретической подвижности, оптимуму рН и термостабильности). Изоферменты имеют четвертичную структуру, которая образована четным количеством субъединиц.Изоформы фермента образуются в результате различных комбинаций субъединиц.В качестве примера можно рассмотреть лактатдегидрогеназу (ЛДГ), фермент, который катализирует обратимую реакцию: НАДН2 НАД+ пируват ←ЛДГ→ лактат ЛДГ существует в виде 5 изоформ, каждая из которых состоит из 4-х протомеров (субъединиц) 2 типов М (muscle) и Н (heart). Синтез протомеров М и Н типа кодируется двумя разными генетическими локусами. Изоферменты ЛДГ различаются на уровне четвертичной структуры: ЛДГ1 (НННН), ЛДГ2(НННМ), ЛДГ3 (ННММ), ЛДГ4 (НМММ), ЛДГ5 (ММММ). Полипептидные цепи Н и М типа имеют одинаковую молекулярную массу, но в составе первых преобладают карбоновые аминокислоты, последних – диаминокислоты, поэтому они несут разный заряд и могут быть разделены методом электрофореза. Кислородный обмен в тканях влияет на изоферментный состав ЛДГ. Где доминирует аэробный обмен, там преобладают ЛДГ1, ЛДГ2 (миокард, надпочечники), где анаэробный обмен - ЛДГ4, ЛДГ5(скелетная мускулатура, печень). В процессе индивидуального развития организма в тканях происходит изменение содержания кислорода и изоформ ЛДГ. У зародыша преобладают ЛДГ4, ЛДГ5. После рождения в некоторых тканях происходит увеличение содержания ЛДГ1, ЛДГ2. Существование изоформ повышает адаптационную возможность тканей, органов, организма в целом к меняющимся условиям. По изменению изоферментного состава оценивают метаболическое состояние органов и тканей. 29. Ингибирование ферментов. Конкурентное и неконкурентное торможение. Под термином "ингибирование ферментативной активности" понимают снижение каталитической активности в присутствии определённых веществ - ингибиторов. К ингибиторам следует относить вещества, вызывающие снижение активности фермента. Обратимое ингибирование Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными. 1. Конкурентное ингибирование К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется (рис. 2-21). 102 Для конкурентного типа ингибирования справедливы следующие уравнения: Е + S ⇔ ES → E + P, E + I ⇔ EI. Классический пример конкурентного ингибирования - ингибирование сукцинатдегидрогеназ-ной реакции малоновой кислотой (рис. 2-22). Малоновая кислота - структурный аналог сукцината (наличие двух карбоксильных групп) и может также взаимодействовать с активным центром сукци-нат дегидрогеназы. Однако отщепление двух атомов водорода от малоновой кислоты невозможно; следовательно, скорость реакции снижается. 2. Неконкурентное ингибирование Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра (рис. 2-24). Неконкурентные ингибиторы не являются структурными аналогами субстрата. Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции. 34.Нуклеиновые кислоты. Биологическая роль. Отличия ДНК и РНК. Нуклеиновыми кислотами или полинуклеотидами называются высокомолекулярные вещества, состоящие из нуклеотидов, соединённых в цепь 3', 5'-фосфодиэфирными связями. Каждый нуклеотид состоит из азотистого основания, углевода (пентозы) и остатка фосфорной кислоты. Биологическая роль: ДНК обеспечивает хранение и передачу генетической информации из поколения в поколение. Участок молекулы ДНК, кодирующий первичную структуру полипептида, молекулы транспортной или рибосомной РНК, называется геном. Реализация наследственной информации осуществляется с участием (РНК). Отличие ДНК и РНК: В состав ДНК входят дезоксирибонуклеотиды, в состав РНК – рибонуклеотиды. Азотистые основания в молекуле ДНК – тимин, аденин, цитозин, гуанин; в РНК вместо тимина участвует урацил. ДНК является матрицей для транскрипции, она хранит генетическую информацию. РНК участвует в синтезе белка. У ДНК двойная цепь, закрученная по спирали; у РНК – одинарная. ДНК есть в ядре, пластидах, митохондриях; РНК – образуется в цитоплазме, в рибосомах, в ядре, собственная РНК есть в пластидах и митохондриях. 35. Строение нуклеиновых кислот.
4.1.3. Нуклеотиды представляют собой фосфорилированные нуклеозиды. Остаток фосфорной кислоты, как правило, присоединяется к гидроксильной группе пентозы в 5'-положении при помощи сложноэфирной связи. Примеры: В клетках встречаются также нуклеозиддифосфаты и нуклеозидтрифосфаты, содержащие соответственно два и три остатка фосфорной кислоты. Биологическая роль этих соединений будет рассматриваться в дальнейшем. 36. Вторичная и третичная структура ДНК и РНК. Структура рибонуклеиновых кислот (РНК) Первичная структура РНК - порядок чередования рибонуклеозидмонофосфатов (НМФ) в полинуклеотидной цепи . Вторичная структура РНК Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - "шпильки", за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C. Участки цепи РНК в таких спиральных структурах антипараллельны, но не всегда полностью комплементарны, в них встречаются неспаренные нуклеотидные остатки или даже одноцепочечные петли, не вписьюающиеся в двойную спираль. Наличие спирализованных участков характерно для всех типов РНК. Третичная структура РНК Одноцепочечные РНК характеризуются компактной и упорядоченной третичной структурой, возникающей путём взаимодействия спирализованных элементов вторичной структуры. Так, возможно образование дополнительных водородных связей между нуклеотидными остатками, достаточно удалёнными друг от друга, или связей между ОН-группами остатков рибо-зы и основаниями. Третичная структура РНК стабилизирована ионами двухвалентных металлов, например ионами Mg2+, связывающимися не только с фосфатными группами, но и с основаниями. Первичная структура ДНК - порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в полинукпеотидной цепи. Каждая фосфатная группа в полинукпеотидной цепи, за исключением фосфорного остатка на 5'-конце молекулы, участвует в образовании двух эфирных связей с участием 3'- и 5'-углеродных атомов двух соседних дезоксирибоз, поэтому связь между мономерами обозначают 3', 5'-фосфодиэфирной. |