Органика. 3. алифа
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
Оборудование иматериалы ацетон этаналь Ступка, пестик, газоотводная трубка с пробкой, стеклянная лопатка, набор пробирок в штативе. Этанол; керосин или любой другой источник жидких алкенов; сырая нефть; насыщенный раствор бромной воды; 1%-ный раствор перманганата калия; концентрированные кислоты: серная, оксид алюминия; 1 н раствор карбоната натрия; песок. Указанияпотехнике безопасности См. лабораторную работу 1. Указанияпопорядку выполненияработы Опыт № 1. Получение и изучение свойств этилена to    CH3 CH2 OH H SO CH3 CH2 OH H SO CH2 CH2 + H2O CH2 CH2 + H2O2 4
   4 [O] CH2 CH2 KMnO CH2 CH2 OH OH Ход работы: В пробирку а(рис. 3) поместите 8 капель концентрированной серной кислоты, 4 капли этилового спирта и несколько крупинок окиси алю- миния А12О3 в качестве катализатора. 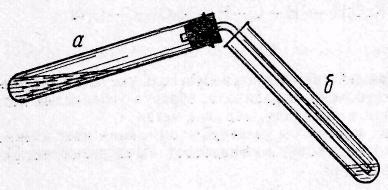 Рис. 2. Получение этилена Рис. 2. Получение этиленаЗакройте пробирку апробкой с газоотводной трубкой и конец ее опу- стите в пробирку б с 4 каплями бромной воды. Нагревайте пробирку ана пла- мени микрогорелки. Убедившись, что бромная вода быстро обесцвечивается, немедленно опустите конец газоотводной трубки в заранее приготовленную пробирку б с 1 каплей 0,1 н КМnО4 и 5 каплями воды. Продолжая нагревание пробирки а,обратите внимание на быстрое обесцвечивание розового раствора марганцовокислого калия. Тотчас же удалите пробирку би подожгите газообразный этилен у конца газоотводной трубки. Убедитесь в том, что он горит, причем горит светящим- ся пламенем. Опыт № 2. Исследовать свойства жидких алкенов.  Br2 Br2CH3 - CH = CH - (CH2)4 - CH3 CH3 - CH - CH - (CH2)4 - CH3 Br Br  CH3 - CH = CH - (CH2)4 - CH3 + KMnO4 + H 2 O CH3 - CH = CH - (CH2)4 - CH3 + KMnO4 + H 2 OCH3 - CH - CH - (CH2)4 - CH3 OH OH + MnO2 + KOH Ход работы: Для опытов с жидкими алкенами можно использовать керо- син или бензин, так как в их состав входят различные непредельные углеводо- роды. В две пробирки наливают по 1 мл керосина (или бензина). В первую про- бирку добавляют несколько капель бромной воды. Полученную смесь, при перемешивании, осторожно нагревают на горячей водяной бане. Наблюдают исчезновение желтой окраски. Во вторую пробирку добавляют раствор перманганата калия, подщело- ченного раствором соды. Фиолетовая окраска раствора исчезает, и появляется бурый хлопьевидный осадок. Опыты по обесцвечиванию бромной воды и раствора перманганата калия провести с сырой нефтью. Контрольные вопросы поусвоениютеоретического материала 1.Какие органические соединения называют углеводородами? 2. Какие углеводороды называют ненасыщенными? Какие гомологические ря- ды ненасыщенных углеводородов вы знаете? 3. Приведите общую формулу этиленовых углеводородов. 4.Какой тип углерод-углеродной связи характерен для этиленовых углеводо- родов? 5.Перечислите возможные способы получения этиленовых углеводородов. Приведите уравнения соответствующих реакций. 6.Опишите химические свойства этиленовых углеводородов. Напишите урав- нения соответствующих реакций. 7. Распишите механизм электрофильного присоединения галогеноводорода к пропилену. 8. Объясните возникновение перекисного эффекта Караша. Приведите пример. Вопросыкзащителабораторнойработы 1. Какова роль концентрированной серной кислоты в реакции получения эти- лена? Ответ подтвердите уравнениями реакций. 2. Как изменяется окраска раствора перманганата калия при пропускании че- рез него этилена? К какому гомологическому ряду относится этилен? Напи- шите уравнение реакции. 3. Как изменяется окраска бромной водой при пропускании через нее этилена? Напишите уравнение реакции. 4. Каков цвет пламени при горении этилена? Почему? Напишите уравнение реакции горения. 5. Можете ли вы утверждать, что в сырой нефти содержатся непредельные уг- леводороды? Литература |
