Органика. 3. алифа
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
3. АЛИФАТИЧЕСКИЕ УГЛЕВОДОРОДЫ: АЛКАНЫ. СПОСОБЫ ПОЛУЧЕНИЯ И ХИМИЧЕСКИЕ СВОЙСТВА. Цельработы.Изучить лабораторные способы получения метана и ознако- миться со свойствами предельных углеводородов. Формируемыекомпетенциипонаправлениюподготовки18.03.01«Химиче- скаятехнология» В результате выполнения лабораторной работы студенты должны: Знать: источники предельных (насыщенных) углеводородов; - типичные способы получения алканов; - характерные особенности Ϭ-связей в органических соединениях; Наоснованиианализаиобобщенияизученной информацииспомощьюис- пользованиязнаний вобласти естественнонаучныхдисциплин Уметь: синтезировать предельные углеводороды из других классов органиче- ских соединений; - на основании строения и состава углеводорода, описать его свойства. Владеть: навыками проведения эксперимента при получении и изучении хи- мических свойств алканов; – навыками составления уравнений реакций, описывающих способы получе- ния и химические свойства алканов. Теоретическаячасть «Алифатические углеводороды» Алифатические углеводороды обра- зуют несколько гомологических рядов, основными из которых являются алка- ны, алкены, алкадиены, алкины. Алканы или предельные углеводороды в сво- их молекулах содержат только σ-связи и для них характерны только реакции замещения, деструкции и окисления. Реакции замещения в алканах протекают под действием галогенов, раз- бавленной азотной кислоты, концентрированной серной кислоты. Общеиз- вестно, что легче всего галогенирование и нитрование протекают по третич- ному углеродному атому, а сульфирование по вторичному, труднее всего – по первичному.  CH4 + Cl2 CH3Cl + HCl CH4 + Cl2 CH3Cl + HClH3C  CH CH3 CH CH3 CH2 CH2CH3 + HNO3  140 o С 140 o С(разб)  H3C H3CNO2   С С CH CH CH2 CH2   + 3 CH H O 2 3  CH3-(CH2)7-CH2-CH3 CH3-(CH2)7-CH2-CH3декан H2SO4 дым  CH3 CH3 (CH2)7 (CH2)7  CH SO3H CH SO3HCH3 Реакции замещения у алканов на свету или под действием высоких тем- ператур протекает по цепному радикальному механизму и является типичным примером радикального замещения (SR). Например. Галогенирование алканов на свету является типичным при- мером радикального замещения (SR). СН4 + Br2 → СН3Br + НBr На первой стадии под влиянием света происходит гомолитический раз- рыв связи в молекуле брома и она распадается на два радикала: Br2 2 Br* Атом или молекула подобного типа, содержащие неспаренныйэлектрон, называются свободными радикалами и, как правило, существуют лишь доли секунды, так как мгновенно реагируют с присутствующими веществами. Поэтому на следующей стадии реакции радикал Br• атакует молекулу метана, образуя бромистый водород и углеводородный радикал – метил: СН4 + Br* → НBr + СН3* Образовавшийся органический радикал атакует молекулу брома и реге- нерирует радикал галогена: СН3* + Br2 → СН3Br + Br* Этот процесс может продолжаться бесконечно долго, но на практике те- чение цепных реакций ограничивается так называемыми процессами обрыва цепи, при которых радикалы, реагируя один с другим, выбывают из процесса: Br• + Br• → Br2 CH3• + Br• → CH3Br CH3• + CH3• → CH3-CH3 Кроме того, они могут взаимодействовать с примесями или со стенками сосуда. Оборудование иматериалы Ступка, пестик, газоотводная трубка с пробкой, стеклянная лопатка, набор пробирок в штативе. Обезвоженный ацетат натрия; натронная известь (смесь порошков оксида кальция с гидроксидом натрия ( 3:1); гексан или петролейный эфир; насыщен- ный раствор бромной воды; 1%-ный раствор перманганата калия; концентри- рованные кислоты: соляная, серная, азотная; раствор 5%-ного карбоната натрия; баритовая вода; песок. Указанияпотехнике безопасности См. лабораторную работу 1. Указанияпопорядку выполненияработы Опыт № 1. Получение и изучение свойств метана   CH3 C CH3 CO   +2NaOH CH4 + Na2CO3 +2NaOH CH4 + Na2CO3O Na  CH4 + Br2 CH4 + Br2  4 [O] CH4 KMnO не идёт не идёт 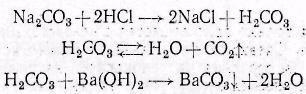 Ход работы: В пробирку, снабженную пробкой с газоотводной трубкой (рис. 2), поместите смесь равных весовых частей обезвоженного (сплавлени- ем) уксуснокислого натрия и натронной извести на высоту около 10 мм. . 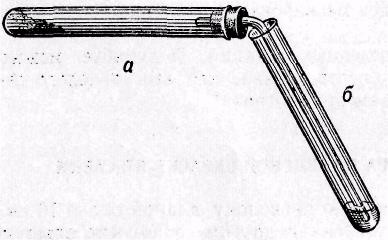 го натрия го натрияРис. 1. Получение метана из уксуснокисло- Держа пробирку в горизонтальном положении, нагрейте ее в пламени мик- рогорелки и подожгите газообразный метан, выделяющийся из отверстия про- бирки (вначале газоотводную трубку можно удалить). Обратите внимание на то, что метан горит несветящимсяпламенем. Иногда оно бывает окрашено в желтый цвет за счет натрия содержащегося в стекле. Не следует путать термин несветящийсястерминомнеокрашенный,т.е. бесцветный. Пламя может быть несветящимся и в то же время иметь цвет, т. е. быть окрашенным в голубова- тый, желтоватый цвет и т. д. Убедившись, что метан горит, сейчас же опустите конец газоотводной трубки в пробирку с заранее приготовленным раствором марганцовокислого калия. Возьмите для этого 1 каплю 0,1 н. КМnО4 и 5 капель воды. Убедив- шись, что при пропускании метана обесцвечивания раствора не происходит (так как метан в данных условиях не окисляется), немедленно опустите конец газоотводной трубки в третью пробирку, предварительно поместив в эту про- бирку 5 капель бромной воды. Обесцвечивания желтой окраски бромной воды не происходит: метан в данных условиях не реагирует с бромом, ибо он явля- ется предельным, насыщенным, углеводородом. Одновременно с метаном образуется углекислый натрий, наличие которого можно обнаружить, если после остывания пробирки адобавить в нее 2–3 кап- ли 2 н. НСl. Выделяются пузырьки СО2. Если быстро соединить пробирку с газоотводной трубкой и опустить конец ее в заранее приготовленную пробир- ку с 2–3 каплями насыщенного раствора гидрата окиси бария Ва(ОН)2, можно заметить помутнение баритовой воды вследствие выделения белого осадка ВаСО3. |
