Органика. 3. алифа
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
Основная литература: 1. Грандберг, И. И. Органическая химия : учебник для бакалавров / И.И. Грандберг, Н.Л. Нам. – 8-е изд. – Москва : Юрайт, 2013. – 607, [1] с. : ил. ; 22. – (Бакалавр. Базовый курс). – Гриф: Рек. МО. – Предм. указ.: с. 590-601. – ISBN 978-5-9916-2898-3 2. Хаханина, Т. И. Органическая химия : учебное пособие / Т. И. Хаханина, Н. Г. Осипенкова. - Москва: Юрайт : Высшее образование, 2010. - 395, [1] с. : ил. ; 22. - (Основы наук). - Библиогр.: с. 396. - ISBN 978-5-9916-0516-8. - ISBN 978-5-9692-0828-5 Дополнительная литература. 1. Петров, А. А. Органическая химия : учеб. для хим.-технол. вузов и фак. / А. А. Петров, Х. В. Бальян, А. Т. Трощенко ; под ред. М. Д. Стадничука. - 5-е изд., перераб. и доп. - СПб. : Иван Федоров, 2002. - 621,[1] с. : ил. ; 22. - Предм. указ.: с. 599-615. 2. Иванов, В. Г. Практикум по органической химии : учеб. пособие / В. Г. Иванов, О. Н. Гева, Ю. Г. Гаверова. - М. : ACADEMIA, 2002. - 288 с. - (Выс- шее образование). - Библиогр.: с. 286. - ISBN 5-7695-0586-9 Методическая литература: 1. Методические указания к практическим занятиям по дисциплине «Орга- ническая химия», Ставрополь СКФУ, 2015 5. АЛИФАТИЧЕСКИЕ УГЛЕВОДОРОДЫ: АЛКИНЫ. СПОСОБЫ ПО- ЛУЧЕНИЯ И ХИМИЧЕСКИЕ СВОЙСТВА Цельработы.Изучить лабораторные способы получения ацетилена и ознако- миться с его свойствами. В результате выполнения лабораторной работы студенты должны: Знать: источники ацетиленовых (алкинов) углеводородов; - типичные способы получения ацетилена и других алкинов; - характерные особенности тройной связи в органических соединениях; Наоснованиианализаиобобщенияизученной информацииспомощьюис- пользованиязнаний вобласти естественнонаучныхдисциплин Уметь: синтезировать ацетиленовые углеводороды из других классов орга- нических соединений; - на основании строения и состава углеводорода, описать его свойства. Владеть: навыками проведения эксперимента при получении и изучении хи- мических свойств алкинов; – навыками составления уравнений реакций, описывающих способы получе- ния и химические свойства алкинов. Теоретическаячасть Алкинами или ацетиленовыми углеводородами называют такие соединения углерода с водородом, в молекулах которых имеются атомы углерода, затра- чивающие на соединение с соседним атомом углерода три валентности, т.е. образующие тройную связь (sp1 – гибридизация). Алкины получают либо алкилированием ацетилена, либо отщеплением галогенов или галогеноводородов от полигалогенопроизводных. . Наличие тройной связи обуславливает своеобразие протекания реакций присоединения. Например, для этиловых углеводородов (алкенов) легче всего протекают реакции электрофильного присоединения, а для ацетиленовых (ал- кинов) возможны как реакции электрофильного, так и нуклеофильного присо- единения. 1.К реакциям электрофильного присоединения относятся реакции гид- рирования, галогенирования, гидрогалогенирования.   H 2 H 2 H 2  CH3 CH3 CH3 CH3     H C C H H C C HPd CH2 CH2 Pd ацетилен этилен этан   H 2 H 2 H 2  CH3 CH3 CH3 CH3    H C C H H C C HPd CH2 CH2 Pd ацетилен этилен этан   Cl Cl      HCl HCl HCl HCl    H C C H C CCH3 CH2 C  Cl ClCH3 CH3 C CH3  Cl Cl  2-хлорпропен 2,2-дихлорпропан 2-хлорпропен 2,2-дихлорпропанГалогены и галогеноводороды могут присоединяться к алкинам по ради- кальному или ионному механизму. 2. Алкины легко присоединяют воду и кислоты в отличие от алкенов. Присоединение воды ведут в присутствии сульфата ртути – реакция Кучерова. При этом из ацетилена получается уксусный альдегид, а из его гомологов - ке-     H C C H C Cпропин CH3 H2O    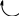 HgSO4 HgSO4CH2 C HO CH3  CH3 CH3  C CH3 C CH3 O Oтоны: пропанон 3.В отличие от алкенов, алкины вступают в реакции присоединения и по нук-   леофильному механизму (реакции со спиртами, синильной и карбоновыми леофильному механизму (реакции со спиртами, синильной и карбоновымикислотами.      H C C H + H C C H +CH3-CH2-OH CH -CH -ONa CH2 CH O CH2 CH3 3 2     винилэтиловый эфир винилэтиловый эфир CH3-CH2-OH CH3-CH2-OH О CH2 CH3     CH2 CH2CH O CH2 CH3   2 CH -CH -ONa CH3 CH   2 3 2   О CH2 О CH2CH3     ацеталь ацеталь   CH C CH C+ HCN Cu (CN) CH2 CH CN рил. Из ацетилена при этом образуется очень важный мономер ― акрилонит- 4. Алкины способны окисляться по месту тройной связи до карбоновых кислот. Однако тройная связь более стойкая к действию окислителей, чем двойная. В качестве окислителей применяются перманганат калия, озон и дру- гие окислители.  CH3 CH3 CH2 CH2   C C C C CH2 CH3 CH2 CH3 [O] [O] KMnO4+KOH KMnO4+KOHо  CH3 CH3О  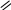  CH2 C CH2 COH 3-гексин 25 С пропановая кислота 5. Алкины способны полимеризоваться в нескольких направлениях: а) под воздействием комплексных солей меди происходит линейная по- лимеризация ацетилена с образованием преимущественно винилацетилена и дивинилацетилена:   CH CH + CH CH +  CH CH CH CH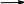 Cu Cl Cu Cl      CH C CH CH C CH    CH2 CH2    2 2 винилацетилен 2 2 винилацетилен    CH C CH C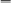  2 CH CH CH CH CH CH C C CH CH2  2 Cu2Cl2 дивинилацетилен б) при нагревании в присутствии активированного угля ацетилен обра- зует бензол:      o 3 CH CH C t  в) при действии на ацетилен комплексных соединений никеля образует- в) при действии на ацетилен комплексных соединений никеля образует-ся циклооктатетраен:     4 CH CH 4 CH CHВсе эти процессы полимеризации имеют практическое применение. 6. Металлирование. Реакция Фаворского. Водородные атомы концевой тройной связи способны замещаться металлами при действии металлооргани- ческих соединений или амидов металлов:   CH CH + CH CH +  NaNH2 NaNH2   CH C CH CNa + NH3      амид натрия ацетиленид натрия амид натрия ацетиленид натрия  CH CH CH CH+ CH3 Mg J CH C Mg J + CH4 иодистый метил магний иодистый ацетиленид магния Ацетилениды, подобно другим металлоорганическим соединениям, лег- ко вступают в реакции нуклеофильного замещения или присоединения с гало- генопроизводными, альдегидами, кетонами, углекислым газом: 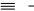 CH C CH CNa + CH3 J    CH C CH CCH3 +  NaJ NaJ   CH C CH C Mg J Mg Jиодистый метил +  CH3 CH3 CH2 CH2пропин   О О C C   CH C CH C CH О CH О  Mg J Mg J   CH C CH C   CH CH2 CH CH2CH3  пропаналь пропанальH  H2O H2O  CH2 CH2CH3  OH OH1-пентин-3-ол + Mg(OH)J      О О   HCl О HCl О   CH C CH CNa + CO2 CH C C  ONa ONaCH C C  OH OH |
