Ксенобиология ответы. 6. Реакции биотрансформации неорганических ксенобиотиков
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
|
23. Образование хелатных комплексов. Характеристика лиганд (хелатирующих агентов). Сродство, коэффициент устойчивости. Известно много веществ (лигандов), способных связываться с металлами. Они часто образуют с ними хелатные соединения. Если металл оказывается заключенным в лиганде между такими элементами, как N, O или S, то образуется хелатное кольцо. В зависимости от количества вступивших во взаимодействие атомов металлов и лиганд могут образовываться комплексы 1:1, 1:2 (в случае избытка лиганд) и др. 3 основных вида лигандов, образующих одно кольцо в комплексе 1:1 с Cu2+  При содержании двух электронодонорных групп заряд катиона металла при образовании хелатного соединения не меняется (этилендиамин). Лиганды могут содержать также одну электронодонорную и одну анионную группы, как в глицине, при этом заряд металла уменьшается на 1. Лиганд может содержать две анионные группы (щавелевая кислота)- заряд металла уменьшается на 2. Для оценки прочности связей применяют константы устойчивости ( θ ), характеризующие равновесие между одним или несколькими лигандами и одним ионом металла, подчиняющееся закону действия масс.Для комплекса в соотношении 1:1 θ рассчитывается: 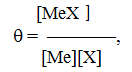 где в числителе находится концентрация комплекса, а в знаменателе – концентрация образующих его компонентов. Часто необходимо знать общую константу устойчивости (), представляющую собой произведение частных констант. Произведение двух частных констант обозначают как 2 (2 = 12 – катион металла + 2 молекулs лиганда. По сравнению с ферментами, обладающими высокой специфичностью в отношении определен. металла, среди синтетических металлосвязывающих агентов подобная избирательность встречается значительно реже. Металлы по своему сродству к большинству хелатирующих агентов располагаются примерно в следующем порядке (от наибол. сродства к наимен.): Fe3+, Hg2+, Cu2+, Al3+, Ni2+, Pb2+, Co2+, Zn2+, Fe2+, Cd2+, Mn2+, Mg2+, Ca2+, Li+, Na+, K+. Факторы , определяющие сродство металлов к лиганду: 1)Ионный радиус. Некоторые из приведенных двухвалентных металлов расположены друг за другом в периодической системе следующим образом (в скобках указаны атомные номера): Mn (25), Fe (26), Co (27), Ni (28), Cu (29), Zn (30). В этом ряду, называемом первым рядом переходных элементов, сродство к хелатирующим агентам последовательно увеличивается, достигая максимума у меди (Cu2+). Повышение сродства к хелатирующим агентам является следствием уменьшения ионного радиуса. 2)Степень ионизации. Хелатообразование зависит от степени ионизации хелатообразующих агентов. Вещество, обладающее меньшим сродством к металлу (из-за низкой конст.устойч-ти), может присоединить большее количество катионов металла, чем вещества, у которых это сродство больше. Это объясняется тем, что для хелатообразования необходимо не только наличие сродства между лигандом и металлом, но также быстрое образование анионов лиганда из агента (или молекул лиганда). Т.о., существует своего рода конкуренция между константами устойчивости и константами ионизации. 3)Окислительно-восстановительный потенциал. Также влияет на относительное сродство ряда металлов изменение окислительно-восстановительного потенциала металла, вызванного образованием хелатных соединений с металлами, имеющими переменную валентность (например, Cu, Fe, Co, Mn, Mo, V). Вследствие хелатообразования такие металлы могут даже изменять первоначальную валентность. Пример: Соли двухвалентного кобальта обычно устойчивы в водных растворах, а соли трехвалентного кобальта мгновенно разлагаются водой с выделением кислорода. Тем не менее после образования хелатного соединения с этилендиамином потенциал падает настолько резко, что комплекс с двухвалентным кобальтом легко окисляется до более стабильного соединения. 24. Концепция рецепторов. Типы хим. связей, определяющих взаимодействие молекул ксенобио-в с мембранактивными сайтами (рецепторами). Рецептор – центр связывания агента, выполняющую регуляторную ф-цию в организме, связывание с которым инициирует специфическую реакцию. П. Куатреказас перечислил основные признаки рецепторов: 1)взаимодействие эффектора с рецептором должно отвечать требованиям определ. пространственной и структурной специфичности 2)ограниченное кол-во мест связывания (связывающие места насыщаемы) 3) тканевая специфичность связывания эффектора, соответствующая его биол.специфич-ти 4)места связывания должны обладать высоким сродством к гормону (их конц должна соответствовать физиол.конц гормона) 5)обратимое связывание эффектора рецептором Для доказательства наличия рецепторов на мембр. –выделить его, очистить, встроить в искусств. бислойную липидн.мембр., показат сохранение биол активности. Структура рецепторов: Гликопротиен/гликолипид Молекула состоит из 2х частей (связывающий и предающий участки) Наружная часть (благодаря полисахаридным цепям) – для связывания вещества(гормона).Вторая (менее полярная) – закрепления в липидном бислое и передачи принятого сигнала внутрь клетки. Взаимодействие между связывающими и передающими участками осуществляется благодаря конформационным перестройкам, происходящим в результате «посадки» эффектора (агониста) на связывающий участок рецептора. Потом происходят небольшие изменения на отдельных участках мембран, результаты которых передаются внутрь клетки, усиливаясь и в конце концов определяют течение внутриклеточных процессов. В основе передачи в ряде случаев лежит активация и инактивация фермента – аденилатциклазы (АЦ), расположенного в мембране. Этот фермент отвечает за синтез цАМФ из АТФ. В норм. состоянии активность АЦ подавлена. при взаимодействии агониста с рецептором аденилатциклаза активируется ↓ усиливается синтез цАМФ, увеличивается конц его внутри клетки ↓ активируется 1 или неск ферментов, расположенных внутри клетки Т.о., хим сигнал передается от одного посыльного к другому. Первичным посыльным является эффектор (гормон, медиатор), через G-белок и аденилатциклазу он передает сообщение внутрь клетки. Вторичные посредники не только способствуют передаче внеш. сигнала во внутрикл, но и обеспечивают значительное усиление первоначального сигнала (в 107-108 раз). Однако постоянная активация АЦ не только не нужна, но и небезопасна для кл (необратимая активация мож вызвать холеру).Поэтому уровень цАМФ регулируется также с помощью фосфодиэстеразы (ФДЭ) (катализ гидролиз цАМФ → АМФ(это поддерживает его постоянный уровень в кл). Циклический АМФ регулирует внутриклеточные реакции про и экариот кл. Действие его основано на активации специфических ферментов цАМФ зависимых протеинкиназ, которые формируют многие белки, в частности белки рибосом, ряд ферментов, транспортные мембранные белки и др. Фосфорилирование белков – это их активации. В неактивированное состояние они возвращаются путем дефосфорилирования с помощью фосфопротеинфосфотазы (ФПФ). Признанными вторичными мессенджерами являются ионы кальция. Кальций участвует в регуляции внутрикл процессов в комбинации с двумя др. вторичными посредниками: инозитолтрифосфатом и диацилглицеролом. Эффектор (медиатор) связывается с рецептором ↓ через ГТФ-связывающие белки (G-белки) ↓ активирует фосфодиэстеразу фосфатидилинозитолтрифосфата (ФИФ2). ↓ При ращеплении ФИФ2 ↓ образуется инозитолтрифосфат (ИФ3) и диацилглицерол (ДАГ). ↓ ↓
Основные критерии, по которым можно судить о наличии рецепторов: 1.высокое сродство, характеризующееся тем, что агент действует при низкой конц.; 2.кривая, описывающая процесс взаимодействия эффектора с местами связывания на мембране от конц, должна выходить на плато, поскольку количество рецепторов (мест связывания) ограничено; 3.различная биол. активность пар оптических изомеров (стереоспецифичность), 4.тканевая специфичность биологического действия веществ, например, адреналин оказывает мощное действие на сердечную мышцу, но слабо действует на поперечно-полосатые мышцы. Взаимодействие возможно только при строгом соответствии пространственных и зарядовых геометрий. 25. Амфифильные ксенобиотики, их классификация (на примере ПАВ). Характеристика этапов их взаимодействия с биологическими мембранами, характер изменения селективности мембраны. Амфифильные вещества стремятся сконцентрироваться на границах раздела несмешивающихся жидкостей: располагаются на границе раздела масло–вода таким образом, что гидрофильная «головка» находится в воде, а липофильные углеводородные цепи размещаются в масле, взаимодействуя с подобными себе цепями растворителя. Молекулы этих веществ обычно состоят из длинных углеводородных цепей, связанных с короткой полярной «головкой». В большинстве случаев полярность «головки» обусловлена наличием атомов азота или кислорода, не обобществленные пары электронов которых образуют водородные связи с молекулами воды. С другой стороны, для попадания в воду углеводородная цепь должна разорвать водородные связи между молекулами воды, которые энергически препятствует этому разрыву. Типичными представителями амфифильных ксенобиотиков являются поверхностно-активные вещества (ПАВ). По характеру диссоциации все ПАВ делятся на: – анионные, функциональные группы, молекулы которых в результате ионизации в растворе образуют отрицательно заряженные ионы, обусловливающие поверхностную активность; – катионные ПАВ, функциональные группы молекул которых в результате ионизации в растворе образуют положительно заряженные ионы, обусловливающие поверхностную активность; – неионогенные, практически не образующие в водном растворе ионов; – амфолитные ПАВ, образующие в водном растворе в зависимости от условий (рН, растворимость и др.) катионные или анионные соединения. При обработке клеток поэтапно увеличивающейся концентрацией детергента ПАВ выявлены четыре различные стадии: связывание детергента с мембраной, лизис, диссоциация мембраны на смесь комплексов липид–детергент, протеин–липид–детергент и высвобождение из комплексов чистых белков. Эти стадии могут быть описаны следующим образом: При низких концентрациях молекулы детергента связываются с мембранами, посредством внедрения во внешнюю фазу липидного бислоя без существенного изменения его структуры. При повышении концентрации мономеров до определенной величины количество молекул детергента становится достаточным для дестабилизации мембраны. ПАВ, встраиваясь в мембрану, могут образовывать поры, размеры и физико-химические свойства которых зависят от типа и концентрации детергента в растворе. В зависимости от вида ПАВ эти поры деформируются в виде связанных каналов или в виде выемок на поверхности мембраны. В ряде случаев при значительных концентрациях детергента образующиеся в мембране поры имеют очень крупные размеры, через них могут проходить сахара и макромолекулы. При еще больших концентрациях вся мембрана перемешивается с молекулами детергента, что приводит к фазовому переходу – мембрана распадается на смесь мицелл, содержащих комплексы детергент–липид или детергент–липид–протеин. При последующем увеличении концентрации ПАВ отношение липид–белок уменьшается до тех пор, пока не происходит полное разделение фракций белков и липидов. Изменение селективности мембран мембрана обладает выраженной селективностью по отношению к различным веществам из-за того, что молекулярные и надмолекулярные структуры мембраны упорядочены. Нарушения этой упорядоченности сказываются на показателях селективности. Пока ПАВ относительно малы, большая часть связывающихся с мембраной молекул «разрыхляет» участки мембраны и каждая из них действует как бы независимо. Поэтому, наступающее снижение селективности примерно пропорционально числу связанных молекул и является суммой отдельных вкладов каждой из них. Но по мере роста концентрации ПАВ молекулы располагаются все плотнее, так что присутствие одной из них усиливает разрушающий эффект другой. Наконец, образуя большие скопления, приводящие в конечном счете к появлению пор, молекулы ПАВ, связанные с мембраной, еще более резко снижают ее селективность. 26. Роль физико-химических факторов окружающей среды на превращения ксенобиотиков Фотохимические превращения. Солнечная радиация хорошо поглощается некоторыми молекулами. Во многих случаях поглощенная энергия способна индуцировать изменения в молекуле. Ионизирующее излучение не настолько сконцентрировано, чтобы вызвать заметный эффект. Энергия инфракрасного излучения достаточна лишь для продуцирования миним. молекулярных изменений, но не для полного превращения молекул. Ультрафиолетовое излучение наряду с видимой областью спектра также поглощается молекулами нек. КБ. Фотохимические превращения проходят в 3 стадии: – акт абсорбции, который приводит к поглощению излучения определенной длины волны и появлению возбужденного состояния; – первичный фотохимический процесс, включающий преобразование электронно-возбужденного состояния и его переход в невозбужденное состояние; – вторичные или «темновые» реакции, происходящие в результате первичного фотохимического процесса. Активные частицы, образующихся в первичных фотохимических процессах, особенно свободные радикалы, могут реагировать с др.молекулами в своем непосредственном окружении(с молек. кислорода или воды). Степень деструкции КБ в фотохим. процессах зависит от его свойств: *В-во должно поглощать электромагнитн излучение в доступном интервале длин волн *обладать потенциальной способностью к хим изменению(иметь реагирующие на воздействие излучения связи, которые при соответствующих уровнях энергии могут перестраиваться или разрываться). Окислительно-восстановительные (ОВ) превращения. Многие неорг и орг в-ва могут принимать (восстанавливаться) или отдавать электроны (окисляться). Важное значение приобретают эти превращение КБ, т.к : – окисл-е и восстан-е формы данного КБ могут существенно различаться по биологич. и экологическим свойствам; – существуют значительные вариации в окислительн или восстановительных условиях в окружающей среде, что влияет на трансформацию КБ. ОВ способность окружающей среды характеризуется величиной рƐ, она позволяет установить, в какой форме в данной среде может существовать КБ. рƐ = – lg [е-], где рƐ – показатель активности электрона, указывающий на способность среды отдавать или принимать электроны; рН – показатель активности протона – lg[Н+], т. е. высокий рН соответствует низкой активности Н+, низкий рН – высокой активности Н+. Высокий рƐ соответствует низкой активности электронов, низкий рƐ соответствует высокой активности электронов. азот (в зависимости от ОВ способности, присущей природным водам) может существовать в различной степени окисления. Уровень содержания нитратов в некоторых поверхностных водах, поступающих из с/х угодий или животноводческих ферм, может создать серьезную экологическую проблему. Нитраты содержат азот в самой высокой степени окисления и образуются при высоких значениях рƐ. Являясь сами по себе токсичными, нитраты в ряде случаев способны восстанавливаться до нитритов. Присутствие последних опасно для здоровья людей вследствие их специфического сродства к гемоглобину. Еще более опасна способность нитритов образовывать нитрозоамины, которые являются канцерогенами. Нитриты далее могут восстанавливаться до аммиака, который, вероятно, при природных значениях рН существует в виде ионов аммония. При низк.значениях рƐ азот существует в виде ионов аммония, а в промежуточной области значений рƐ– в форме нитритов. Окисление КБ может происходить в водной среде за счет растворенного в воде кислорода посредством перекиси водорода, которая выделяется в воду некоторыми гидробионтами, и окислением с участием свободных радикалов. Гидролиз. Реакции гидролиза обусловлены способностью в-ва вступать в реакции с водой. Вода, особенно при нагревании, быстро разрушает многие вещества. Эфирные связи, напр, в молекулах фосфорорганических соединений, высокочувствительны к действию воды, чем определяется умеренная стойкость этих соединений в окруж. среде. Способность вещества реагировать в воде с ионами водорода или гидроксила в большей степени определяется распределением заряда в его молекуле. При оценке способности в-ва вступать в реакции гидролиза необходимо учитывать влияние рН. Большинство хим. реакций включает отталкивание или притяжение электронов, и наиболее сильными атакующими группами в молекуле являются те, которые способны принимать электроны от атакуемой молекулы или отдавать ей их. Водородные ионы и др.группы с дефицитом электронов называются электрофильными. Они особенно сильно притягиваются к атому с небольшим отрицательным зарядом, к свободной электронной паре или электронам двойной связи. Вещества с избытком не связывающихся электронов являются нуклеофилами. Наиболее изучены по сравнению с др. реакции гидролиза эфиров(карбоновых кислот, амидов). Адсорбция ксенобиотиков на частицах. Доступность КБ для ферментов снижается также в результате сорбции молекул на частицах биол. или абиотич. происхожд-я. Процессы сорбции–десорбции КБ часто определяют их устойчивость и взаимосвязаны с переносом в биосфере на большие расстояния. Примеры : Многие пестициды в почве гидролизуются с образованием соед-й, которые адсорбируются на частицах почвы, связываются с гумусом и благодаря этому сохраняются длительное время, т. е. возрастает устойчивость этих токсикантов. В адсорбированном состоянии они не разлагаются фотохимически и не гидролизуются водой. По мере разрушения гумуса грибами (что является ферментативным процессом) ранее связанные молекулы пестицида освобождаются и могут проявить свое токсическое действие на организмы данной экосистемы. При этом, подобные пестициды в чисто хим эксперименте (в водном растворе без почвы) малоустойчивы. Переходы веществ из одной среды в другую. Изменения физ-хим.св-в в-в в результате модификации структуры их молекул, сорбция КБ на частицах и др. оказываются существенными при переходе в-в (и продуктов их превращений) из одного блока биогеоценоза в др. Таковы переходы КБ из воды в воздух и обратно, из организмов в воду и обратно, из почвы в воду и т. д. КБ переносятся воздушными массами (летучесть пестицидов)и выпадают в виде пыли, с атмосферными осадками в значительных кол-вах. 27.Связь структуры с активностью ксенобиотиков, закономерности и подходы, используемые для ее установления. Выявление взаимосвязи структуры с активностью ксенобиотиков (КБ) позволяет прогнозировать и предсказывать последствия при его попадании в организм, биосферу и способствует целенаправленному синтезу веществ с заданными свойствами. Такие прогнозы необходимы, тк экономят большие средства, необходимые для установления соответствующих свойств экспериментальным путем. Структура – строение вещества, определяющее все его физические и химические свойства. Активность – это взаимодействие вещества с центрами-мишенями, которое может быть связано длинной цепью событий с наблюдаемым физиологическим эффектом. Параметры веществ, изучаемые при установлении соотношения "структура-активность" : молек.масса, плотность, молек.объем, критическое давление, коэф. теплопроводности, теплоемкость, поверхност.натяжение, вязкость и тд. В подавляющем большинстве биологич. активность КБ коррелирует с их способностью определенным образом распределяться между липидной и водными фазами. (такие показатели будут тесно связаны с другими физ. хим. показателями, которые связаны в коэф.распределения) Для оценки биол. активности КБ по его физико-химическим свойствам применяют методы: 1) основанные на поиске корреляционных связей между этими показателями и биологической активностью. Например, сопоставление скоростей разрушения (СР) ряда третичных аминов с величинами pKa и коэф. распределения (Кр). Изучение СР 18 соединений, позволило вывести соотношение зависимости логарифма СР от логарифма Кр (величина pKa бралась равной 9,5): lg CP = a lg pKp - b lg Ка - c, где a,b,c имеют численное значение, т е Положительные значения множителя перед lg pKp указывают на то, что с увеличением коэф. распределения СР повышается. Соединения с более высокими значениями Кр в микросомной мембране более легко достигают ферментативной системы, осуществляющей реакцию деметилирования. Тот факт, что большинство изменений скоростей для изученной группы в-в можно связать с рКа и pKp, указывает на то, что в этом случае стерические эффекты не имеют особого значения. 2) поиск аналогий в строении молекулы нового соединения и молекул, биологическое действие которых уже охарактеризовано. Напр, если молекула КБ содержит 2 противоположно заряженные ионогенные группы (H3N+ и COO-), то все аналоги, имитирующие ее действие, также обязательно содержат пару разноименно заряженных групп. Биолог. акт. этих в-в является функцией расстояния между этими группами, т е если у исследуемого вещества расстояние заряженных групп равно аналогу, то в-во будет иметь тот же уровень активности. 3) метод с использованием теории распознавания образов (в том случае, если рассматривается более 1 признака) На практике к анализу привлекаются лишь некоторые основные, обладающие характерным проявлением био акт., соединения. Напр, известно, что наиболее эффективные яды – это соединения, являющиеся аналогами природных биорегуляторов, так гербицид 2,4-д близок в структурном отношении к ИУК, регулирующей ростовые процессы у растений. При оценке "близости" структуры и свойств нового вещества с каждым из исследованных соединений необходимо: * определить более точно характер действия * располагать сведениями о проявлении соответствующего характера действия соединений известной структуры. Также при исследовании закономерностей изменения био акт в ряду аналогов некоторого вещества модификации, вызывающие сдви био активности, обычно разделяют на 2 группы: модификации связанные с изменением сродства молекулы к мембранактивным структурам (рецептору),и модификации, нарушающие развитие реакции системы на образование комплекса "вещество-рецептор". Далее следует считаться с тем обстоятельством, что молекулы многих в-в имеют в растворе несколько стабильных конформаций, причем для осуществления акта взаимодействия с активным центра необходима лишь 1 или некоторые из них. Поэтому на ряду с определением спектра стабильных конформаций молекулы КБ возникает необходимость выявления так называемой "биологически активной конформации". 28.Понятия токсичности и опасности ксенобиотиков для живых систем. Яды и токсины. Приемы классификации. Негативное действие КБ на организм человека, животного или растения может осуществляться не только путем непосредственного влияния, но и в результате поступления его по пищевым цепям вследствие биоконцентрации. Многие из КБ и поллютантов являются сильнодействующими ядовитыми веществами. Яды – это химические вещества экзогенного происхождения (синтетические и природные), которые после проникновения в организм вызывают структурные и функциональные изменения, сопровождающиеся развитием характерных патологических состояний.( в малых дозах могут применяться в медицине, напр морфин) Яды и токсины – это, как правило, вещества высочайшей биологической активности и исключительной селективности, вызывающие отравление. В организме любой КБ обладает той или иной мерой токсичности. Токсичность – мера несовместимости вещества с жизнью, величина, обратная абсолютному значению средне смертельной дозы (1/LД50) или концентрации 1/LС50. Опасность – вероятность появления вредных для здоровья эффектов в реальных условиях их производства и применения. Классы токсичности (опасности): I – чрезвычайно токсичные (опасные) II - высоко токсичные (опасные) III - умеренно токсичные (опасные) IV – мало токсичные (опасные). Яды и токсины в целом делят на 2 группы: *общие, основанные на каком-либо одном принципе оценки: по хим св-вам (химическая) ; по целям применения (практическая); по степени токсичности (гигиеническая); по виду токсического действия (токсикологическая); по избирательной токсичности. * специальные, отражающие связь между отдельными физико-химическими или другими признаками в-в и проявлениями их токсичности: по типу гипоксии; по механизму взаимодействия с ферментными системами; по хар-ру биологического последствия отравлений; по степени канцерогенной, мутагенной и прочих видов активностей. В зависимости от источника происхождения и практического применения: 1) Промышленные яды: органические растворители (ацетон); в-ва, применяемые в качестве топлива (метан); красители (анилин); химические реагенты, полупродукты органического синтеза; 2) Хим. удобрения и средства защиты растений; 3) Лекарственные средства и полупродукты фармацевтической промышленности; 4) Бытовые химикаты; 5) Растительные и животные яды; 6) Боевые отравляющие вещества. По характеру их токсического действия на организм: 1. Нервно-паралитическое действие (никотин) 2.Кожно-резорбтивное действие (мышьяк) 3. Общетоксическое действие (алкоголь) 4. Удушающее действие (фосген) 5. Слезоточивое и раздражающее действие (пары крепких кислот и щелочей) 6. Психотическое действие (кокаин) По избирательной токсичности 1) Сердечные яды (гликозиды) 2) Нервные яды (транквилизаторы) 3) Печеночные яды (фенолы) 4) Почечные яды (соединения тяжелых Ме) 5) Кровяные яды (анилин) 6) Желудочно-кишечные яды (концентрированные кислоты) 7) Легочные яды (фосген). Для характеристики токсичности используют значения LD50 или LC50. ЛД50— средняя доза вещества, вызывающая гибель половины членов испытуемой группы. ЛС 50 – Применяются обычно для ядовитых газов, обозначая летальную концентрацию газа в воздухе и время воздействия. Недостатки использования параметра LD50 (LC50): -проведенные в 65 европейских лабораториях определения LD50 для таких веществ как анилин, ацетанилид, салицилат, хлорид кадмия в сходных условиях на одних и тех же животных показали, что полученные величины отличались для одного и того же вещества в 5– 10 раз; - несостоятельность использования животных с этической и гуманной точек зрения. 29. Реакция метаболического восстановления и гидролиза органических ксенобиотиков, основные типы и ферменты. Реакции восстановления. Если восстановленная форма будет лучше экскретироваться из организма, то реакции восстановления будут преобладать над реакциями окисления, несмотря на более сложные процессы. Наряду с окислительными ферментативными системами в ЭР содержатся ферменты, которые восстанавливают КБ. Все ферменты, участвующие в реакциях восстановления ксенобиотиков, относят к классу редуктаз. 1) Некоторые альдегиды и кетоны могут восстанавливаться в спирты под действием алкогольдегидрогеназ. Однако ацетон может прямо входить в цикл аэробного метаболизма через ацетоацетат и ацетил-КоА. R1CO2 → RCHOHR2 (восстановление кетонов до спиртов) Так же существуют редуктазы, восстанавливающие карбонильные группы в молекулах кетонов и альдегидов. 2) Восстановление нитро- и азогрупп: Способны восстанавливаться в соответствующие амины (нитробензол →аланин) нитроредуктазами, находящейся в микросомальной и растворимой фракциях печени и почек. Возможно образование продуктов, содержащих также гидроксиамино- или нитрозогруппы. Образование нитрозосоединений представляет большую опасность для биосферы, т к может появляться в-во, которое обладает сильным мутагенным и/или канцерогенным дейтствием. Активность нитроредуктаз зависит от наличия с среде инкубации НАДН и НАДФН, но ингибируется кислородом. Нитроредуктазы малоспецифичны к субстратам и восстанавливают нитрогруппы практически у всех ароматических нитросоединений. Восстановление субстратов ферментами может протекать, во-первых через такие промежуточные соединения, как нитрозосоединения и гидроксиламин, а во-вторых, через анионные радикалы. Последний путь характерен для микросомных нитроредуктаз тк в реакции наряду с флавопротеидом участвует цитохром Р450. Он вступает в процесс на более поздних этапах и, следовательно, передает электроны промежуточным соединениям, образующимся вслед за анионными радикалами. Восстановление азосоединений катализируется азоредуктазами. В одном случае в процессе принимают участие НАДФН-цитохром с редуктазов, в другом – цитохром Р450. НАДФН-цитохром с редуктазой передает электроны на субстрат через флавины, которые полностью или частично восстановлены цитохромом с. Скорость окисления азосоединений флавинами пропорциональна потенциалу восстановления, что свидетельствует о простом переносе электронов в ходе реакции. Восстановление азосоединений с участием цитохрома Р450 включает также образование свободных радикалов. 3) Восстановление N-оксидов: Процесс катализируется N-оксидоредуктазами, которые обнаружены в микросомной и растворимой фракциях клеток, а так же в митохондриях. Активность фермента ингибируется угарным газом. При внесении субстрата восстановления (N-оксиды тирамида) его связывание происходи с восстановленной формой цитохрома Р450. 4) Немикросомное метаболическое восстановление: а. восстановление дисульфидов с образованием тиолов; б. восстановление двойных связей (могут становиться насыщенными), но простейшие алкены могут экскретироваться без изменений; в. дегидроксилирование, напр восстановлние замещенных катехолов с двумя ОН-группами до соответствующих замещенных монофенолов. Гидролиз. Сложные чужеродные в-ва могут гидролизоваться рядом гидролитических ферментов (гидролаз), находящихся в печени и плазме крови, некоторые могут быть в микросомной фракции печени. 1. Гидролиз эфиров карбоновых кислот: Катализируется ферментами эстеразами, которые классифицируются по группам в-в, на которые они действуют, и по их отношению к ингибиторам: *арилэстеразы – гидролизуют ароматические эфиры; *карбоксилэстеразы – алифатические эфиры; *холинэстергидролазы – эфиры холина; *ацетилэстеразы – подобны арилэстеразам, но по-другому реагируют на воздействие ингибиторов. Проксин → аминобензойная кислота + этанолдипропиламин 2. Гидролиз амидов, гидразидов, нитролов: происходит с участием амидаз (многие из изученных амидаз являются внеклеточными гидролазами). Гидролиз амидов происходит в меньшей скоростью, чем эфиров карбоновых кислот. Иногда на этом эффекте основано действиелекарственных препаратов. 3. Фосфорорганические вещества гидролизуются с помощью ферментов, атакующих эфирные связи или действующих на ангидриды киислот. К первым из изученных ферментов, расщепляющих связь с фтором, относится фторгидролаза. Эфир фосфорной кислоты + вода →диэтиловый эфир фосфорной кислоты + n-нитрофеенол. Фермент, гидролизующий связь "углерод-кислород" в оксирановом кольце, называется эпоксидгидратазой; локализован в ЭР клеток печени, почек, легких и кишечника. Особое место занимают β-глюкуронидаза и сульфатаза. 30.Активный транспорт ксенобиотиков через биологические мембраны: определение и характеристика основных механизмов. Активный транспорт перенос ксенобиотиков с затратой энергии против электрохимического потенциала. Осуществляется либо за счет сопряжения электрохимических градиентов, либо выполняется молекулярными машинами (АТФазами). Следует различать первичный и вторичный (или сопряженный) активный транспорт. Первичный активный транспорт трансмембранный векторный перенос веществ осуществляется непосредственно в ходе реакции энергетического преобразования в АТФазных системах или в ОВЦ, т е используется энергия либо АТФ, либо ОВ (окислительно-восстановительных) реакций. Подразделяется на: а. электрогенный активный транспорт, т.е. непосредственный перенос в-в через мембрану во время АТФазной или ОВ реакции, сопровождающийся генерацией электрического потенциала. б. электронейтральный актив.транспорт, т.е. перенос в-в, не сопровождающийся генерацией электрического потенциала. Вторичный активный перенос совершается, когда в качестве энергетических источников используются градиенты электрохимических потенциалов других ионов. Напр, электрохимический градиент ионов Н+ для сопряженного транспорта анионов, сахаров, АК и других в-в в клетку (котранспорт), или, наоборот, для вывода ионов Na+ из клетки (противотранспорт). Классическая модель активного переноса: Активация – видоизменение носителя в результате поглощения метаболической энергии (АТФ) , в результате приобретается сильное сродство к подлежащей переносу молекуле и присоединение ее к себе → Переориентация – образованный комплекс проходит через мембрану → Релаксация – потеря сродства и высвобождение молекулы в результате второй хим реакции. Затем цикл повторяется. Процессов, идущим с потреблением энергии, является модифицирование структуры молекулы. Согласно традиционной точке зрения, для каждого в-ва имеется свой носитель, который модифицирует свою структуры. Но в настоящее время большую популярность набирает точка зрения, согласно которой меняется один универсальный механизм энергообеспечения активного переноса различный соединений, как заряженых, так и нейтральных – электрохимические потенциалы ионов натрия или протонов, которые образуются благодаря работе Na+/K+-зависимой АТФазы (животные клетки), Н+-АТФазы (растительные и др.) Функционирование Н+-АТФазной помпы плазмолеммы: При переносе положит. заряженной частицы наружу на мембране устанавливается более высокий по абсолютной величине потенциал ΔΨ (внутренняя сторона заряжена отрицательно по отношению к наружной) и изменяется разность концентраций переносимого иона, в данном случае ΔрН. В результате положит. ион (калий) по градиенту электрохимического потенциала, а протон по градиенту концентрации входят в клетку. (из обл с большим ΔΨ в обл меньшего ΔΨ). Вторичный актив транспорт приводится в действие за счет энергии, запасенной в градиентах в-в, а не путем прямого гидролиза АТФ. Очень важный механизм транспорта КБ – функционирование Р-гликопротеина, являющегося транспортной АТФазой. Когда гидрофобное в-в, в т ч противораковое лекарство (ПРЛ), проникает в клетку, то оно удаляется из нее Р-гликопротеоном за счет энергии гидролиза АТФ. Это снижает эффективность химиотерапии рака. В переносе в-в через мембраны принимают участие редокс-цепи мембран, т е окислительно-восстановительные реакции (напр, ОВ дыхательной цепи). Исходным звеном РЦ выступают восстановленные пиридиннуклеотиды, а конечных акцептором электронов является кислород. 31.Характеристика процессов адсорбции ксенобиотиков. Изотерма Лэнгмюра. Адсорбция — увеличение концентрации растворенного вещества у поверхности раздела двух фаз (твердая фаза — жидкость; две несмешивающиеся жидкости). Адсорбирующая поверхность в клетке может на несколько порядков превышать объем. Когда говорят об адсорбции какого-либо в-ва, подразумевают, что оно обратимо концентрируется на поверхности. Процесс адсорбции обусловлен теми же типами связей (в особенности ван-дер-вальсовыми, водородными и ионными), что и хим реакции, происходящие во всем объеме в-ва. Физико-химические хар-ки в-в после их адсорбции отличаются от св-в в растворе, что имеет большую биологическую значимость, и определяют количественные различия между реакциями, протекающими на поверхности и в растворе. Напр, за счет увеличения концентрации в-ва, вероятность хим взаимодействия сильно возрастает. Адсорбцию на поверхности подразделяют на: *Неспецифическая адсорбция характерна для веществ амфифильной природы, при которой нейтральные молекулы адсорбируются сильнее, чем ионы. Это происходит потому, что ион гидратируется сильнее, чем соответствующие неионизированные молекулы, и поэтому последние легче вытесняются из воды. * Специфическая адсорбция свойственна гидрофобным веществам, которые стремятся разместиться на поверхности, имеющей химически комплементарный характер. Простейший пример – притяжение аниона к положительно заряженному участку поверхности, а катиона – к отрицательно заряженному. В таких случаях ион будет адсорбироваться сильнее, чем неионизированная молекула. Если при адсорбции не происходит образование ковалентных связей, то это обратимый процесс, и положение его равновесия устанавливается в соответствии с законом действующих масс. В 1918г Ленгмюр вывел из этого закона уравнение, позволяющее получить количественные хар-ки адсорбции. При выводе соотношения были сделаны следующие предположения: *энергия адсорбции постоянна и не зависит от степени заполнения поверхности; * адсорбция происходит на локальных центрах, и адсорбированные молекулы между собой не взаимодействуют; * максимальная возможная адсорбция соответствует полному заполнению монослоя. Число молей вещества Г, адсорбированного на поверхности: Г= 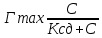 , где Ксд – константа сорбции-десорбции, Г max – число молей растворенного в-ва, адсорбированного на поверхности адсорбента с образованием полностью заполненного монослоя, С – концентрация КБ в растворе. , где Ксд – константа сорбции-десорбции, Г max – число молей растворенного в-ва, адсорбированного на поверхности адсорбента с образованием полностью заполненного монослоя, С – концентрация КБ в растворе.Изотерму Ленгмюра можно представить и в линейной форме:  Это уравнение показывает, что адсорбент насыщается при высоких значениях С, т е при образования монослоя. Это уравнение показывает, что адсорбент насыщается при высоких значениях С, т е при образования монослоя. П  ри адсорбции различных агентов часто наблюдается такое явление, когда биологический эффект от каждого последующего удвоения становится все менее ощутимым, при этом кривая зависимости эффекта от дозы представляет собой гиперболу. Существуют несколько типов кривых, характеризующих процесс адсорбции, напр 3 распространенных: ри адсорбции различных агентов часто наблюдается такое явление, когда биологический эффект от каждого последующего удвоения становится все менее ощутимым, при этом кривая зависимости эффекта от дозы представляет собой гиперболу. Существуют несколько типов кривых, характеризующих процесс адсорбции, напр 3 распространенных:Н-кривые: характеризующие случаи с высокой степенью сродства; на этих кривых начальные значения концентраций адсорбированного в-ва очень велики; такие кривые часто получаются, если в-во адсорбируется в виде мицелл, а так же при адсорбции ионов, имеющих высокую степент сродства и способных обмениваться с ионами, обладающими малой степенью сродства. L-кривые: нормальны изотермы Ленгмюра, характеризующие адсорбцию моолекул, ориентированных на поверхности горизонтально; чем больше в-ва адсорбированно, тем более затруднена дальнейшая адсорбция. S-кривые: соответствующие вертикальной ориентации молекул относительно поверхности. На этапе, который характеризуется начальным участком сигмоидной кривой, чем больше в-ва уже адсорбированно, тем легче происходит дальнейшая адсорбция. Этот эффект получил название кооперативного. 32.Экологическая и токсикологическая характеристика оксидов азота, серы и фторсодержащих углеводородов. Количество выбросов оксидов: 200–350 млн т в год. |
