8.1.2 Биохимия печени, метаболизм гема и железа - Вопросы для са. 8. 1 Биохимия печени, метаболизм гема и железа Вопросы для самоконтроля
 Скачать 347.18 Kb. Скачать 347.18 Kb.
|
8.1 Биохимия печени, метаболизм гема и железаВопросы для самоконтроля
Вещества, поступающие в организм из окружающей среды и не используемые им для построения тканей организма или как источники энергии, называют чужеродными веществами, или ксенобиотиками.
Гидрофильные ксенобиотики выводятся из организма в неизменённом виде с мочой
Обезвреживание большинства ксенобиотиков происходит путём химической модификации и протекает в 2 фазы. В результате этой серии реакций ксенобиотики становятся более гидрофильными и выделяются с мочой. Вещества, более гидрофобные или обладающие большой молекулярной массой (>300 кД), чаще выводятся с жёлчью в кишечник и затем удаляются с фекалиями.
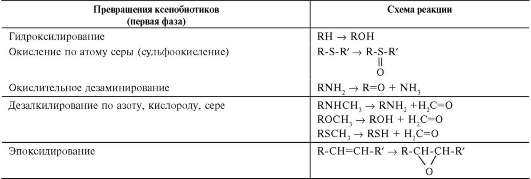

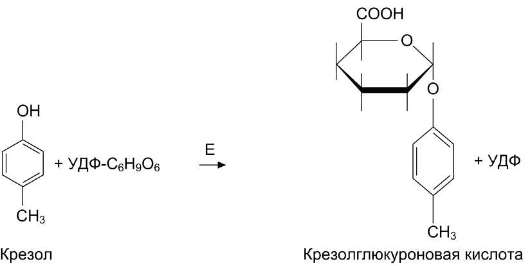
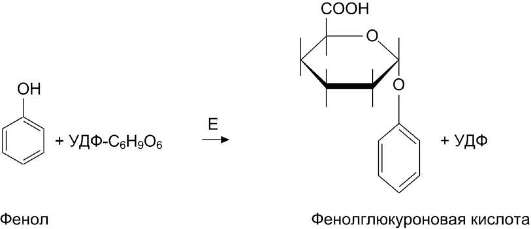
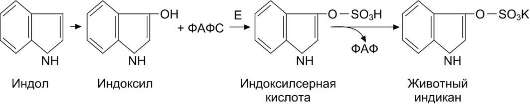
Реакции конъюгации, в результате которых чужеродное вещество, модифицированное ферментными системами ЭР, связывается с эндогенными субстратами - глюкуроновой кислотой, серной кислотой, глицином, глутатионом. Образовавшийся конъюгат удаляется из организма.
Эндоплазматический ретикулум
В ЭР существуют две такие цепи, первая состоит из двух ферментов - NADPH-Р450 редуктазы и цитохрома Р450, вторая включает фермент NADH-цитохром-b5редукта-зу, цитохром b5 и ещё один фермент - стеароил-КоА-десатуразу.
RH + O2 + NADPH + H+ → ROH + H2O + NADP+
Барбитураты, полициклические ароматические углеводороды, спирты, кетоны и некоторые стероиды.
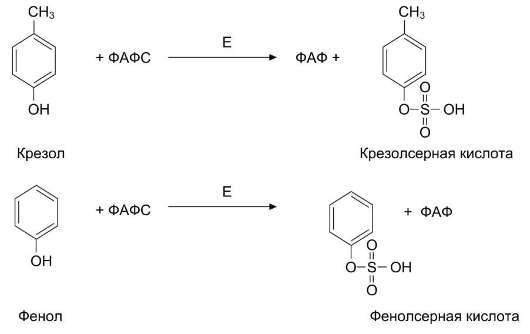

Альбумины, липопротеины, а также в комплексе с кислым α1-гликопротеином.
В норме его функция состоит в экскреции ионов хлора и гидрофобных токсичных соединений из клеток.
В результате биотрансформации лекарственных веществ может произойти: • инактивация лекарственных веществ, т.е. снижение их фармакологической активности; • повышение активности лекарственных веществ; • образование токсических метаболитов
Барбитурат в ходе биотрансформации превращается в гидроксибарбитурат, который далее участвует в реакции конъюгации с остатком глюкуроновой кислоты. Фермент глюкуронилтрансфераза катализирует образование барбитуратглюкуронида, в качестве источника глюкуроновой кислоты используется УДФ-глюкуронил. 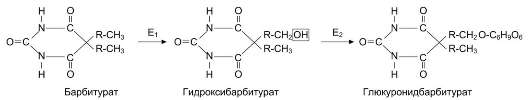
Образование дезметилимипрамина из имипрамина. 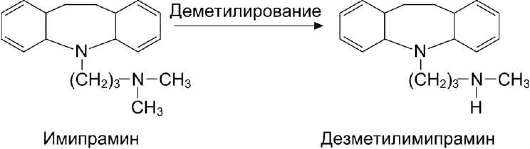 Ипразид - антидепрессант, который в результате дезалкилирования превращается в изониазид 
Фенацетин превращается в парафенетидин, вызывающий гипоксию за счёт образования метгемоглобина - неактивной формы Нb 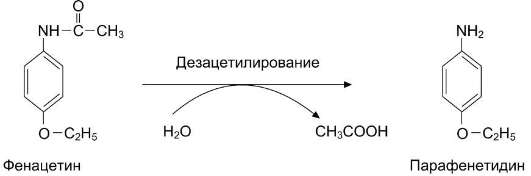
С9H5ОН + NAD+ ↔ CH3CHO + NADH + H+.
C9H5OH + NADPH + Н+ + О2 → CH3CHO + NADP+ + 2 Н2О
СН3СН2ОН + Н2О2 → СН3СНО +2 Н2О
CH3CHO + О2 + Н2О → CH3COOH +Н2О2
CH3CHO + Н2О + NAD+ → CH3COOH + + NADH + H+
Ацетальдегид - очень реакционно-способное соединение; он неферментативно может ацетилировать SH-, NН2-группы белков и других соединений в клетке и нарушать их функции.
При химиотерапии злокачественных процессов начальная эффективность лекарства часто постепенно падает. Более того, развивается множественная лекарственная устойчивость, т.е. устойчивость не только к этому лечебному препарату, но и целому ряду других лекарств. Это происходит потому, что противоопухолевые лекарства индуцируют синтез Р-глико-протеина, глутатионтрансферазы и глутатиона. Использование веществ, ингибирующих или активирующих синтез Р-гликопротеина, а также ферменты синтеза глутатиона, повышает эффективность химиотерапии. Металлы являются индукторами синтеза глутатиона и низкомолекулярного белка метал-лотионеина, имеющих SH-групггы, способные связывать их. В результате возрастает устойчивость клеток организма к ядам и лекарствам.
Гем состоит из иона двухвалентного железа и порфирина. В основе структуры пор-фиринов находится порфин. Порфин представляет собой четыре пиррольных кольца, связанных между собой метеновыми мостиками
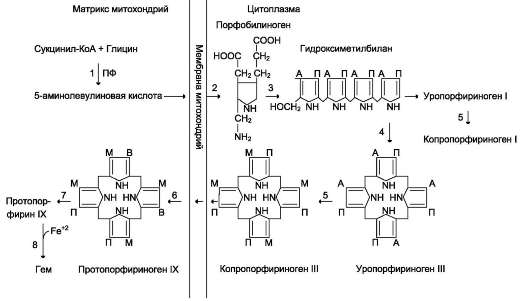
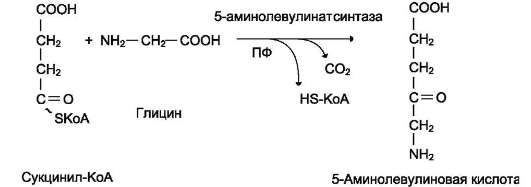
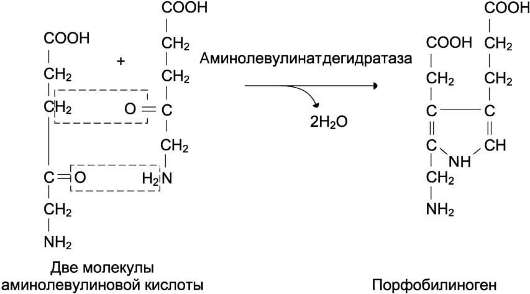
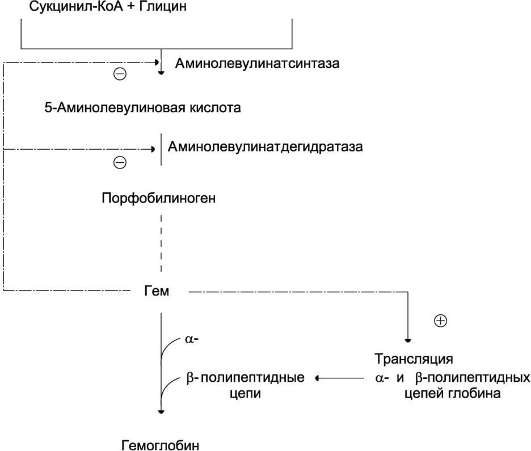 Гем по принципу отрицательной обратной связи ингибирует 5-аминолевулинатсинтазу и 5-аминолевулинатдегидратазу и является индуктором трансляции α- и β-цепей гемо глобина.
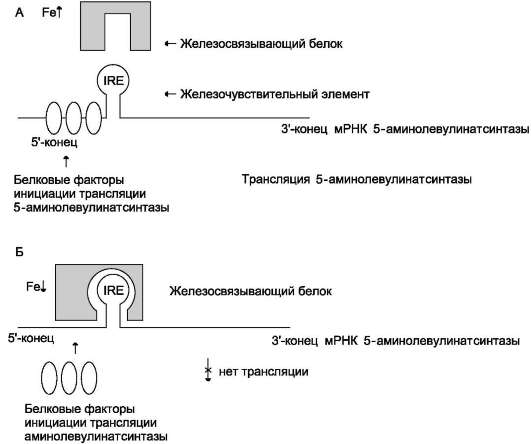 А - при высокой концентрации железа в ретикулоцитах оно присоединяется к железосвязывающему белку и снижает сродство этого белка к железочувствительному элементу (IRE) матричной РНК, кодирующей 5-аминолевулинатсинтазу. Белковые факторы инициации трансляции связываются с мРНК и инициируют трансляцию 5-аминолевулинатсинтазы. Б - при низком содержании железа в ретикулоцитах железосвязывающий белок обладает высоким сродством к IRE и взаимодействует с ним. Белковые факторы инициации трансляции не могут присоединиться к мРНК, и трансляция прекращается.
Hаследственные порфирии обусловлены генетическими дефектами ферментов, участвующих в синтезе гема, за исключением 5-аминолевули-натсинтазы.
Гем, трансферрин, ферритин, окислительные ферменты рибонуклеотидредуктазу и ксантиноксидазу, железофлавопротеины NADH-дегидрогеназу и сукцинатдегидрогеназу.
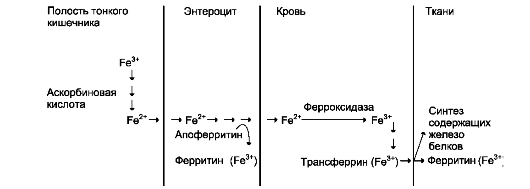 В пище железо в основном находится в окисленном состоянии (Fe3+) и входит в состав белков или солей органических кислот. Освобождению железа из солей органических кислот способствует кислая среда желудочного сока. Наибольшее количество железа всасывается в двенадцатиперстной кишке. Аскорбиновая кислота, содержащаяся в пище, восстанавливает железо и улучшает его всасывание, так как в клетки слизистой оболочки кишечника поступает только Fe2+. В суточном количестве пищи обычно содержится 15-20 мг железа, а всасывается только около 10% этого количества. Организм взрослого человека теряет около 1 мг железа в сутки.
Количество железа, которое всасывается в клетки слизистой оболочки кишечника, как правило, превышает потребности организма. Поступление железа из энтероцитов в кровь зависит от скорости синтеза в них белка апоферритина. Апоферритин «улавливает» железо в энтероцитах и превращается в ферритин, который остаётся в энтероцитах. Таким способом снижается поступление железа в капилляры крови из клеток кишечника. Когда потребность в железе невелика, скорость синтеза апоферритина повышается. Постоянное слущивание клеток слизистой оболочки в просвет кишечника освобождает организм от излишков железа. При недостатке железа в организме апоферритин в энтероцитах почти не синтезируется. Железо, поступающее из энтероцитов в кровь, транспортирует белок плазмы крови трансферрин
Депонирует железо в энтероцитах
Связывает только окисленное железо
 Окисление железа, поступающего в кровь
Когда потребность в железе невелика, скорость синтеза апоферритина повышается. При недостатке железа в организме апоферритин в энтероцитах почти не синтезируется.
Трансферрин взаимодействует со специфическими мембранными рецепторами клеток. В результате этого взаимодействия в цитозоле клетки образуется комплекс Са2+-кальмодулин-ПКС, который фосфорилирует рецептор транс-феррина и вызывает образование эндосомы. АТФ-зависимый протонный насос, находящийся в мембране эндосомы, создаёт кислую среду внутри эндосомы. В кислой среде эндосомы железо освобождается из трансферрина. После этого комплекс рецептор-апотрансферрин возвращается на поверхность плазматической мембраны клетки. При нейтральном значении рН внеклеточной жидкости апотрансферрин изменяет свою конформацию, отделяется от рецептора, выходит в плазму крови и становится способным вновь связывать ионы железа и включаться в новый цикл его транспорта в клетку. Железо в клетке используется для синтеза железосодержащих белков или депонируется в белке ферритине.
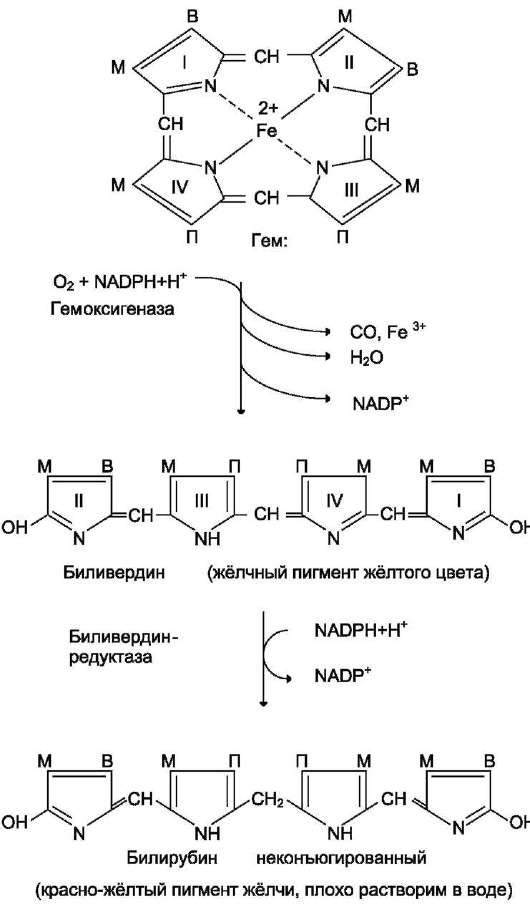 М - (-СН3) - метильная группа; В - (-СН=СН2) - винильная группа; П - (-СН2-СН2-СООН) - остаток пропионовой кислоты. В ходе реакции одна метильная группа превращается в окись углерода и, таким образом, раскрывается структура кольца. Образованный биливердин под действием биливердинредуктазы превращается в билирубин.
Селезёнка, костный мозг
Билирубин, образованный в клетках РЭС (селезёнки и костного мозга), плохо растворим в воде, по крови транспортируется в комплексе с белком плазмы крови альбумином.
Облегчённая диффузия билирубина в гепатоциты осуществляется двумя типами белков-переносчиков: лигандина (он транспортирует основное количество билирубина) и протеина Z
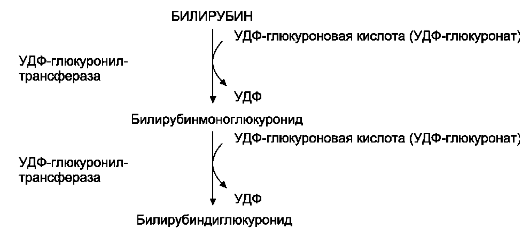
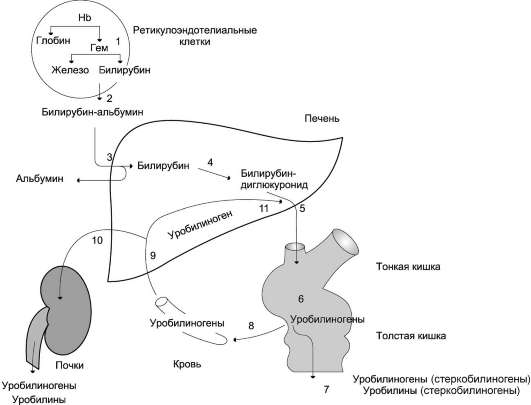 Билирубин-уробилиногеновый цикл в печени. 1 - катаболизм Hb в ретикулоэндотелиальных клетках костного мозга, селезёнки, лимфатических узлов; 2 - образование транспортной формы комплекса билирубин-альбумин; 3 - поступление билирубина в печень; 4 - образование билирубинглюкуронидов; 5 - секреция билирубина в составе жёлчи в кишечник; 6 - катаболизм билирубина под действием кишечных бактерий; 7 - удаление уробилиногенов с калом; 8 - всасывание уробилиногенов в кровь; 9 - усвоение уробилиногенов печенью; 10 - поступление части уробилиногенов в кровь и выделение почками с мочой; 11 - небольшая часть уробилиногенов секретируется в жёлчь.
Причинами гипербилирубинемии могут быть увеличение образования билирубина, превышающее способность печени экскретировать его, или повреждение печени, приводящее к нарушению секреции билирубина в жёлчь в нормальных количествах. Гипербилирубинемию отмечают также при закупорке желчевыводящих протоков печени.
Гемолитическая (надпечёночная) желтуха - результат интенсивного гемолиза эритроцитов. Она обусловлена чрезмерным образованием билирубина, превышающим способность печени к его выведению. Гемолитическая желтуха развивается при исчерпании резервных возможностей печени. Основная причина надпечёночной желтухи - наследственные или приобретённые гемолитические анемии.
Увеличены
Причиной повышения концентрации непрямого билирубина в крови служит ускоренный гемолиз и недостаточность функции белков и ферментов печени, ответственных за поглощение, конъюгацию и секрецию прямого билирубина. У новорождённых не только снижена активность УДФ-глюкуронилтрансферазы, но и, по-видимому, недостаточно активно происходит синтез второго субстрата реакции конъюгации УДФ-глюкуроната.
Причина повышения концентрации билирубина в крови - поражение и некроз части печёночных клеток. Происходит задержка билирубина в печени, чему способствует резкое ослабление метаболических процессов в поражённых гепатоцитах, которые теряют способность нормально выполнять различные биохимические и физиологические функции, в частности переводить конъюгированный (прямой) билирубин из клеток в жёлчь против градиента концентрации. Для печёночно-клеточной желтухи характерно то, что вместо преобладающих в норме диглюкуронидов билирубина в поражённой печёночной клетке образуются главным образом моноглюкурониды. В результате деструкции печёночной паренхимы образующийся прямой билирубин частично попадает в большой круг кровообращения, что ведёт к желтухе. Экскреция жёлчи также нарушена. Билирубина в кишечник попадает меньше, чем в норме.
Понижены
Механическая, или обтурационная (подпечё-ночная), желтуха развивается при нарушении желчеотделения в двенадцатиперстную кишку. Это может быть вызвано закупоркой жёлчных протоков, например при желчнокаменной болезни, опухолью поджелудочной железы, жёлчного пузыря, печени, двенадцатиперстной кишки, хроническим воспалением поджелудочной железы или послеоперационным сужением общего жёлчного протока
В моче повышена |
