|
|
все вопросы бх. А) Химическая природа ферментов Ферменты(энзимы) биологические катализаторы
14
Разобщители тканевого дыхания (динитроортокрезол)
Известны вещества, способные разобщать процессы биологического окисления и фосфорилирования. Такими свойствами обладают, как правило, липофильные соединения, содержащие фенольную группу в молекуле и являющиеся слабыми органическими кислотами. Наиболее известными и широко используемыми в хозяйственной деятельности представителями группы являются 2,4-динитрофенол (ДНФ), динитро-о-крезол (ДНОК), пентахлорфенол. При авариях на промышленных объектах и других чрезвычайных ситуациях эти вещества могут стать причиной массового поражения людей.
In vitro разобщители тканевого дыхания стимулируют скорость потребления кислорода митохондриями и индуцируют активность АТФазы. In vivo в результате их действия значительно активируются процессы биологического окисления и потребления кислорода тканями, однако содержание АТФ и других макроэргов в клетках при этом снижается. Развиваются типичные для отравления веществами общеядовитого действия признаки интоксикации. Образующаяся в ходе окисления субстратов энергия рассеивается в форме тепла, температура тела отравленного резко повышается, что является характерным признаком острого отравления разобщителями тканевого дыхания.
Биологическая роль свободного, или нефосфорилирующего, окисления.
Биологический смысл нефосфорилирующего — свободного — окисления можно видеть в многочисленных реакциях окисления, не связанных с лимоннокислым циклом и переносом водорода и электронов по дыхательной цепи. Сюда относятся, например, все внемитохондриальные процессы окисления, окислительное удаление токсически действующих веществ и многие акты регуляции количественного содержания биологически активных соединений (некоторых аминокислот, биогенных аминов, адреналина, гистидина, серотонина и т. д., альдегидов и пр.) путем более или менее интенсивного их окисления. Соотношение свободного и фосфорилирующего окисления является также одним из путей терморегуляции у человека и теплокровных животных
15
Окисли́тельное декарбоксили́рование пирува́та — биохимический процесс, заключающийся в отщеплении одной молекулы углекислого газа (СО2) от молекулы пирувата и присоединения к декарбоксилированному пирувату кофермента А (СоА) с образованием ацетил-СоА; является промежуточным этапом между гликолизом и циклом трикарбоновых кислот. Декарбоксилирование пирувата осуществляет сложный пируватдегидрогеназный комплекс (PDH), включающий в себя 3 фермента и 2 вспомогательных белка, а для его функционирования необходимы 5 кофакторов (СоА, NAD+, тиаминпирофосфат (ТРР),FAD и липоевая кислота (липоат)). Суммарное уравнение окислительного декарбоксилирования пирувата таково[1]:
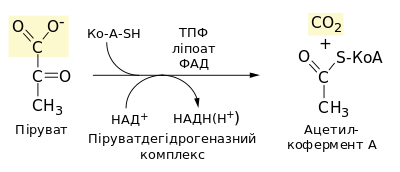
Компоненты


Работа пируватдегидрогеназного комплекса
Пируватдегидрогеназный комплекс включает в себя 3 фермента, 3 кофактора (простетическая группа,связанная с апоферментом прочно ковалентно), 2 кофермента (простетическая группа, связанная сапоферментом непрочно нековалентно):
Е1 — пируватдегидрогеназа декарбоксилирующая.
Кофактором является активная форма витамина В1 — тиаминпирофосфат.
Е2 — дигидролипоилацетилтрансфераза.
Кофактором является витаминоподобное вещество — липоевая кислота, которая присоединив 2 атомаводорода может превращаться в дигидролипоил.
Коферментом является активная форма пантотеновой кислоты — НS-КоА, она принимает ацетильныйостаток от липоевой кислоты.
Е3 — дигидролипоилдегидрогеназа .
Кофактором является флавинадениндинуклеотид (ФАД) — активная форма витамина В2.
Коферментом является активная форма витамина PP — никотинамидадениндинуклеотид (НАД+).
Регуляция
«По механизму обратной связи» ингибируют работу пируватдегидрогеназного комплекса конечные продуктыокислительного декарбоксилирования — ацетил-КоА, НАДН.Н+, а также АТФ. Увеличивает активностькомплекса пируват.
Также имеется регуляция со стороны гормонов: Инсулин увеличивает активность комплекса, глюкагон —снижает.
16.
Цикл трикарбоновых кислот — это ключевой этап дыхания всех клеток, использующих кислород, центр пересечения множества метаболических путей в организме, промежуточный этап между гликолизом и электронтранспортной цепью. Кроме значительной энергетической роли циклу отводится также и существенная пластическая функция.
Главная роль ЦТК — образование большого количества АТФ. Значения ЦТК :
1) главный источник АТФ. Энергию для образования большого количества АТФ дает полный распад Ацетил-КоА до СО2 и Н2О;
2) универсальный терминальный этап катаболизма веществ всех классов;
3) играет важную роль в процессах анаболизма (промежуточные продукты ЦТК): а) из цитрата ——>синтез жирных кислот; б) из a-кетоглутарата и ЩУК (щавеливо-уксусная кислота) ——> синтез аминокислот; в) из ЩУК ——> синтез углеводов; г) из Сукцинил-КоА ——> синтез гема гемоглобина.
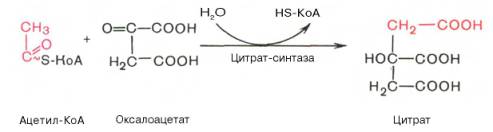
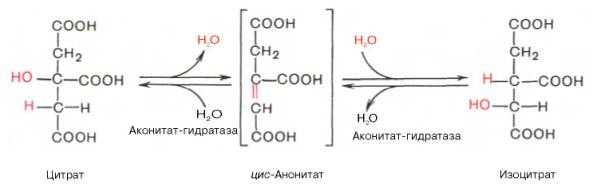
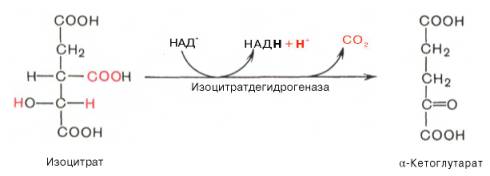
Данный цикл происходит в матриксе митохондрий и состоит
из восьми последовательных реакций.
1.
2. 
3. 
4. 
5. 
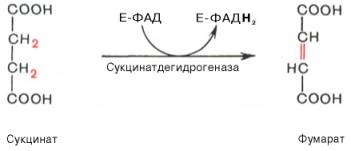
6. 
7. 
8. 
Главным и основным регулятором ЦТК является оксалоацетат, а точнее его доступность. Наличие оксалоацетата вовлекает в ЦТК ацетил-SKoA и запускает процесс.
17.
Переваривание углеводов
Переваривание это процесс гидролиза веществ до их ассимилируемых форм. Переваривание бывает: 1). Внутриклеточное (в лизосомах); 2). Внеклеточное (в ЖКТ): а). полостное (дистантное); б). пристеночное (контактное).
Переваривание углеводов в ротовой полости (полостное)
В ротовой полости пища измельчается при пережёвывании и смачивается слюной. Слюна состоит на 99% из воды и обычно имеет рН 6,8. В слюне присутствует эндогликозидаза α-амилаза (α-1,4-гликозидаза),расщепляющая в крахмале внутренние α-1,4-гликозидные связи с образованием крупных фрагментов — декстринов и небольшого количества мальтозы и изомальтозы. Необходим ион Cl-.
Переваривание углеводов в желудке (полостное)
Действие амилазы слюны прекращается в кислой среде (рН <4) содержимого желудка, однако, внутри пищевого комка активность амилазы может некоторое время сохраняться. Желудочный сок не содержит ферментов, расщепляющих углеводы, в нем возможен лишь незначительный кислотный гидролиз гликозидных связей.
Переваривание углеводов в тонком кишечнике (полостное и пристеночное)
В двенадцатиперстной кишке кислое содержимое желудка нейтрализуется соком поджелудочной железы (рН 7,5—8,0 за счет бикарбонатов). С соком поджелудочной железы в кишечник поступает панкреатическая α-амилаза. Эта эндогликозидаза гидролизует внутренние α-1,4-гликозидные связи в крахмале и декстринах с образованием мальтозы (2 остатка глюкозы, связанные α-1,4-гликозидной связью), изомальтозы (2 остатка глюкозы, связанные α-1,6-гликозидной связью) и олигосахаридов, содержащих 3—8 остатков глюкозы, связанных α-1,4- и α-1,6-гликозидными связями.
Переваривание мальтозы, изомальтозы и олигосахаридов происходит под действием специфических ферментов - экзогликозидаз, образующих ферментативные комплексы. Эти комплексы находятся на поверхности эпителиальных клеток тонкого кишечника и осуществляют пристеночное пищеварение.
Сахаразо-изомальтазный комплекс состоит из 2 пептидов, имеет доменное строение. Из первого пептида образован цитоплазматический, трансмембранный (фиксирует комплекс на мембране энтероцитов) и связывающий домены и изомальтазная субъединица. Из второго - сахаразная субъединица. Сахаразная субъединица гидролизует α-1,2-гликозидные связи в сахарозе, изомальтазная субъединица - α-1,6-гликозидные связи в изомальтозе, α-1,4-гликозидные связи в мальтозе и мальтотриозе. Комплекса много в тощей кишке, меньше в проксимальнойи дистальной частях кишечника.
Гликоамилазный комплекс, содержит две каталитические субъединицы, имеющие небольшие различия в субстратной специфичности. Гидролизует α-1,4-гликозидные связи в олигосахаридах (с восстанавливающего конца) и в мальтозе. Наибольшая активность в нижних отделах тонкого кишечника.
β-Гликозидазный комплекс (лактаза) гликопротеин, гидролизует β-1,4-гликозидные связи в лактозе. Активность лактазы зависит от возраста. У плода она особенно повышена в поздние сроки беременности и сохраняется на высоком уровне до 5-7-летнего возраста. Затем активность лактазы снижается, составляя у взрослых 10% от уровня активности, характерного для детей.
Трегалаза гликозидазный комплекс, гидролизует α-1,1-гликозидные связи между глюкозами в трегалозе — дисахариде грибов.
Переваривание углеводов заканчивается образованием моносахаридов – в основном глюкозы, меньше образуется фруктозы и галактозы, еще меньше – маннозы, ксилозы и арабинозы.
Всасывание углеводов
Моносахариды всасываются эпителиальными клетками тощей и подвздошной кишок. Транспорт моносахаридов в клетки слизистой оболочки кишечника может осуществляться путём диффузии (рибоза, ксилоза, арабиноза), облегчённой диффузии с помощью белков переносчиков (фруктоза, галактоза, глюкоза), и путем вторично-активного транспорта (галактоза, глюкоза). Вторично-активный транспорт галактозы и глюкозы из просвета кишечника в энтероцит осуществляется симпортом с Na+. Через белок-переносчик Na+ двигается по градиенту своей концентрации и переносит с собой углеводы против их градиента концентраций. Градиент концентрации Na+ создаётся Nа+/К+-АТФ-азой.
При низкой концентрации глюкозы в просвете кишечника она транспортируется в энтероцит только активным транспортом, при высокой концентрации - активным транспортом и облегчённой диффузией. Скорость всасывания: галактоза > глюкоза > фруктоза > другие моносахариды. Моносахариды выходят из энтероцитов в направлении кровеносного капилляра с помощью облегченной диффузии через белки-переносчики.
Нарушение переваривания и всасывания углеводов
Недостаточное переваривание и всасывание переваренных продуктов называют мальабсорбцией. В основе мальабсорбции углеводов могут быть причины двух типов:
1). Наследственные и приобретенные дефекты ферментов, участвующих в переваривании. Известны наследственные дефекты лактазы, α-амилазы, сахаразно-изомальтазного комплекса. Без лечения эти патологии сопровождаются хроническим дисбактериозом и нарушениями физического развития ребёнка.
Приобретённые нарушения переваривания могут наблюдаться при кишечных заболеваниях, например гастритах, колитах, энтеритах, после операций на ЖКТ.
Дефицит лактазы у взрослых людей может быть связан со снижением экспрессии гена лактазы, что проявляться непереносимостью молока - наблюдается рвота, диарея, спазмы и боли в животе, метеоризм.
2). Нарушение всасывания моносахаридов в кишечнике.
Нарушения всасывания могут быть следствием дефекта какого-либо компонента, участвующего в системе транспорта моносахаридов через мембрану. Описаны патологии, связанные с дефектом натрийзависимого белка переносчика глюкозы.
Синдром мальабсорбции сопровождается осмотической диареей, усилением перистальтики, спазмами, болями, а также метеоризмом. Диарею вызывают нерасщеплённые дисахариды или невсосавшиеся моносахариды в дистальных отделах кишечника, а также органические кислоты, образованные микроорганизмами при неполном расщеплении углеводов.

18. Биологическая роль, синтез и распад гликогена. Особенности распада гликогена в печени и скелетных мышцах.
Многие ткани синтезируют в качестве резервной формы глюкозы гликоген. Синтез и распад гликогена обеспечивают постоянство концентрации глюкозы в крови и создают депо для её использования тканями по мере необходимости.
Синтез гликогена. Глюкоза, поступающая в клетку, фосфорилируется при участии АТФ (реакция 1). Затем глюкозо-6-фосфат в ходе обратимой реакции превращается в глюкозо-1 -фосфат (реакция 2) под действием фермента фосфоглюкомутазы. Реакция 3 - стадия образования уридинди-фосфатглюкозы из УТФ и глюкозо-1-фосфата. Фермент, катализирующий эту реакцию, назван по обратной реакции: УДФ-глюкопирофосфорилаза. Однако в клетке обратная реакция не протекает, потому что образовавшийся в ходе прямой реакции пирофосфат очень быстро расщепляется пирофосфатазой на 2 молекулы фосфата. Образованная УДФ-глюкоза далее используется как донор остатка глюкозы при синтезе гликогена (реакция 4). Эту реакцию катализирует фермент гликогенсинтаза (глюкозилтрансфераза). Так как гликоген в клетке никогда не расщепляется полностью, синтез гликогена осуществляется путём удлинения уже имеющейся молекулы полисахарида, называемой "затравка", или "праймер". К "затравке" последовательно присоединяются молекулы глюкозы. Строением молекулы "затравки" как бы предопределяется тип связи, который возникает в реакции трансгли-козилирования. Таким образом, синтезируется полисахарид, аналогичный по строению с "затравочным". В состав "затравки" может входить белок гликогенин, в котором к ОН-группе одного из тирозиновых остатков присоединена олигосахаридная цепочка (примерно 8 остатков глюкозы). Глюкозные остатки переносятся гликогенсинтазой на нередуцирующий конец олигосахарида и связываются α-1,4-гликозидными связями. По окончании синтеза гликогенин остаётся включённым в гранулу гликогена. Разветвлённая структура гликогена образуется при участии амило-1,4 →1,6-глюкозилтрансферазы, называемой ферментом "ветвления"
19.
Гликолиз — это сложный ферментативный процесс расщепления глюкозы до двух молекул пирувата (аэробный гликолиз) или двух молекул лактата (анаэробный гликолиз, протекающий без потребления кислорода).
Биологическая роль гликолиза:
1. Генерирование АТФ. Гликолиз — единственный процесс в клетках, продуцирующий АТФ без потребления кислорода. Клетки, имеющие мало или не имеющие вообще митохондрий, получают АТФ только в ходе гликолиза.
Значение гликолиза для эритроцитов. Гликолиз — единственный процесс, продуцирующий АТФ в эритроцитах и поддерживающий их целостность и функции.
2. Является источником углеводородных радикалов для процессов биосинтеза в клетках
Уравнения реакций
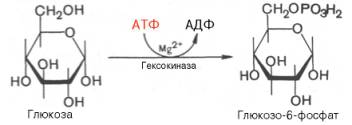
1.
2.
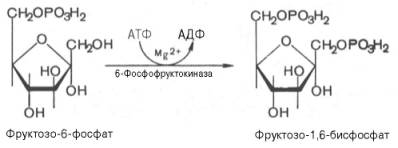
3.
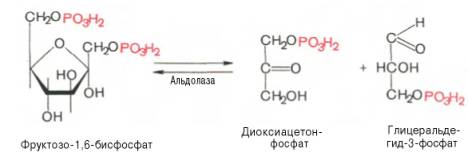
4.
5.
6.
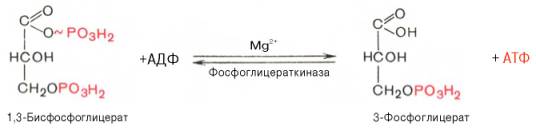
7.
8. 
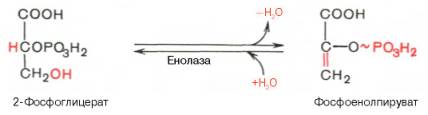
9. 
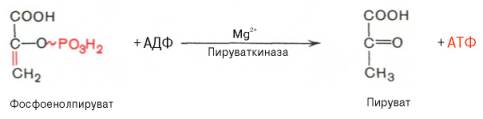
10. 
11. 

20. Биологическая роль аэробного окисления глюкозы, его основные этапы и расчет энергии окисления глюкозы в аэробных условиях.
Аэробным называется окисление биологических субстратов с выделением энергии, протекающее при использовании кислорода в качестве конечного акцептора водорода в дыхательной цепи. В качестве доноров водорода выступают восстановленные формы коферментов (НАДН, ФАДН2 и НАДФН), образующиеся в промежуточных реакциях окисления субстратов.
Аэробное дихотомическое окисление глюкозы является основным путём катаболизма глюкозы в организме человека и может происходить во всех органах и тканях. В результате этих реакций глюкоза расщепляется до СО2 и Н2О, а выделяющаяся энергия аккумулируется в АТФ.
1. Аэробный путь окисления глюкозы и его энергетика.
Аэробный путь окисления глюкозы происходит в 3 этапа:
1. окисление молекулы глюкозы до 2 молекул пирувата;
2. окислительное декарбоксилирование пирувата (с образованием 2 молекул ацетил-КоА);
3. реакции цикла Кребса, где каждая молекула ацетил-КоА сгорает с образованием 12 АТФ.
1-ый этап. Окисление молекулы глюкозы до 2 молекул пирувата - это первые 10 реакций гликолиза. Суммарная реакция 1 этапа: Глюкоза + 2 НАД+ + 2 АДФ ^ 2 пирувата + 2 НАДН + Н+ + 2 АТФ
2-ой этап. Окислительное декарбоксилирование пирувата (с образованием 2 молекул ацетил-КоА) происходит в матриксе митохондрий и осуществляется мультиферментным комплексом пируватдегидрогеназой. В его состав входят 3 фермента и 5 коферментов:
1. Пируватдекарбоксилаза - кофермент тиаминпирофосфат (активная форма витамина В1).
2. Дегидролипоилацетилтрансфераза - кофермента: в активном центре - липоевая кислота (витаминоподобное вещество), из матрикса митохондрий используется Коэнзим А (КоА
8Н).
3. Дигидролипоилдегидрогеназа - коферменты: в активном центре - ФАД, из матрикса митохондрий используется - НАД.
Суммарная реакция: 2 Пируват + 2 НАД+ + КоА ^ 2 ацетил-КоА + 2 НАДН + Н+
Каждый восстановленный НАД в митохондриях отдает протоны и электроны в полную ц.п.э., где образуется 2 х 3 АТФ = 6 АТФ. Таким образом, ценность второго этапа - 6 АТФ. Эти реакции происходят только в аэробных условиях!
3-ий этап. Реакции цикла Кребса, где каждая молекула ацетил-КоА сгорает с образованием 12 АТФ. Следовательно, энергетический выход третьего этапа (в расчете на молекулу глюкозы) - 2 х 12 АТФ = 24 АТФ
2. Челночные механизмы переноса НАДН из цитозоля в матрикс митохондрий.
Образующийся в ходе аэробного окисления каждый НАДН отдает протоны и электроны в митохондриальную цепь переноса электронов с помощью челночных механизмов (см. наглядный материал): малат-аспартатного. В случае малат-аспартатного челнока митохондриальным акцептором протонов и электронов является НАД+. При работе малат-аспартатного челнока в результате реакций окислительного фосфорилирования, сопряженного с цепью переноса электронов, образуется 3 АТФ (в полной ц.п.э.) . Следовательно, в результате первого этапа окисления глюкозы образуется 2 АТФ (7-ая и 10-ая реакции гликолиза -субстратное фосфорилирование) + 2 х [3 (или 2)] АТФ при окислении каждого НАДН в ц.п.э. = 8 (или 6) АТФ.
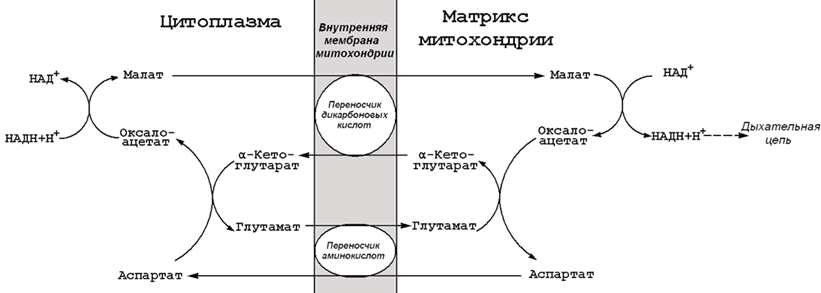
3. Энергетическая ценность аэробного окисления глюкозы:
1 этап - 8 (6) АТФ
2 этап - 6 АТФ
3 этап - 24 АТФ Итого: 38 (36) АТФ
(разница в 2 АТФ зависит от челнока, который переносит протоны и электроны из цитозоля от НАДН, образованного в 6-ой реакции гликолиза в митохондрии в ц.п.э.).
Аэробное окисление глюкозы является главным источником энергии для большинства клеток организма.
|
|
|
 Скачать 6.2 Mb.
Скачать 6.2 Mb.