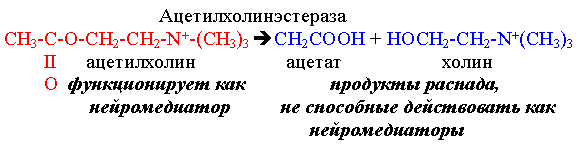все вопросы бх. А) Химическая природа ферментов Ферменты(энзимы) биологические катализаторы
 Скачать 6.2 Mb. Скачать 6.2 Mb.
|
|
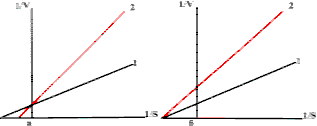
Активный центр — это особая часть молекулы фермента, определяющая её специфичность и каталитическую активность. Активный центр непосредственно осуществляет взаимодействие с молекулой субстрата или с теми её частями, которые непосредственно участвуют в реакции. Характер взаимодействия фермента и субстрата говорит о наличии в активном центре ряда структурных групп, соединяющихся с различными участками субстрата. В активном центре условно выделяют: каталитический центр — непосредственно химически взаимодействующий с субстратом; связывающий центр (контактная или «якорная» площадка) — обеспечивающий специфическое сродство к субстрату и формирование комплекса фермент-субстрат. В) теории образования фермент-субстратного комплекса по Э. Фишеру и Д. Кошланду: 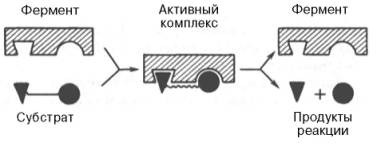 Образование нестойкого фермент-субстратного комплекса согласно теории Э. Фишера «ключ-замок».  Изменения структуры активного центра фермента, вызванные субстратом, согласно модели «индуцированного соответствия» Д. Кошленда. Г) уравнение скорости ферментативной реакции, график зависимости скорости ферментативной реакции от концентрации субстрата (кривая субстратного насыщения), константа Михаэлиса и ее биологический смысл: Уравне́ние Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата. Уравнение названо в честь физикохимиков Леонора Михаэлиса и Мод Леоноры Ментен. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса: Уравнение имеет вид: где  график зависимости скорости ферментативной реакции от концентрации субстрата (кривая субстратного насыщения) Константа Михаэлиса, Км (Michaelis constant, Km) — кинетический параметр ферментативной реакции, численно равный концентрации субстрата, при которой скорость реакции составляет половину максимальной; К.М. характеризует сродство фермента к субстрату: чем меньше значение К.М., тем сильнее связывание фермента с субстратом. 5. Регуляция действия ферментов В живой клетке скорость ферментативных реакций находится под строгим контролем, что позволяет каждой метаболической цепочке реакций постоянно изменяться, приспосабливаясь к меняющимся потребностям клетки в продукте.
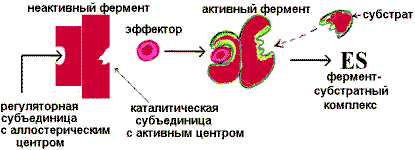
В каждой метаболической цепи есть фермент, который задает скорость всей цепочке реакций. Он называется регуляторным ферментом. Существует несколько способов регуляции действия ферментов: изменение активности фермента при его постоянной концентрации; изменение концентрации фермента, обычно в результате ускорения (индукции) или торможения (репрессии) синтеза фермента; Основные способы регуляции активности ферментов Аллостерическая регуляция. Фермент изменяет активность с помощью нековалентно связанного с ним эффектора. Связывание происходит в участке, пространственно удаленном от активного (каталитического) центра. Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. Активность может увеличиться - это активация фермента, или уменьшиться - это ингибирование.
«Сообщение» о присоединении аллостерического активатора передается посредством конформационных изменений каталитической субъединице, которая становится комплементарной субстрату, и фермент «включается». При удалении активатора фермент вновь переходит в неактивную форму и «выключается». Аллостерическая регуляция является основным способом регуляции метаболических путей. Регуляция активности ферментов путем фосфорилирования-дефосфорилирования . Фермент изменяет активность в результате ковалентной модификации.
В этом случае фосфатная группа - ОРО32- присоединяется к гидроксильным группам в остатках серина, треонина или тирозина. В зависимости от природы фермента фосфорилирование может его активировать или, наоборот, инактивировать. Реакция присоединения фосфатной группы и ее отщепление катализируют специальные ферменты - протеинкиназы и протеинфосфатазы. Регуляция путем ассоциации-диссоциации субъединиц в олигомерном ферменте. Этот процесс иногда начинается с ковалентной или нековалентной модификации одной из субъединиц. Например, фермент протеинкиназа в неактивной форме построена как тетрамер R2C2 (R и С - разные субъединицы). Активная протеинкиназа представляет собой субъединицу С, для освобождения которой необходима диссоциация комплекса. Активация фермента происходит при участии cAMP (циклоаденозинмонофосфорная кислота), которая способна присоединиться к субъединице R, после чего изменяется конформация, комплементарность субъединиц R и С и происходит диссоциация комплекса: R2C2 + 2cАМР 2С + 2(R -сАМР) Циклический АМР является продуктом АТР, превращение которой катализирует фермент аденилатциклаза: АТРс АМР + Н4Р2О7 Аденилатциклазная система. Аденилатциклаза и протеинкиназа катализируют взаимосвязанные реакции, которые составляют единую регуляторную систему.
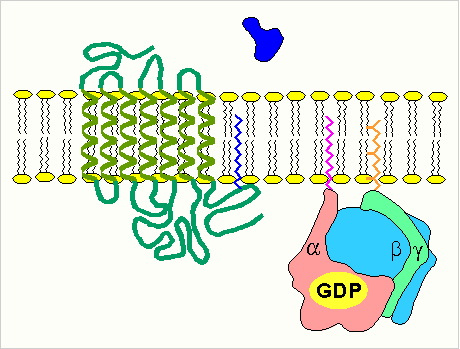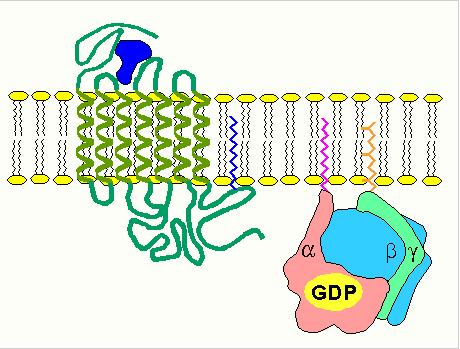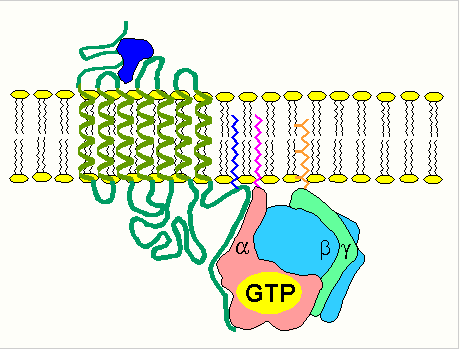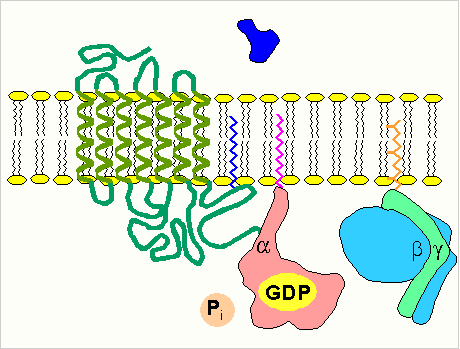
С помощью этой системы в клетку передаются сигналы из внеклеточной среды, и в нужном направлении изменяется метаболизм клетки. Внеклеточным вестником сигнала могут быть разные молекулы, в том числе и гормоны. Эти молекулы не проникают внутрь клетки, но «узнаются» мембранными рецепторами. При активации аденилатциклазы происходят следующие этапы:
изменение конформации рецептора после присоединения к нему сигнальной молекулы и увеличение его сродства к регуляторному G-белку. В результате образуется комплекс рецептора и протомеров G-белка; образование этого комплекса приводит к изменению конформации a -протомера G-белка, который теряет сродство к GDP и происходит замена GDP на GTP. В результате комплекс протомеров G-белка распадается; a -протомер взаимодействует с аденилатциклазой, что ведет к изменению ее конформации и как следствие этого - активации; после этого аденилатциклаза катализирует синтез cAMP, который в свою очередь активирует cAMP-зависимую протеинкиназу. Активация последней связана с диссоциацией комплекса входящих в нее протомеров после присоединения cAMP. Протеинкиназа фосфорилирует соответствующие ферменты, изменяет их активность и, следовательно, скорость метаболизма в клетке. Активация ферментов путем частичного протеолиза. Некоторые ферменты синтезируются первоначально неактивными и лишь после секреции из клетки переходят в активную форму. Неактивный предшественник называется проферментом. Активация профермента включает модификацию первичной структуры с одновременным изменением конформации. Например, трипсиноген, синтезированный в поджелудочной железе, затем в кишечнике превращается в трипсин путем удаления фрагмента с N-конца: энтеропептидаза трипсиногентрипсин + Val-(Acn) -Lys Расщепление определенных пептидных связей «запускает» новые взаимодействия R-групп по всей молекуле, приводя к новой конформации, в которой R-группы активного центра занимают оптимальное положение для катализа. Нарушения структуры какого-либо фермента, ведущие к снижению его активности, приводят к нарушению метаболических путей, в которых участвует этот фермент. Такие нарушения почти всегда проявляются как болезни. Повреждения ферментов бывают двух типов: наследственные дефекты строения фермента и повреждения, вызванные попадающими в организм токсическими веществами, ингибирующими фермент. Ингибиторы ферментов Действие ферментов можно полностью или частично подавить (ингибировать) определенными химическими веществами (ингибиторами). По характеру действия ингибиторы могут быть обратимыми и необратимыми. В основе этого деления лежит прочность соединения ингибитора с ферментом. Другой способ деления ингибиторов основывается на характере места их связывания. Одни из них связываются с ферментом в активном центре, а другие - в удаленном от активного центра месте. Они могут связывать и блокировать функциональную группу молекулы фермента, необходимую для проявления его активности. При этом они необратимо, часто ковалентно, связываются с ферментом или фермент - субстратным комплексом и необратимо изменяют нативную конформацию. Это, в частности, объясняет действие Hg2+, Pb2+, соединений мышьяка. Ингибиторы такого рода могут быть полезны при изучении природы ферментативного катализа. Например, диизопропилфторфосфат ингибирует ферменты, имеющие серин в активном центре. Таким ферментом является ацетилхолинэстераза, катализирующая следующую реакцию:
Реакция происходит каждый раз после проведения нервного импульса, прежде чем второй импульс будет передан через синапс. Диизопропилфторфосфат - одно из отравляющих веществ нервно-паралитического действия, так как приводит к утрате способности нейронов проводить нервные импульсы.
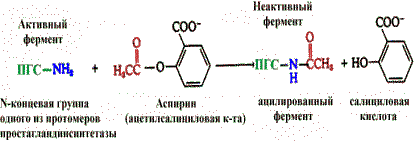
Терапевтическое действие аспирина как жаропонижающего и противовоспалительного средства объясняется тем, что аспирин ингибирует один из ферментов, катализирующий синтез простагландинов (ПГ). Простагландины - вещества, участвующие в развитии воспаления. Ингибирование обусловлено ковалентной модификацией одной из аминогрупп фермента - простагландинсинтетазы.
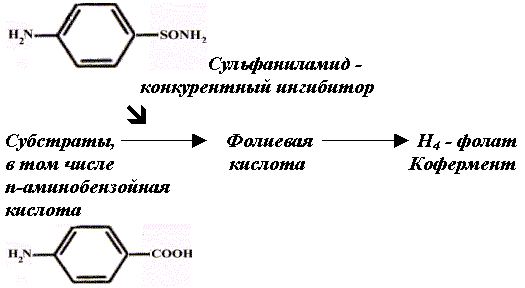
Обратимые ингибиторы. Существует два типа подобных ингибиторов - конкурентные и неконкурентные. Конкурентный ингибитор конкурирует с субстратом за связывание с активным центром. Это происходит потому, что ингибитор и субстрат имеют сходные структуры:
В отличие от субстрата связанный с ферментом конкурентный ингибитор не подвергается ферментативному превращению. Более того, образование EI уменьшает число молекул свободного фермента, и скорость реакции снижается. Связывание S и I происходит взаимоисключающим образом. Образуется либо ES, либо EI, но не EIS. Так как конкурентный ингибитор обратимо связывается с ферментом, то можно сдвинуть равновесие реакции E + I ↔ EI влево простым увеличением концентрации субстрата. Конкурентными ингибиторами являются многие химиотерапевтические средства. Например, сульфамидные препараты, используемые для лечения инфекционных болезней. Сульфаниламиды – это структурные аналоги парааминобензойной кислоты, из которой в клетке микроорганизма синтезируется кофермент (Н4 - фолат), участвующий в биосинтезе нуклеиновых оснований. Нарушение синтеза нуклеиновых кислот приводит к гибели микроорганизмов.
Неконкурентное обратимое ингибирование не может быть ослаблено или устранено повышением концентрации субстрата, так как эти ингибиторы присоединяются к ферменту не в активном центре, а в другом месте.
Связывание приводит к изменению конформации фермента и нарушению комплементарности к субстрату. Неконкурентные ингибиторы могут обратимо связываться как со свободным ферментом, так и с комплексом ES. Наиболее важными неконкурентными ингибиторами являются образующиеся в живой клетке промежуточные продукты метаболизма, способные обратимо связываться с определенными участками ферментов (аллостерические центры) и изменять их активность, что является одним из способов регуляции метаболизма. Исследование действия ингибиторов используется при изучении механизма действия фермента, кроме того, помогает в поисках более эффективных лекарственных средств, так как лечебное действие многих лекарств обусловлено тем, что они являются ингибиторами определенных ферментов. Структурные аналоги коферментов тоже могут быть ингибиторами. Кинетические тесты позволяют отличить конкурентное ингибирование от неконкурентного.
6. Биохимия витаминов. Классификация: Витамины относятся по своей химической структуре к абсолютно разным классам химических соединений, поэтому какая-то общая химическая классификация витаминов в данном случае невозможна. Их различают по растворяемости на два класса: -Жирорастворимые витамины: А, Д, Е, К, провитамин А (каротиноиды). -Водорастворимые витамины: В1, В2, В5, В6, В9, В12, С, Н, РР. По физиологическому действию на человеческий организм классификация витаминов выглядит следующим образом: антиоксиданты (витамины А, С, Е, каротиноиды); прогормоны (витамин А и Д); коферменты (витамины В6, В1, В2, РР, В5, В9, В12, витамин К, витамин Н). Определение и причины гипо-,гипер- и авитаминозов: Гиповитаминоз - болезненное состояние, возникающее при нарушении соответствия между расходованием витаминов и поступлением их в организм; то же, что витаминная недостаточность. Гиповитаминоз развивается при недостаточном поступлении витаминов. Гиповитаминоз развивается незаметно: появляется раздражительность, повышенная утомляемость, снижается внимание, ухудшается аппетит, нарушается сон. Систематический длительный недостаток витаминов в пище снижает работоспособность, сказывается на состоянии отдельных органов и тканей (кожа, слизистые, мышцы, костная ткань) и важнейших функциях организма, таких как рост, интеллектуальные и физические возможности, продолжение рода, защитные силы организма. Гипервитаминоз - острое расстройство в результате интоксикации сверхвысокой дозой одного или нескольких витаминов (содержащихся в пище или витаминсодержащих препаратах). Чаще всего гипервитаминозы вызываются приёмом резко повышенных доз витаминов А и D. Лечение производится отменой приёма витаминов, обильным питьём (форсированный диурез), антидотами. Авитаминоз - заболевание, являющееся следствием длительного неполноценного питания, в котором отсутствуют какие-либо витамины. Причины авитаминоза: -Нарушение поступления витаминов с пищей при неправильном питании, недостаточном или некачественном питании. -Нарушение процессов пищеварения или нарушение работы органов, связанных непосредственно с пищеварением. -Поступление в организм антивитаминов, например лекарственных препаратов синкумар, дикумарол, применяющихся при лечении повышенной свертываемости крови. 3. Провитамины, антивитамины: Провитамины - биохимические предшественники витаминов. Основные провитамины: Каротин — жёлто-оранжевый пигмент, непредельный углеводород из группы каротиноидов, провитамин витамина А Триптофан — незаменимая аминокислота в организме человека, является своего рода провитамином, так как бактериальная флора кишечника человека может синтезировать из неё витамин B3 Эргостерин — провитамин витамина D2, полициклический спирт (стероид), содержащийся в дрожжах, грибах, некоторых водорослях. 7-Дегидрохолестерин — провитамин витамина D3, содержится в коже человека. Антивитаминами называют вещества, которые различными способами нарушают биохимическое использование витаминов живой клеткой, что приводит к состоянию недостаточности какого-либо определенного витамина или группы витаминов. Антивитамины можно разделить на две основные группы. К первой группе относятся химические вещества, которые инактивируют витамин путем его расщепления, разрушения или связывания его молекул в неактивные формы. Ко второй группе относятся химические вещества структурно-подобные или структурно-родственные витаминам. Эти вещества вытесняют витамины из биологически активных соединений и, таким образом, делают их неактивными. В результате действия антивитаминов обеих групп нарушается нормальное течение процесса обмена веществ в организме. Примеры: Авидин(связывается с вит.Н(биотин), образуется неактивное в-во), тиаминаза, аскорбиназа, липоксидаза, пиридин-3-сульфоновая кислота. В1,В2,В6,фолиевая кислота, РР, В12. В1(тиамин, антиневритный). Кофермент – тиаминпирофосфат(ТПФ). Биологическая роль: участвует в ЦТК, ПФП, ок.декарбоксилировании пирувата. В природе тиамин синтезируется растениями и многими микроорганизмами. Животные и человек не могут синтезировать тиамин и получают его вместе с пищей. В тиамине нуждаются все животные за исключением жвачных, так как бактерии в их кишечнике синтезируют достаточное количество витамина. Всасываясь из кишечника, тиамин фосфорилируется и превращается в тиаминпирофосфат. Тиаминпирофосфат (ТПФ) — активная форма тиамина — является коферментом пируватдекарбоксилазного и α-кетоглутаратдегидрогеназного комплексов, а также транскетолазы. Первые два фермента участвуют в метаболизме углеводов, транскетолаза функционирует в пентозофосфатном пути, участвуя в переносе гликоальдегидного радикала между кето- и альдосахарами. ТПФ синтезируется ферментом тиаминпирофосфокиназой, главным образом в печени и в ткани мозга. Реакция требует присутствия свободного тиамина, ионов Mg2+ и АТФ. 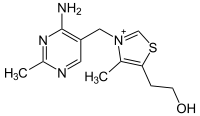 Дефицит: Системный дефицит тиамина является причинным фактором развития ряда тяжёлых расстройств, ведущее место в которых занимают поражения нервной системы. Комплекс последствий недостаточности тиамина известен под названием болезни бери-бери и синдрома Корсакова-Вернике. Как правило, развитие дефицита тиамина бывает связано с нарушениями в питании. Это может быть как следствием недостаточного поступления тиамина с пищей, так и происходить в результате избыточного употребления продуктов, содержащих значительные количества антитиаминовых факторов. Так, свежие рыба и морепродукты содержат значительные количества тиаминазы, разрушающей витамин; чай и кофе ингибируют всасывание тиамина. При бери-бери наблюдаются слабость, потеря веса, атрофия мышц, невриты, нарушения интеллекта, расстройства со стороны пищеварительной и сердечно-сосудистой системы, развитие парезов и параличей. Одной из форм бери-бери, встречающейся преимущественно в развитых странах, является синдром Гайе-Вернике (иначе — синдром Вернике-Корсакова), развивающийся при алкоголизме. Синдром Корсакова-Вернике является потенциально фатальным неврологическим расстройством, что видно наиболее часто у алкоголиков. Алкоголь напрямую влияет на механизмы фосфорилирования / дефосфорилирования тиамина что приводит к сильному уменьшению концентрации активной формы тиамина. Энцефалопатия Вернике и Корсакова психоз два отдельных диагноза. Этот синдром вызывает повреждения головного мозга в третьем и четвёртом желудочке, таламусе и маммилярных органах. Прогресс болезни приводит к психозу и необратимому повреждению в областях мозга, связанных с памятью. Симптомы энцефалопатии Корсакова-Вернике включают в себя: Путаницу и потерю умственной деятельности, что может прогрессировать до комы Потеря мышечной координации (атаксия) Аномальные движения глаз, двоение в глазах Неспособность сформировать новые воспоминания Потеря памяти Лечение энцефалопатии Вернике включает внутривенное введение тиамина в течение 3-5 дней с последующим приемом высокой потенции B-витаминного комплекса, пока улучшение продолжается. При нарушении обмена тиамина в первую очередь возникает расстройство окислительного декарбоксилирования α-кетокислот и частично блокируется метаболизм углеводов. У больных бери-бери происходит накопление недоокисленных продуктов обмена пирувата, которые оказывают токсическое действие на ЦНС и обусловливают развитие метаболического ацидоза. Вследствие развития энергодефицита снижается эффективность работы ионных градиентных насосов, в том числе клеток нервной и мышечной ткани. Нарушается синтез жирных кислот и трансформация углеводов в жиры. Усиление катаболизма белков ведёт к развитию мышечной атрофии, у детей — к задержке физического развития. Вследствие затруднения образования из пировиноградной кислоты ацетил КоА страдает процесс ацетилирования холина. В2(рибофлавин) Кофмермент: флавинмононуклеотид(ФМН), флавинадениндинуклеотид(ФАД). Флавиновые ферменты принимают участие в окислении жирных, янтарной и других кислот; инактивируют и окисляют высокотоксичные альдегиды, расщепляют в организме чужеродные D-изомеры аминокислот, образующиеся в результате жизнедеятельности бактерий; участвуют в синтезе коферментных форм витамина B6 и фолацина; поддерживают в восстановленном состоянии глутатион и гемоглобин. В ферментах коферменты функционируют как промежуточные переносчики электронов и протонов, отщепляемых от окисляемого субстрата. Дефицит: Витамин B2 необходим для образования эритроцитов, антител, для регуляции роста и репродуктивных функций в организме. Он также необходим для здоровья кожи, ногтей, роста волос и в целом для здоровья всего организма, включая функцию щитовидной железы. Внешними проявлениями недостаточности рибофлавина у человека являются поражения слизистой оболочки губ с вертикальными трещинами и слущиванием эпителия (хейлоз), изъязвления в углах рта (ангулярный стоматит), отёк и покраснение языка (глоссит), Себорейный дерматит на носогубной складке, крыльях носа, ушах, веках. Часто развиваются также изменения со стороны органов зрения: светобоязнь, васкуляризация роговой оболочки, конъюнктивит, кератит и в некоторых случаях — катаракта. В ряде случаев при авитаминозе имеют место анемия и нервные расстройства, проявляющиеся в мышечной слабости, жгучих болях в ногах и др. Основные причины недостатка рибофлавина у человека — недостаточное потребление продуктов содержащих этот витамин; неправильное хранение и приготовление продуктов содержащих данный витамин, вследствие чего содержание витамина резко уменьшается; хронические заболевания желудочно-кишечного тракта, приём медикаментов, являющихся антагонистами рибофлавина. 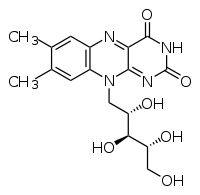 В6(пиридоксин, пиридоксаль) Кофермент: пиридоксальфосфат. 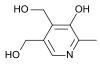 Биологическая роль: принимает участие в образовании эритроцитов; участвует в процессах усвоения нервными клетками глюкозы; необходим для белкового обмена и трансаминирования аминокислот; принимает участие в обмене жиров; оказывает гипохолестеринемический эффект; оказывает липотропный эффект, достаточное количество пиридоксина необходимо для нормального функционирования печени. Дефицит: полиневриты, отеки, анемии, повышенная возбудимость ЦНС, судороги. РР(никотиновая кислота, В3) Кофермент: коф.А(коэнзим А, HS-KoA),4-фосфопантетеин. Биологическая роль: участвует в синтетических реакциях репликации и репарации, переносе ацильных групп. Гиповитаминоз РР приводит к пеллагре — заболеванию, симптомами которого являются дерматит, диарея, деменция. 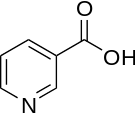 Вит.С,Р, пантотеновая кислота, биотин. Вит.С(аскорбиновая кислота) Биологическая роль: Образование коллагена, серотонина из триптофана, образование катехоламинов, синтез кортикостероидов. Аскорбиновая кислота также участвует в превращении холестерина в желчные кислоты. Витамин С необходим для детоксикации в гепатоцитах при участии цитохрома P450. Витамин С сам нейтрализует супероксидный радикал до перекиси водорода. Восстанавливает убихинон и витамин E. Стимулирует синтез интерферона, следовательно, участвует в иммуномодулировании. Переводит трёхвалентное железо в двухвалентное, тем самым способствует его всасыванию. Тормозит гликозилирование гемоглобина, тормозит превращение глюкозы в сорбит. Дефицит: Принято считать, что среди симптомов нехватки в организме витамина С находятся слабость иммунной системы, кровоточивость дёсен, бледность и сухость кожи, замедленное восстановление тканей после физических повреждений (раны, синяки), потускнение и выпадение волос, ломкость ногтей, вялость, быстрая утомляемость, ослабление мышечного тонуса, ревматоидные боли в крестце и конечностях (особенно нижних, боли в ступнях), расшатывание и выпадение зубов; хрупкость кровеносных сосудов приводит к кровоточивости дёсен, кровоизлияниям в виде тёмно-красных пятен на коже. Однако на сегодня (август 2011) не было проведено достаточного количества исследований, на основании которых можно было бы достоверно утверждать о наличии связи между упомянутыми симптомами и недостатком в организме витамина C. Лишь когда его количество принимает крайне малые значения, проявляются некоторые из перечисленных симптомов, сигнализирующих о возникновении крайне редкого ныне заболевания — цинги. Вит.Р(рутин) Биологическая роль: Совместно с аскорбиновой кислотой P-витамины участвуют в окислительно-восстановительных процессах, а также тормозят действие гиалуронидазы. Повышается концентрация гиалуроновой кислоты, которая увеличивает эластичность капилляров и снижает их проницаемость. Кроме того, они обладают антиоксидантными свойствами и, в частности, предохраняют от окисления аскорбиновую кислоту и адреналин. Снижают свёртывание крови и повышают эластичность эритроцитов. Дефицит: При дефиците витамина P в пище повышается проницаемость капилляров, вследствие чего появляются кровоизлияния в коже, слизистых оболочках и в подкожной клетчатке, особенно в местах, подверженных физическим воздействиям, давлению. Такие кровоизлияния обычно носят мелкий, точечный характер и называются петехиями. Развиваются кровоизлияния в сетчатке глаза; боли в ногах при ходьбе, боли в плечах; быстрая утомляемость; спонтанные кровоизлияния; синюшный оттенок кожи; развитие угревой сыпи; выпадение волос; кровоточивость десен. Пантотеновая кислота: Биологическая роль: В клетках животных и растений пантотеновая кислота входит в состав кофермента A (KoA), принимающего участие в важнейших реакциях обмена веществ. Важнейшим свойством витамин пантотеновой кислоты является ее способность стимулировать производство гормонов надпочечников — глюкокортикоидов, что делает его мощным средством для лечения таких заболеваний как артрит, колит, аллергия и болезни сердца. Витамин играет важную роль в формировании антител, способствует усвоению других витаминов, а также принимает участие в синтезе нейротрансмиттеров. Пантотеновая кислота участвует в метаболизме жирных кислот. Она нормализует липидный обмен и активирует окислительно-восстановительные процессы в организме. Пантотеновая кислота (витамин В5) оказывает мощный репаративный эффект на слизистые. Повышенные дозы пантотеновой кислоты, наоборот, тормозит секреторную функцию желудка. Также пантотеновая кислота стимулирует перистальтику кишечника.[1] Пантотеновая кислота оказывает значительное гиполипидемическое действие, обусловленное, по-видимому, ингибированием биосинтеза основных классов липидов, формирующих в печени липопротеины низкой и очень низкой плотности. Дефицит: Недостаток пантотеновой кислоты в организме приводит к нарушениям обмена веществ, на основе которых развиваются дерматиты, депигментация и потеря волос, шерсти или перьев, прекращение роста, истощение, изменения в надпочечниках и нервной системе, а также расстройства координации движений, функций сердца и почек, желудка, кишечника. При недостатке в организме пантотеновой кислоты в желудке образуется избыток соляной кислоты, что может стать причиной развития язвенно-эрозийных заболеваний желудочно-кишечного тракта. [1] Причиной дефицита витамина могут быть малое содержание в пище белков, жиров, витамина С, витаминов группы В, заболевания тонкого кишечника с синдромом мальабсорбции, а также длительное применение многих антибиотиков и сульфаниламидов. Симптомы гиповитаминоза: усталость депрессия расстройство сна повышенная утомляемость головные боли тошнота мышечные боли жжение, покалывание, онемение пальцев ног жгучие, мучительные боли в нижних конечностях, преимущественно по ночам покраснение кожи стоп диспепсические расстройства язвы 12-перстной кишки При пантотеновой недостаточности снижается сопротивляемость организма к инфекции, часто возникают острые респираторные заболевания. Биотин(вит.Н, В7) Входит в состав ферментов, регулирующих белковый и жировой баланс, обладает высокой активностью. Участвует в синтезе глюкокиназы — фермента, регулирующего обмен сахаров. Является коферментом различных ферментов, в том числе и транскарбоксилаз. Участвует в синтезе пуриновых нуклеотидов. Является источником серы, которая принимает участие в синтезе коллагена[1]. С участием биотина протекают реакции активирования и переноса СО2. Дефицит: При недостатке биотина наблюдаются: поражения кожи рук и ног сухость и нездоровый оттенок кожи бледный гладкий язык сонливость, депрессия болезненность и слабость мышц гипотония высокий уровень холестерина и сахара в крови анемия потеря аппетита и тошнота ухудшение состояния волос замедляется рост. А,Е,К,Д3,F Вит. А(ретинол) Ретиналь является компонентом родопсина — основного зрительного пигмента. В форме ретиноевой кислоты витамин стимулирует рост и развитие. Ретинол является структурным компонентом клеточных мембран, обеспечивает антиоксидантную защиту организма. Дефицит: Недостаток витамина A может произойти из-за первичной или вторичной недостаточности. Первичный дефицит витамина A возникает среди детей и взрослых, которые не потребляют нужное количество каротиноидов из фруктов и овощей или витамина A из животных и молочных продуктов. Ранний отказ от грудного вскармливания может также увеличить риск дефицита витамина A[21]. Вторичный дефицит витамина A связан с хроническим нарушением всасывания липидов, желчеобразования и хроническому воздействию окислителей, таких как сигаретный дым, и хронический алкоголизм. Витамин A — жирорастворимый витамин, и зависит от мицеллярной солюбилизации для дисперсии в тонком кишечнике, что приводит к плохому использованию витамина A при низком содержании жиров. Дефицит цинка также может ухудшать всасывание, транспорт и метаболизм витамина A, поскольку он необходим для синтеза транспортных белков и в качестве кофактора для превращения ретинола в ретиналь. В недоедающих популяциях общее низкое употребление витамина A и цинка усиливают выраженность дефицита витамина A. Исследование, проведённое в Буркина-Фасо, показало значительное снижение заболеваемости малярией среди детей младшего возраста при использовании комбинации витамина A и цинка[22]. Наиболее ранним симптомом гиповитаминоза является куриная слепота — резкое снижение темновой адаптации. Характерными являются поражения эпителиальных тканей: кожи (фолликулярный гиперкератоз), слизистых оболочек кишечника (вплоть до образования язв), бронхов (частые бронхиты), мочеполовой системы (лёгкое инфицирование). Дерматиты сопровождаются патологической пролиферацией, кератинизацией и слущиванием эпителия. Десквамация эпителия слёзных каналов может приводить к их закупорке и уменьшению смачивания роговицы глаза — она высыхает (ксерофтальмия) и размягчается (кератомаляция) с образованием язв и «бельма». Поражение роговицы может развиваться очень быстро, так как нарушение защитных свойств эпителия приводит к вторичным инфекциям. При недостатке витамина также начинается отставание в росте[2]. Надлежащее обеспечение, но не избыток витамина A, особенно важен для беременных и кормящих женщин для нормального развития плода и в грудное молоко[21][23]. Недостатки не могут быть компенсированы послеродовой добавкой[24]. Метаболическая активность витамина ингибируется при употреблении алкоголя во время беременности и характеризуется такой же тератогенностью, что и материнский дефицит витамина A[25]. |